Sulfure d'hydrogène
Le sulfure d'hydrogène, ou hydrogène sulfuré, est un composé chimique de formule H2S, constitué de soufre et d'hydrogène. C'est un gaz inflammable, incolore, à l'odeur nauséabonde d'œuf pourri, très toxique, faiblement soluble dans l'eau en donnant un acide faible, l’acide sulfhydrique. Il réagit avec les solutions aqueuses basiques et les métaux tels que l'argent ou l'acier, même inoxydable.
| Sulfure d'hydrogène | |
  Molécule de sulfure d'hydrogène |
|
| Identification | |
|---|---|
| Nom UICPA | Sulfure d'hydrogène |
| Synonymes |
Hydrogène sulfuré |
| No CAS | |
| No ECHA | 100.029.070 |
| No CE | 231-977-3 |
| FEMA | 3779 |
| Apparence | gaz comprimé liquéfié, incolore, d'odeur caractéristique d'œufs pourris[1]. |
| Propriétés chimiques | |
| Formule | H2S [Isomères] |
| Masse molaire[2] | 34,081 ± 0,005 g/mol H 5,91 %, S 94,09 %, |
| Moment dipolaire | 0,978 33 D[3] |
| Propriétés physiques | |
| T° fusion | −85,5 °C[4] |
| T° ébullition | −60,7 °C[4] |
| Solubilité | 5 g·L-1 (eau, 20 °C)[1] Sol. dans le disulfure de carbone, le méthanol, l'acétone |
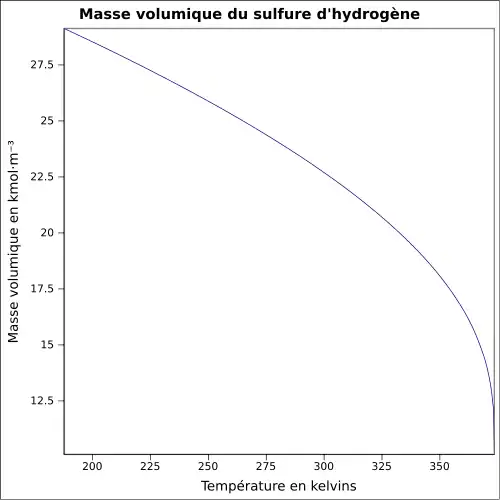
| Masse volumique | 1,539 g·L-1 (0 °C)[4]
|
| T° d'auto-inflammation | 260 °C[1] |
| Point d’éclair | Gaz Inflammable[1] |
| Limites d’explosivité dans l’air | 4,3–46 %vol[1] |
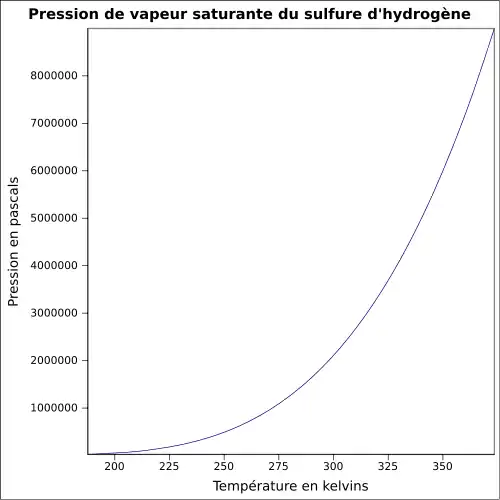
| Pression de vapeur saturante | 1 780 kPa
|
| Point critique | 100,4 °C ; 88,9 atm[4] |
| Vitesse du son | 289 m·s-1 (0 °C, 1 atm)[6] |
| Thermochimie | |
| S0gaz, 1 bar | 205,77 J/mol·K |
| ΔfH0gaz | -20,5 kJ/mol |
| ΔvapH° | 18,67 kJ·mol-1 (1 atm, −59,55 °C) ; 14,08 kJ·mol-1 (1 atm, 25 °C)[7] |
| PCI | 519,1 kJ·mol-1[8] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,457 ± 0,012 eV (gaz)[9] |
| Propriétés optiques | |
| Indice de réfraction | 1,000 644 (1 atm)[4] |
| Précautions | |
| SGH[10] - [11] | |
    Danger |
|
| SIMDUT[12] | |
   A, B1, D1A, D2B, |
|
| NFPA 704 | |
| Transport[11] | |
| Inhalation | Dangereux, les vapeurs sont très irritantes et corrosives. |
| Peau | Les solutions concentrées peuvent provoquer des brûlures. |
| Yeux | Dangereux, peut causer des brûlures |
| Ingestion | Peut causer nausées et vomissements |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,001 ppm haut : 0,13 ppm[13] |
| Unités du SI et CNTP, sauf indication contraire. | |
En biologie
Le sulfure d'hydrogène joue un rôle important en biologie. Il est produit par la dégradation des protéines contenant du soufre et est en grande partie responsable de l'odeur fétide des excréments et des gaz intestinaux, humains et animaux[14].
Il peut résulter de décomposition bactérienne de la matière organique dans des environnements pauvres en oxygène (méthanisation), ou de l'action des bactéries sulfato-réductrices.
Synthèse
La synthèse du sulfure d'hydrogène peut se réaliser en deux étapes :
- en mélangeant du soufre et de la limaille de fer, on réalise un brûlât dans un têt (production d'une fumerolle blanche et âcre), ce qui donne une sorte de caillou orangé (le sulfure de fer(II) (FeS) avec des traces grises (la limaille qui n'a pas réagi) ;
- en versant n'importe quel acide (de préférence de l'acide sulfurique, mais c'est l'ion hydronium qu'on fait réagir) sur le sulfure de fer obtenu à la première étape, il se produit immédiatement un dégagement intense de sulfure d'hydrogène bien reconnaissable à son odeur qualifiée dans les manuels scolaires de « nauséabonde », qui est celle de l'œuf pourri.
On peut également faire réagir du sulfure d'aluminium Al2S3 avec de l'eau, ce qui produit, en plus du H2S, de l'hydroxyde d'aluminium.
Utilisations et industrie
Le sulfure d'hydrogène est naturellement présent dans le pétrole, le gaz naturel, les gaz volcaniques et les sources chaudes. Il peut également provenir de nombreuses activités industrielles.
Les premiers gaz d'éclairage s'avèrent être un mélange redoutable d'hydrogène, de monoxyde de carbone et de sulfure d'hydrogène. Non content de dégager une odeur désagréable d'œuf pourri, le sulfure d'hydrogène ou son produit de combustion le dioxyde de soufre (SO2) attaquent les métaux et les noircissent ; les peintures contenant de la cérusite (PbCO3) sont ainsi altérées. Dans les théâtres où le gaz de houille est utilisé, il flétrit toutes les peintures, et peut dans le cours d'une année, détruire toutes les décorations et les ornements les plus coûteux[15] ; dans les magasins ou bibliothèques, on signale des effets corrosifs sur les tissus, les reliures ainsi que sur les couleurs[16]. En 1860, le London Gaz Act fixe des taux limites de sulfure d'hydrogène qu'il fallut relever, les compagnies n'arrivant pas à les atteindre[17].
Le sulfure d'hydrogène est produit par de nombreuses industries, par exemple dans la transformation des produits alimentaires, le traitement des eaux usées, les hauts fourneaux, la papeterie, la tannerie, le raffinage du pétrole. Il est également présent dans le gaz naturel et le pétrole, desquels il est généralement retiré industriellement avant leur traitement.
En chimie organique, le sulfure d'hydrogène peut être utilisé pour produire des composés organosulfurés tels que le méthanethiol, l'éthanethiol ou encore l'acide thioglycolique.
Il réagit avec les métaux alcalins pour donner des hydrosulfures et des sulfures alcalins, tels que l'hydrosulfure de sodium NaHS et le sulfure de sodium Na2S, qui sont utilisés dans la dégradation des biopolymères. D'une manière générale, le sulfure d'hydrogène réagit avec les métaux pour donner le sulfure métallique correspondant. Cette propriété est mise à profit dans le traitement de gaz ou d'eau contaminés par le sulfure d'hydrogène. La purification de minerais métalliques par flottation, les poudres minérales sont souvent traitées au sulfure d'hydrogène pour accroître la séparation. Les pièces métalliques peuvent également être passivées au sulfure d'hydrogène.
Les catalyseurs utilisés en hydrodésulfuration sont couramment activés par le sulfure d'hydrogène, et ce dernier modifie également le comportement des catalyseurs métalliques utilisés dans d'autres équipements d'une raffinerie.
En chimie analytique, il a joué un rôle important pendant plus d'un siècle pour caractériser les ions métalliques en analyse qualitative non-organique. Dans ce type d'analyses, les ions de métaux lourds (et de non-métaux), tels que Pb2+, Cu2+, Hg2+, ou As3+, en solution précipitent en présence d'H2S. Les composants des précipités qui en résultent se dissolvent à nouveau sélectivement.
À l'échelle du laboratoire, le thioacétamide a supplanté le sulfure d'hydrogène comme source d'ions sulfure.
Le sulfure d'hydrogène est utilisé pour séparer l'eau lourde D2O de l'eau normale par le procédé de Girdler.
Supraconduction
Une équipe de chercheurs allemands a battu le record de température la plus haute pour un matériau supraconducteur en 2015 : −70 °C[18]. Il aura été nécessaire de comprimer le sulfure d'hydrogène à 1,5 million de bars dans une cellule à enclumes de diamant.
Corrosion des métaux
Ce gaz peut s'accumuler dans les réseaux d'assainissement (gaz d'égout) et corroder les tuyaux qu'ils soient en béton ou en métal. Il peut faire suffoquer les égoutiers. Lorsqu'il est présent dans le gaz naturel, il corrode les matériels traditionnels tels que les tuyaux, les vannes, etc. Il faut alors remplacer les matériaux usuels par de l'Inconel (en milieu anhydre), ce qui n'est pas sans conséquence sur le prix des installations.
Il attaque également l'argent ; c'est la raison pour laquelle les bijoux argentés noircissent lorsqu'ils sont longuement exposés à l'atmosphère polluée. Le sulfure d'argent résultant de la réaction est de couleur noire.
Effets sur la santé
Le coup de plomb des vidangeurs dont on rencontre la description dans des manuels de médecine du XVIIIe siècle et du XIXe siècle n'est autre qu'une asphyxie au sulfure d'hydrogène. Les fosses d'aisances maintenues closes sont alors le siège de décompositions et de fermentations anaérobies qui génèrent le dangereux gaz[19] qui causait quelquefois la mort des ouvriers vidangeurs ou d'autres personnes qui approchaient de trop près des fosses[20]. En attendant qu'on en connaisse la nature, à partir du XIXe siècle, le gaz qui s'échappe des fosses prend les noms de « vapeur méphitique », « plomb », « mofette» (de même racine que méphitique), « moufette » (avant les mammifères réputés pour leurs sécrétions) et on désignait par « fosse empoisonnée » ou « fosse plombée », les fosses qui renfermaient l'air pestilentiel pendant ou après sa vidange. Le nom de « plomb » provenait du fait que l'asphyxie consécutive à l'exposition « aux gaz méphitiques » des fosses s'accompagnait d'un sentiment d’oppression, comme un poids énorme qui comprimerait la poitrine. Les pathologies associées au sulfure d'hydrogène sont décrites avec beaucoup de détails[21]. Le coup de plomb correspond à une intoxication suraiguë — H2S supérieur à 700 ppm —, perte subite de conscience, quelques convulsions et dilatation pupillaire[19]. Des précautions sont à prendre pour les égoutiers qui sont aussi susceptibles d'être exposés au H2S[22]. Le 31 mars 2021, huit hommes sont morts intoxiqués par ce gaz dans la fosse septique d'une prison en Algérie[23].
Le sulfure d'hydrogène est considéré comme un poison à large spectre. Il peut donc empoisonner différents organes. L'inhalation prolongée de sulfure d'hydrogène peut causer la dégénérescence du nerf olfactif et provoquer la mort juste après quelques mouvements respiratoires. L'inhalation du gaz, même en quantité relativement faible, peut entraîner une perte de connaissance. À partir d'un faible seuil, l'exposition à l'hydrogène de sulfure entraîne une paralysie olfactive, et il est conseillé de ne pas se fier à son odorat pour déceler des teneurs supérieures à 10 ppm[24].
L'exposition à des concentrations inférieures peut avoir comme conséquence des irritations des yeux, de la gorge, une toux douloureuse, un souffle court et un épanchement de fluide dans les poumons. Ces symptômes disparaissent habituellement en quelques semaines. L'exposition à long terme à de faibles concentrations peut avoir pour conséquence : fatigue, perte d'appétit, maux de tête, irritabilité, pertes de mémoire et vertiges.
Dans certaines conditions, une production endogène de H2S est possible dans l'intestin (ainsi que d'amines, phénols, indoles, thiols, CO2, H2) par les bactéries intestinales ; ces métabolites sont tous toxiques et pourraient jouer un rôle dans certaines maladies intestinales[25].
Les études sur des animaux ont prouvé que les porcs ayant mangé de la nourriture contenant du sulfure d'hydrogène ont eu des diarrhées après quelques jours et une perte de poids après environ 105 jours.
En 2005, Mark Roth, biochimiste de l'Université de Washington à Seattle, a montré que des souris inhalant durant quelques minutes une faible dose de sulfure d'hydrogène (80 ppm) perdent connaissance et sont plongées dans un état de vie suspendue[26], leur température chute de 37 à 25 °C environ[27] et leur respiration est ralentie (de 120 à moins de 10 respirations par minute). Leur métabolisme est ralenti et leurs cellules consomment alors moins d'oxygène. Après six heures, les souris ont été réexposées à un air normal et se sont réveillées en bonne santé. Dans ce cas, les chercheurs n'ont noté aucun effet secondaire évident. Cela laisse penser « qu'il est possible de baisser le niveau métabolique à la demande » selon Roth, qui ajoute que bien que ces découvertes puissent avoir des implications dans le domaine de l'exploration spatiale, son équipe travaille d'abord sur des débouchés médicaux[28].
Ce pourrait aussi être un moyen de limiter les effets de stress oxydant induit par les radiations lors de vols spatiaux longs[29]. Les blindages anti-rayonnement cosmique sont lourds et couteux, aussi recherche-t-on des alternatives chimiques et biologiques[29]. Des gaz médicaux radioprotecteurs pouvant piéger les radicaux libres sont une piste (le CO, H2, NO, et le gaz H2S sont étudiés dans cet espoir, visant aussi à limiter des maladies impliquant le stress oxydatif (maladies cardiovasculaires ou inflammatoire chronique, hypertension, ischémie, cancer, maladie de Parkinson, maladie d'Alzheimer, cataractes, et vieillissement)[29]. Le traitement pourrait passer par l'inhalation de mélanges gazeux ou par l'ingestion d'eau avec des gaz dissous[29].
Relation odeur-santé
Le seuil de toxicité du sulfure d'hydrogène est de 14 mg m−3, tandis que son seuil de perception olfactive chez l'homme est de 0,000 66 mg m−3 soit (0,000 4 ppm), c'est-à-dire que notre système olfactif est capable de détecter cette substance en très faible quantité. Ceci nous permet d'être alerté avant une absorption pouvant être toxique, à condition que l'accroissement de la concentration de gaz ne soit pas instantanée (cas des poches de gaz dans les réseaux d'assainissement).
Cependant, à partir d'un certain seuil, facile à atteindre (100 à 150 ppm), le nerf olfactif est paralysé et le sujet ne sent plus rien.
Effets du sulfure d’hydrogène sur les humains, selon la concentration
- 4 ppm : odeur modérée, facilement détectable
- 10 ppm : irritation des yeux, seuil de sécurité fixé pour une exposition en atelier[24]
- 27 ppm : odeur désagréable
- 100 ppm : toux, irritation des yeux, perte de l’odorat au bout de 2 à 15 minutes
- 200-300 ppm : inflammation des yeux et irritation de l’appareil respiratoire au bout d’une heure
- 500-700 ppm : perte de conscience et mort éventuelle au bout de 30 à 60 minutes
- 800-1 000 ppm : perte de conscience rapide, arrêt de la respiration et mort
- > 1 000 ppm : paralysie du diaphragme dès la première inhalation, asphyxie rapide[30].
Suicides au Japon
Début 2008, le sulfure d'hydrogène est mentionné dans beaucoup de cas de suicides au Japon.
De janvier à fin , 517 personnes se sont donné la mort grâce à une recette trouvée sur internet[31], mélangeant détergents et produits pour le bain, ce qui produirait du sulfure d'hydrogène en forte quantité. Plusieurs bâtiments ont dû être évacués pour ne pas intoxiquer plus de monde.
Émanations dues aux échouages d'algues
Des échouages massifs d'algues (« marées vertes ») ont tendance à produire du sulfure d'hydrogène : l'accumulation des algues en forte épaisseur cause une fermentation anaérobique provoquant alors la réduction des sulfates contenus naturellement dans l'eau de mer (environ 2,7 g l−1) et la combinaison du soufre avec l'hydrogène de l'eau pour former du sulfure d'hydrogène.
Ainsi en , un cheval est mort des suites d'inhalation de sulfure d'hydrogène sur les plages bretonnes. En effet, l'amoncellement important d'algues vertes en décomposition, en partie dû à l'eutrophisation, a créé une forte concentration d'hydrogène sulfuré (1 000 ppm) qui s'est révélée mortelle pour l'animal. Le cavalier a été sauvé de justesse. À la fin du mois de , ce sont 36 sangliers qui sont retrouvés morts à Hillion, au niveau de l'estuaire du Gouessant. L'hydrogène sulfuré a été retrouvé dans les poumons d'au moins cinq d'entre eux[32]. Deux études concluent qu'ils ont été intoxiqués par du sulfure d'hydrogène lié à la décomposition des algues vertes[33]. On considère qu'un être humain peut survivre seulement une minute dans un air à 1 400 ppm d'hydrogène sulfuré[34]. En 2016, c'est ce même gaz qui a provoqué le décès d'un joggeur là-encore dans l'estuaire du Gouessant, à Hillion[35]. La Bretagne n'est pas la seule région touchée par la prolifération des algues vertes : on en trouve également en bordure de l'étang de Berre.
Dans les Caraïbes, l'échouage massif de sargasses provoque également de fortes émissions de sulfure d'hydrogène, agissant à la fois sur la santé humaine et sur la détérioration des appareils électroménagers.
Rôle hypothétique dans l'extinction permo-triasique
Peuplée de créatures essentiellement reptiliennes, la Terre connait un bouleversement majeur dû à un réchauffement climatique il y a 250 Ma. Ce réchauffement de l'atmosphère provoque le ralentissement, voire l'arrêt total des courants océaniques qui sont alimentés par la descente en profondeur de l'eau froide aux pôles. L'arrêt des courants océaniques a pour conséquence essentielle la stagnation des océans. Puisque ces courants apportent de l'oxygène et des nutriments nécessaires à la vie marine, la plupart des créatures marines meurent et tombent au fond des océans. La décomposition de ces animaux morts dégage d'énormes quantités de sulfure d'hydrogène qui remontent à la surface et viennent empoisonner l'atmosphère. Les animaux terrestres sont donc affectés et sont aussi décimés. Cette période de la vie terrestre est nommée extinction du Permien. Malgré tout, les causes menant à l'extinction permo-triasique restent mal définies. L'explication du sulfure d'hydrogène reste une hypothèse à corréler à d'autres.
Incident majeur
Le , à Moscou, le dysfonctionnement d'un filtre dans une raffinerie de Gazprom a provoqué une forte concentration de gaz dans l'atmosphère, six fois supérieure à la norme[36] - [37]. Un épais nuage a enveloppé la ville. Les autorités ont demandé aux habitants de fermer leurs portes et leurs fenêtres pour se prémunir des odeurs désagréables.
Notes et références
- SULFURE D'HYDROGENE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of Chemistry and Physics, CRC, , 89e éd., 2736 p. (ISBN 142006679X et 978-1420066791), p. 9-50.
- (en) Pradyot Patnaik, Handbook of Inorganic Chemicals, McGraw-Hill, , 1086 p. (ISBN 0-07-049439-8), p. 379.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- (en) W. M. Haynes, Handbook of Chemistry and Physics, CRC, 2010-2011, 91e éd., 2610 p. (ISBN 978-1-4398-2077-3), p. 14-40.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0).
- Magalie Roy-Auberger, Pierre Marion, Nicolas Boudet, Gazéification du charbon, éd. Techniques de l'Ingénieur, réf. J5200, 10 décembre 2009, p. 4.
- (en) David R. Lide, Handbook of Chemistry and Physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 [PDF] (16 décembre 2008).
- « Sulfure d'hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- (en) « Hydrogen sulfide », sur hazmap.nlm.nih.gov (consulté le ).
- (en) FL Suarez, J Springfield et MD Levitt, « Identification of gases responsible for the odour of human flatus and evaluation of a device purported to reduce this odour », Gut, vol. 43, no 1, , p. 100-104.
- Jacques-Auguste Kaufmann, V. Le Blanc et Ollivier, Adam, Architectonographie des théâtres : seconde série : théâtres construits depuis 1820. Détails et machines théâtrales. Mathias, 1840 (lire en ligne)
- Charles Adolphe Wurtz et Jules Bouis, Dictionnaire de chimie pure et appliquée : comprenant la chimie organique et inorganique, la chimie appliquée à l'industrie, à l'agriculture et aux arts, la chimie analytique, la chimie physique et la minéralogie, vol. 2, Hachette, 1870 (lire en ligne)
- Robert Hogarth Patterson (en), Gas Purification in London, including a Complete Solution of the Sulphur Question, Édimbourg, 1873, 2e éd. 1874
- Nathalie Mayer, « Record : du sulfure d’hydrogène devient supraconducteur dès −70 °C », Futura-Sciences, (lire en ligne, consulté le ).
- « Hydrogène sulfuré H2S », sur forsapre.fr.
- Morisot J.M., Tableaux détaillés des prix de tous les ouvrages du bâtiment, Carilian, 1814, lire en ligne
- Emmanuel-Cyprien-Alphonse Desplas, Essai sur les asphyxies des égouts et des fosses d'aisance ; tribut académique, etc. 1834, lire en ligne
- Précautions, sur u-picardie.fr
- https://www.elwatan.com/a-la-une/drame-au-centre-penitentiaire-de-bejaia-01-04-2021
- INRS, « Sulfure d'hydrogène - Fiche toxicologique n°32 », sur inrs.fr,
- (en) Macfarlane GT et Macfarlane S., Bacteria, colonic fermentation, and gastrointestinal health, J. AOAC Int., janvier-février 2012, 95(1):50-60 (résumé).
- « Hibernation : ceci n'est pas Walt Disney », sur Agence Science-Presse.
- Mark Roth, « Roth Lab ».
- « Des boules puantes mettent des souris en animation suspendue », sur Futura-Sciences.
- (en) Schoenfeld MP, Ansari RR, Nakao A et Wink D, A hypothesis on biological protection from space radiation through the use of new therapeutic gases as medical counter measures, Med. Gas Res., 4 avril 2012, 2(1):8 (résumé).
- Ministère de l'Agriculture, de l'Alimentation et des Affaires rurales, mai 2014 Les gaz dangereux dans les exploitations agricoles
- Gaz mortel au levant [PDF], Le quotidien du médecin, no 8376, 23 mai 2008.
- Damien Meyer / AFP, « De l'hydrogène sulfuré a été retrouvé sur cinq des sangliers morts en Bretagne », Le Point, (lire en ligne).
- Marielle Court, « Les algues vertes coupables de la mort des sangliers », Le Figaro, (lire en ligne
 , consulté le ).
, consulté le ). - Le Figaro, Le Figaro - Sciences : Algues vertes : le risque pour l'homme est confirmé, 20 août 2009.
- « Algues vertes. « Le joggeur d’Hillion est décédé d’une intoxication » », sur Ouest-France.fr, (consulté le )
- « Moscou frappée par une forte pollution au sulfure d'hydrogène » [vidéo], sur francetvinfo.fr
- « L'air de Moscou empli d'une forte concentration de sulfure d'hydrogène », sur rtbf.be
Voir aussi
Articles connexes
Bibliographie
- R. Molinero et R. Fagegaltier, 6. « Étude du comportement volumétrique et des conditions de formation d’hydrates d’un gaz naturel contenant une forte proportion d’hydrogène sulfuré », 4th World Petroleum Congress, .
Liens externes
- Ressources relatives à la santé :
- Notices dans des dictionnaires ou encyclopédies généralistes :