Éthanethiol
L'éthanethiol ou mercaptan éthylique (sa dénomination commune) ou SultanT est un liquide incolore, de la famille des thiols (ou mercaptans). Il peut être présent dans les pétroles et gaz naturels riches en soufre (qui doivent alors être nettoyés avant d'être vendus).
| Éthanethiol | |||
| |||
  |
|||
| Identification | |||
|---|---|---|---|
| Synonymes |
Mercaptan éthylique |
||
| No CAS | |||
| No ECHA | 100.000.762 | ||
| No CE | 200-837-3 | ||
| FEMA | 4258 | ||
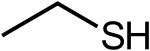
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur âcre[1]. | ||
| Propriétés chimiques | |||
| Formule | C2H6S [Isomères] |
||
| Masse molaire[2] | 62,134 ± 0,007 g/mol C 38,66 %, H 9,73 %, S 51,61 %, |
||
| Propriétés physiques | |||
| T° fusion | −144,4 °C[1] | ||
| T° ébullition | 35 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 6,8 g·l-1[1] | ||
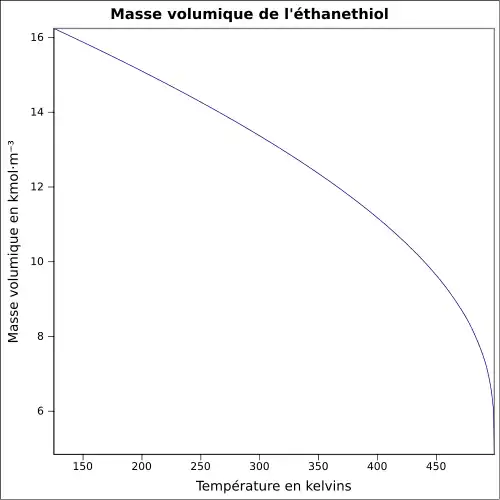
| Masse volumique | 0,839 g·cm-3[1], 2,14 g·cm-3 (air) |
||
| T° d'auto-inflammation | 299 °C[1] | ||
| Point d’éclair | −48,3 °C[1] | ||
| Limites d’explosivité dans l’air | 2,8–18,2 %vol[1] | ||
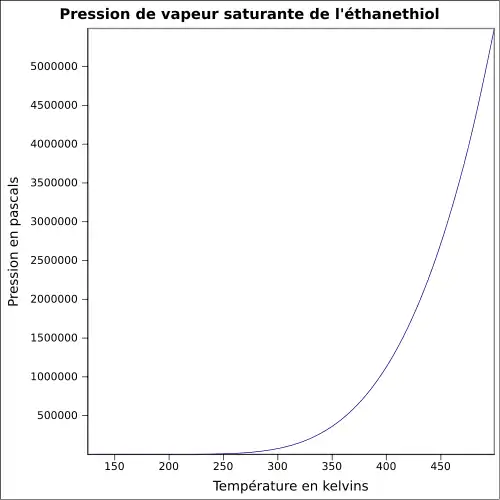
| Pression de vapeur saturante | à 20 °C : 58,9 kPa[1]
|
||
| Viscosité dynamique | 0,297 mPa.s (à 25 °C) | ||
| Tension de surface | 23 N/m (à 25 °C) | ||
| Énergie de 1re ionisation | 9,31 eV pour environ 1000 molécules | ||
| Enthalpie de formation d'ion | 851 kJ/mol (à 25 °C) | ||
| Point critique | 54,9 bar, 225,85 °C [4] | ||
| Thermochimie | |||
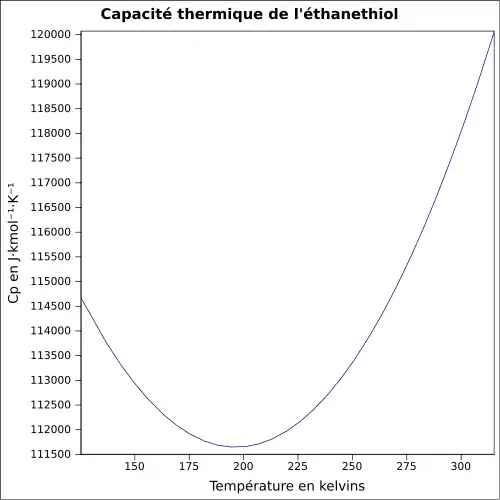
| Cp | |||
| Propriétés électroniques | |||
| 1re énergie d'ionisation | 9,31 ± 0,03 eV (gaz)[6] | ||
| Propriétés optiques | |||
| Indice de réfraction | 1,431 (à 20 °C) | ||
| Précautions | |||
| SGH[7] | |||
   Danger |
|||
| SIMDUT[8] | |||
 B2, |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Inhalation | Idem ingestion | ||
| Peau | Peut provoquer des rougeurs | ||
| Yeux | Idem | ||
| Ingestion | Vertiges, maux de tête, nausées, vomissements, perte de conscience. | ||
| Autres infos | Peut former du monoxyde de carbone, des oxydes de soufre et du sulfure d'hydrogène lors de sa combustion. Réagit avec les oxydants en provoquant des risques d'incendie et d'explosion. Réagit vigoureusement avec les acides forts et les bases en provoquant des risques d'intoxication. | ||
| Écotoxicologie | |||
| LogP | 1,5[1] | ||
| Seuil de l’odorat | bas : 9,8×10-5 ppm haut : 0,003 ppm[9] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il a une forte odeur évoquant selon les teneurs l'œuf pourri, l'ail et l'oignon. L'odeur de ce gaz à l'état de traces est familière en France à ceux qui utilisent le gaz naturel ou le propane dans leur gazinière, car il est utilisé à l'état de trace comme additif dans ces gaz, normalement inodores, pour leur adjoindre une odeur spécifique facilitant la détection de fuites.
La formule chimique de l'éthanethiol est C2H5SH
Selon le Livre Guinness des records, édition 2000, l'éthanethiol serait la « substance la plus puante » du monde.
L'éthanethiol est le produit odorant volatil issu de l'éthionine contenue dans la pulpe et qui donne au durian son odeur nauséabonde[10].
Toxicité, écotoxicité
L'éthanethiol est toxique et écotoxique à partir d'une certaine dose. Chez l'humain, il cause des maux de tête, des nausées ainsi qu'un manque de coordination, puis des dommages au foie et aux reins pouvant conduire à la mort. Les traces de ce gaz adjointes au gaz naturel ne sont pas réputées dangereuses.
Sa valeur limite d'exposition (VLE) en France est de 0,5 ml/m³. Sa limite de détection olfactive est d'environ 0,002 ppm.
La dose létale pour l'être humain n'est pas connue (par manque de retour d'expérience), mais il existe des données pour les rats et souris.
Risques d'inflammation ou explosion
L'éthanethiol est un acide faible et est soluble dans l'eau, l'éthanol et le benzène.
Il réagit violemment avec les acides et les bases fortes ainsi que les oxydants au point qu'une telle réaction peut provoquer un incendie ou une explosion.
Ses produits de la combustion sont toxiques (monoxyde de carbone, oxydes de soufre…) En cas d'incendie, il est recommandé d'utiliser du dioxyde de carbone ou des mousses d'alcool pour éteindre le feu. L'usage d'eau est déconseillé car l'éthanethiol peut réagir à haute température et former du sulfure d'hydrogène.
Voir aussi
- Thiol
- Méthanethiol
- 1-butanethiol
- Butyl séléno-mercaptan
Liens externes
Références
- ETHANETHIOL, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 0-88415-857-8)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Éthylmercaptan » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- « Ethanethiol », sur hazmap.nlm.nih.gov (consulté le )
- « Pourquoi le durian a-t-il une odeur nauséabonde ? », sur https://www.sciencesetavenir.fr, (consulté le )