Propane
Le propane est un alcane linéaire de formule C3H8. On parle de biopropane s'il est d'origine non fossile.
| Propane | |
   Molécule de propane. |
|
| Identification | |
|---|---|
| Nom UICPA | propane |
| Synonymes |
n-propane |
| No CAS | |
| No ECHA | 100.000.753 |
| No CE | 200-827-9 |
| PubChem | 6334 |
| SMILES | |
| InChI | |
| Apparence | gaz comprimé liquéfié, inodore, incolore[1] |
| Propriétés chimiques | |
| Formule | C3H8 [Isomères] |
| Masse molaire[2] | 44,095 6 ± 0,003 g/mol C 81,71 %, H 18,29 %, |
| Moment dipolaire | 0,084 ± 0,001 D[3] |
| Propriétés physiques | |
| T° fusion | −187,63 °C[4] - [5] |
| T° ébullition | −42,1 °C[5] |
| Solubilité | 75 mg l−1 (eau, 20 °C)[5] |
| Paramètre de solubilité δ | 13,1 MPa1/2 (25 °C)[6] |
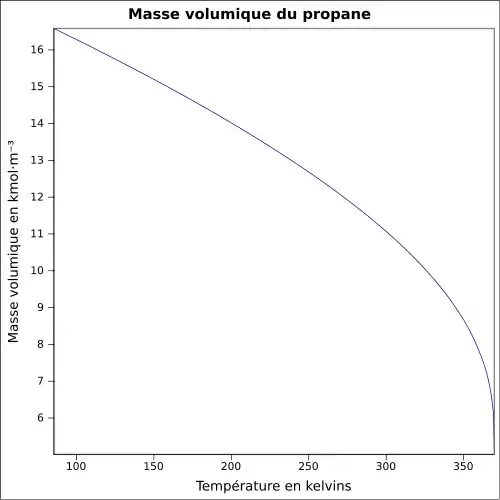
| Masse volumique | 2,009 8 kg m−3 (0 °C, 1 015 mbar, gaz) 0,581 2 kg l−1 (−42,1 °C, 1 015 mbar, liquide)[5] |
| T° d'auto-inflammation | 470 °C[5] |
| Point d’éclair | −104 °C[5] |
| Limites d’explosivité dans l’air | 1,7–10,8 %vol 31–202 g m−3[5] |
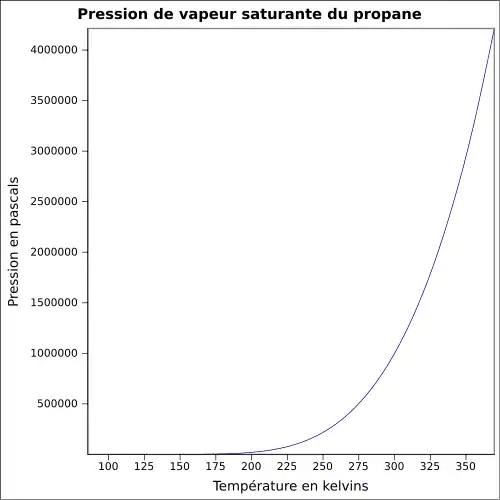
| Pression de vapeur saturante | 8,327 bar à 20 °C 10,8 bar à 30 °C 17,081 bar à 50 °C[5] |
| Point critique | 96,75 °C, 42,5 bar, 0,2 l−1 mol−1[8] |
| Point triple | 1,685×10-9 bar à −188,15 °C[8] |
| Vitesse du son | 1 158 m s−1 (liquide, −42,1 °C)[9] |
| Thermochimie | |
| S0liquide, 1 bar | 171,0 J mol−1 K−1[8] |
| ΔfH0gaz | −104,7 kJ mol−1[8] |
| ΔfH0liquide | −119,8 kJ mol−1[8] |
| ΔvapH° | 16,25 kJ mol−1 à 25 °C 18,774 kJ mol−1 à −42,11 °C[8] |
| Cp | 73,6 J mol−1 K−1 (25 °C, gaz) 98,36 J mol−1 K−1 (−43,15 °C, liquide)[8] |
| PCS | 2 195,9 kJ mol−1[11] |
| PCI | 2 028,37 kJ mol−1[11] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,95 ± 0,05 eV (gaz)[12] |
| Précautions | |
| SGH[13] | |
  Danger |
|
| SIMDUT[14] | |
  A, B1, |
|
| NFPA 704 | |
| Transport | |
| Écotoxicologie | |
| LogP | 2,36[1] |
| Seuil de l’odorat | bas : 12 225 ppm haut : 20 005 ppm[15] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il est essentiellement aujourd'hui dérivé d'autres produits pétroliers par des processus de thermochimie de gaz ou de pétrole, mais commence aussi à être dérivé du biogaz. Il est couramment utilisé comme source d'énergie chimique par combustion dans les moteurs à combustion interne, chaudières, barbecue.
Il est généralement vendu à l'état liquide, sous forme de GPL notamment (c'est l'un de ses constituants principaux). Un additif, l'éthanethiol, est utilisé comme odorant pour signaler les fuites éventuelles.
Utilisation
Le propane est principalement utilisé comme combustible et carburant (c'est le principal composant du gaz de pétrole liquéfié).
Dans l'industrie, il est également utilisé comme réactif pour :
- la production de l'éthylène et du propène au moyen du vapocraquage ;
- dans la synthèse du tétrachloroéthylène et du tétrachlorométhane par chlorolyse ;
- (depuis peu) pour synthétiser (par conversion catalysée sur zéolithe) du benzène, du toluène et du xylène[16] ;
- (depuis peu) en alternative ou complément à la fracturation hydraulique pour la fracturation et la stimulation de roches-réservoir afin d'en extraire du gaz naturel (gaz de schiste) selon une méthode développée par GasFrac[17], une petite compagnie gazière basée à Calgary (Alberta), spécialisée dans la fracturation hydraulique, qui cherchait une solution aussi efficace, mais moins consommatrice d'eau[18]. Le propane (on utilise aussi parfois de l'azote, ou un mélange de gaz) s'insinue mieux et plus loin dans les microfissures de la roche, et en ressort plus facilement que l'eau. C'est cependant un fluide beaucoup plus dangereux à manipuler que l'eau.
Une oxydation catalytique est possible en utilisant du platine ou du palladium comme catalyseurs[19]. Parce que le propane est une matière première bon marché et abondante, son oxydation sélective en monomères (propylène[20] - [21] - [22] - [23], acide acrylique[24] - [25] - [26] - [27]) est étudiée intensivement.
Propriétés physico-chimiques
Le propane est un gaz plus dense que l'air (1,5 fois) dans les conditions normales de température et de pression, il forme donc des poches au sol dans une pièce remplie d'air. Il se décompose à partir d'une température supérieure à 780–800 °C[5].
La combustion du propane est plus propre que celle de l'essence (grâce à son rapport H/C avantageux), mais significativement plus polluante que celle du méthane ou de l'hydrogène. La présence de liaisons C-C crée des résidus organiques en plus de la vapeur d'eau et du dioxyde de carbone. Ces produits rendent la flamme visible.
Production et synthèse
Le propane est principalement issu de la purification du gaz naturel ou de la séparation des gaz de pétrole liquéfiés (propane et butane) provenant de la distillation du pétrole brut[28] - [16].
Effets sur le climat
La Terre en libère une mégatonne par an dans l'atmosphère[29], par comparaison la consommation mondiale de GPL et de ses dérivés s'élève à 275 Mt/an.
Il est important de noter que le propane n'est pas considéré comme un gaz à effet de serre (GES), alors que le méthane l'est. Par conséquent, l'effet sur le climat du propane est limité à l'effet du dioxyde de carbone et autres GES émis par sa combustion et sa production. Dans le cas du méthane, il faut ajouter l'émission du gaz lui-même, par exemple par le bétail mais aussi par fuites à toutes les étapes de l'extraction à la consommation.
Biopropane
Le biopropane est un gaz issu de biomasse, ayant la même composition chimique que le propane du commerce, donc à ne pas confondre avec le méthane.
Dans le cas de la première raffinerie européenne de Neste à Rotterdam, il s'agit d'un coproduit de la production du biodiesel à partir de 68 % de déchets industriels (huiles de cuisson, résidus de graisse animale (provenant principalement d'Asie, mais aussi d’Europe et de France) et huiles végétales (colza et huile de palme qui constituent les 32 % restants du mélange)[30]) - [31].
Selon les analyses de cycle de vie commandées par Primagaz (évaluée durant un an avec l'ADEME) « Le biopropane émet 60 g de CO2 équivalent/kWh [16,7 g/MJ], soit environ 78 % de moins que les énergies fossiles de référence […] 36 g de CO2 éq/kWh [10 g/MJ] sont dus à l’approvisionnement en biomasse, 22 g [6,1 g/MJ] à la fabrication, 0,5 g [0,14 g/MJ] au transport maritime et 1,5 g [0,42 g/MJ] à la distribution […] le fioul émet cinq fois plus de CO2 équivalent » que le biopropane, faisant de ce dernier « le combustible le moins émissif du marché […] Le biopropane de Primagaz est produit à Rotterdam en Hollande, par Neste, avec qui SHV Energy a conclu un partenariat d’exclusivité portant sur la production de 40 000 t de biopropane par an dès 2018 »[30]. La moitié des projets de construction de maisons individuelles desservies par Primagaz le seront en biopropane dès 2019 selon Primagaz, de même, probablement, que certains éco-quartiers habitats sociaux en projet. Tout le territoire, dont les 27 000 communes non desservies par le réseau gazier, y aura potentiellement accès. En outre, une bouteille de gaz biopropane est prévue avant la fin 2018. En 2018, Primagaz envisage d'intégrer 8 % de biopropane dans le GPL de 1 750 stations françaises, mais n'importera en 2020 que 3 % de ses ventes[31].
Économie

Le propane est utilisé dans des citernes, aériennes ou enterrées, et remplies une ou plusieurs fois par an par des fournisseurs, appelés propaniers. La citerne est généralement mise à disposition gratuitement en échange d'un engagement sur plusieurs années.
En France, le marché du gaz propane est un oligopole[32] entre Antargaz (Anciennement Antargaz-Finagaz[33]), Butagaz, Primagaz et, dans une moindre mesure, Vitogaz.
Les fournisseurs facilitent l'accès au gaz en installant des citernes dans les logements qui ne sont pas reliés au gaz de ville (gaz naturel). Il existe aussi des citernes de fioul, mais le propane est une énergie plus propre à consommer lors de sa combustion.
Notes et références
- PROPANE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- D. Lide, Handbook of Chemistry, 2004-2005.
- Entrée « Propane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 20 avril 2009 (JavaScript nécessaire).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Propane », sur nist.gov (consulté le ).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 91e éd., 2610 p. (ISBN 9781439820773, présentation en ligne), p. 14-40.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub., , 396 p. (ISBN 0-88415-857-8).
- Les gaz Butane Propane
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- « Propane » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- « Propane », sur hazmap.nlm.nih.gov (consulté le ).
- Karl Griesbaum, Arno Behr, Dieter Biedenkapp, Heinz-Werner Voges, Dorothea Garbe, Christian Paetz, Gerd Collin, Dieter Mayer et Hartmut Höke, Ullmann's Encyclopedia of Industrial Chemistry, Hydrocarbons, Wiley-VCH Verlag,
- Portail de l'entreprise Gasfrac
- Brino, A. et Albany, N. (2011), New Waterless Fracking Method Avoids Pollution Problems, But Drillers Slow to Embrace It [PDF], Insideclimatenews.org., 5 p.
- Tang, W., Xiao, W., Wang, S., Ren, Z., Ding, J. et Gao, P. X. (2018), Boosting catalytic propane oxidation over PGM-free Co 3 O 4 nanocrystal aggregates through chemical leaching: A comparative study with Pt and Pd based catalysts, Applied Catalysis B: Environmental.
- (es) Juan Pablo Hernández, Adriana Echavarría et Luz Amparo Palacio, « Synthesis of two new Nickel and Copper- Nickel vanadates used for propane oxidative dehydrogenation », Revista Facultad de Ingeniería Universidad de Antioquia, (ISSN 0120-6230, lire en ligne)
- (en) « Oxidative dehydrogenation of propane with N2O over zeolite Cr/FeZSM-5 », Ing. compet., vol. 15, (lire en ligne)
- (en) « EFFECT OF VANADIUM IN CATALYSTS DERIVED FROM HYDROTALCITE-LIKE MATERIALS IN OXIDATIVE DEHIDROGENATION OF PROPANE », Revista Colombiana de Química, (lire en ligne)
- (en) « PROMOTING EFFECT OF Mo ON Pd / γ-Al2O3 SUPPORTED CATALYSTS IN THE OXIDATIVE DEHYDROGENATION OF PROPANE », Dyna rev.fac.nac.minas, (lire en ligne [PDF])
- (en) Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts, (lire en ligne)
- (en) « The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts », Journal of Catalysis, vol. 311, , p. 369-385 (lire en ligne)
- (en) « Multifunctionality of Crystalline MoV(TeNb) M1 Oxide Catalysts in Selective Oxidation of Propane and Benzyl Alcohol », ACS Catalysis, , p. 1103-1113 (lire en ligne)
- (en) « Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid », Journal of Catalysis, vol. 285, , p. 48-60 (lire en ligne)
- La fabrication du fioul, sur FioulMarket.fr (consulté le 23 août 2012).
- Science et Vie, On sait ce que la Terre dégaze d’hydrocarbures, no 1098, mars 2009, p. 34.
- Eva Gomez, « Primagaz lance le biopropane en France », sur environnement-magazine.fr, .
- Aurélie Barbaux, « Primagaz lance le biopropane en France », (consulté le ).
- « 14ème législature », sur questions.assemblee-nationale.fr
- « Total va céder sa filiale Totalgaz à Antargaz », sur Les Echos, (consulté le )