Paraquat
Le paraquat, également appelé gramoxone, est un herbicide produit à des fins commerciales à partir de 1961 par Imperial Chemical Industries (devenu Syngenta). Il appartient à la famille chimique des pyridines, qui comprend d'autres produits phytosanitaires possédant des propriétés similaires.
| Paraquat | ||
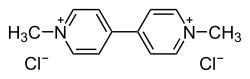
| ||
 | ||
| Représentation 3D de la molécule | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,1’–diméthyl-4,4’-bipyridinium | |
| Synonymes |
Gramoxone |
|
| No CAS | ||
| No ECHA | 100.016.015 | |
| No CE | 225-141-7 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre blanche | |
| Propriétés chimiques | ||
| Formule | C12H14N2 [Isomères] |
|
| Masse molaire[1] | 186,253 ± 0,011 g/mol C 77,38 %, H 7,58 %, N 15,04 %, |
|
| Propriétés physiques | ||
| T° fusion | 175 à 180 °C | |
| T° ébullition | décomposition >300 °C | |
| Solubilité | soluble dans l'eau | |
| Masse volumique | 1,25 liquide | |
| Pression de vapeur saturante | 700 g·L-1 à 20 °C | |
| Précautions | ||
| SGH | ||
    |
||
| Directive 67/548/EEC | ||
 T  N |
||
| Inhalation | Irritation des muqueuses respiratoires. Fibrose pulmonaire aiguë. |
|
| Peau | Irritation | |
| Yeux | Irritation des muqueuses oculaires |
|
| Ingestion | Brûlures du système digestif. Dommages aux reins. |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
| Dichlorure de paraquat | |
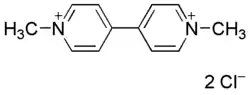
| |
| Identification | |
|---|---|
| Nom UICPA | Dichlorure de 1,1’-Diméthyl-4,4’-bipyridinium |
| No CAS | |
| No ECHA | 100.016.015 |
| No CE | 217-615-7 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C12H14Cl2N2 |
| Masse molaire[2] | 257,159 ± 0,015 g/mol C 56,05 %, H 5,49 %, Cl 27,57 %, N 10,89 %, |
| Précautions | |
| Directive 67/548/EEC | |
 T+  N |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| Paraquat méthylsulfate | |
| Identification | |
|---|---|
| Nom UICPA | di(méthylsulfate) de 1,1’-Diméthyl-4,4’-bipyridinium |
| No CAS | |
| No ECHA | 100.016.015 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C14H20N2O8S2 |
| Masse molaire[3] | 408,447 ± 0,025 g/mol C 41,17 %, H 4,94 %, N 6,86 %, O 31,34 %, S 15,7 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Le paraquat est hautement toxique à l'ingestion et présenterait des effets indésirables sur la santé lors de contacts prolongés.
| No CAS | Nom commun | Nom chimique |
|---|---|---|
| Paraquat | 1,1’-Diméthyl-4,4’-bipyridinium | |
| Paraquat chlorure | Dichlorure de 1,1’-Diméthyl-4,4’-bipyridinium | |
| Paraquat méthylsulfate | di(méthylsulfate) de 1,1’-Diméthyl-4,4’-bipyridinium |
Usages
Le paraquat est l’un des herbicides les plus utilisés au monde, vendu dans plus de 120 pays (selon son fabricant). Bien que très toxique, pour son faible coût et sa facilité d'utilisation, il sert en agriculture, floriculture et dans certains boisements à désherber ou préparer le sol pour une centaine de cultures de céréales (maïs, blé, orge, seigle, riz...), de soja, pomme de terre, fruits (pomme, orange, banane), de plantes destinées à la fabrication de boissons (café, thé, cacao) et des cultures traitées (coton, huile de palme, canne à sucre et caoutchouc). Il vise à protéger les semis contre la concurrence d'un large éventail de plantes pluriannuelles, les adventices, qui réduisent le rendement et la qualité de la récolte par compétition pour l'espace, l'eau, les nutriments, et la lumière. Il est aussi de plus en plus utilisé pour préparer le semis direct, notamment là où les adventices sont devenues résistantes au glyphosate (mais avec le risque de générer de nouvelles résistances au paraquat, cette fois).
Caractéristiques physico-chimiques
Le paraquat-chlorure se présente sous la forme de cristaux incolores et inodores. Il n’est pas volatil. Très soluble dans l’eau, il l'est légèrement dans l’éthanol et l’acétone ; il est insoluble dans les hydrocarbures. Les sels de paraquat et leurs solutions aqueuses ne sont pas inflammables.
Il se décompose au-dessus de 300 °C, produisant des fumées toxiques.
Il attaque les métaux, notamment le fer.
Caractéristiques de l'action herbicide
Quelques caractéristiques le distinguent d'autres substances actives d'herbicides de contact :
- Non-sélectivité (il détruit un large éventail de plantes) ;
- Action rapide ;
- La pluie survenant quelques minutes après application ne diminue pas son efficacité ;
- Il devient biologiquement inactif pour les plantes au contact du sol car il y est rapidement et très fortement adsorbé, mais on ignore ses éventuels effets sur les invertébrés du sol, et son devenir lorsqu'il est emporté par l'érosion hydrique.
Les préparations légales les plus utilisées en France étaient des solutions aqueuses contenant au maximum 40 g·L-1 de paraquat sous forme de dichlorure. Des spécialités contenant en plus du paraquat d’autres matières actives (simazine, diuron ou diquat) existaient aussi. Ces préparations étaient colorées en bleu et dénaturées par adjonction d’une substance odorante, répulsive et émétique. Cependant, la firme ICI fabricant le Paraquat est suspectée d'avoir limité la quantité d'émétique pour des raisons de coût dans certains produits, à une dose insuffisante pour protéger du risque d'ingestion[4]. Le produit était pulvérisé après dilution dans l’eau.
Effets sur la santé humaine
Le professeur de toxicologie clinique à l’université d’Edimbourg Michael Eddleston estime en 2021 que probablement plus de 100 000 personnes sont mortes empoisonnées au Paraquat depuis sa mise sur le marché dans les années 1960[4].
Toxicité aiguë
Le paraquat est dangereux par sa forte toxicité aiguë par ingestion, même à faible dose[5]. Il est à l'origine de controverses, notamment aux Antilles[6].
- Atteinte digestive caustique, avec diarrhée pouvant conduire à des risques de déshydratation en cas d’ingestion importante.
- Atteinte rénale de type insuffisance rénale fonctionnelle (réversible)[7] - [8].
- Si ce premier cap difficile est surmonté, une fibrose pulmonaire irréversible s’installe, aboutissant à une mort douloureuse par hypoxie en quelques jours ou semaines (aucun antidote connu).
- L’absorption cutanée après des contacts prolongés avec des solutions concentrées peut suffire à provoquer la mort par fibrose pulmonaire[9].
Toxicité chronique
Essentiellement effet irritant de la peau, des muqueuses oculaires et respiratoires.
Dans les années , l'ONG nicaraguayenne Fundacion Nica Global a alerté sur l'effet potentiel que pourrait avoir le paraquat sur une épidémie d'insuffisance rénale chronique qui concernerait les planteurs de canne à sucre et atteindrait directement plus de 2 500 travailleurs. Si cette alerte fut relayée dans certains médias, elle donna lieu à une controverse sur l'implication des pesticides et notamment le paraquat[10] - [11]. Une étude récente indique que l'exposition au glyphosate, lorsqu'elle est associée au paraquat, aurait un effet synergique et pourrait effectivement conduire à l'apparition d'insuffisance rénale chronique[12].
Expérimentalement :
- La toxicité induite par le paraquat chez les rats a été également mise en évidence avec des lésions dégénératives du système nerveux analogues à celles de la maladie de Parkinson.
- Une étude de indique que le paraquat, comme d'autres neurotoxiques tels que le plomb ou le mercure, peuvent, même à faible dose, inhiber le développement et le fonctionnement du cerveau et de la moelle épinière en bloquant la division des cellules souches du système nerveux central en agissant tous sur la même voie de signalisation cellulaire Fyn/c-Cbl[13].
La valeur limite d'exposition professionnelle (VLE) est fixée à 0,1 mg·m-3.
Effets physiopathologiques sur le système nerveux
L'intérêt pour le paraquat provient de sa similarité structurale avec le MPP+, un produit issu du catabolisme du MPTP (1-méthyle-4-phényl-1,2,3,6-tétrahydropyridine)[14]. Le MPTP est utilisé dans l'industrie comme intermédiaire de synthèse. Le chlorure de MPP+ a notamment été utilisé pour produire le Cyperquat, un herbicide, dans les années [15] ; substance structurellement proche du paraquat, elle a été suspectée d’avoir la même toxicité, bien que les études épidémiologiques, à l'époque, ne semblaient pas en apporter la preuve[16].
 Paraquat.
Paraquat.
Des études épidémiologiques plus récentes indiquent un excès de risque - deux fois plus élevé - de développer la maladie de Parkinson lors d'une exposition à des pesticides causant un stress oxydatif et notamment le paraquat[17] - [18]. Il a par ailleurs été montré que le paraquat avait un effet synergique lorsqu'il était associé au manèbe et au zirame ; dans le cas d'une exposition à ces trois pesticides, le risque de développer la maladie de Parkinson est multiplié par trois[19] - [20].
Contribution du MPTP à la recherche sur la maladie de Parkinson
Le MPTP est une neurotoxine qui peut être produite au cours de la synthèse de MPPP (1-methyl-4-phenyl-4-propionoxypiperidine) (en), c'est pour cette raison que son rôle inducteur d'un syndrome Parkinsonien a été découvert dans les années [21]. Sa neurotoxicité avait déjà été suspectée en lorsque Barry Kidston, un étudiant en chimie du Maryland âgé de 23 ans, s’était injecté du MPPP qu’il avait synthétisé de manière incorrecte en générant des impuretés, le MPTP. Le MPPP est un opioïde de synthèse, analogue de la péthidine, utilisé par les toxicomanes comme drogue récréative et qui a des effets similaires à ceux de l’héroïne et de la morphine. Il a été ainsi été lésé par le MPTP, et à l’issue d’un délai de trois jours, il a commencé à développer les symptômes de la maladie de Parkinson, symptômes éliminés avec succès par un traitement à la levodopa ; il décédera 18 mois plus tard d'une overdose de cocaïne. Lors de l'autopsie, on a découvert une destruction des neurones dopaminergiques de la substance noire[22].
Le MPTP lui-même n'est pas toxique et comme tout composé liposoluble, il peut traverser la barrière hémato-encéphalique. Une fois à l'intérieur du cerveau, le MPTP est métabolisé en une substance toxique le 1-méthyl-4-phenylpyridinium (MPP +) par la monoamine oxydase (MAO-B), une enzyme présente dans les cellules gliales. Le MPP+ est transporté dans les neurones dopaminergiques par le transporteur de la dopamine (en). Il détruit essentiellement les neurones dopaminergiques dans une partie du cerveau appelée la substance noire. Le MPP+ interfère avec le complexe I de la chaîne respiratoire, un élément du métabolisme des mitochondries, ce qui conduit à la mort cellulaire et provoque l'accumulation de radicaux libres, des molécules toxiques qui contribuent ultérieurement à la destruction des cellules.
Langston et al. (1984) ont constaté que l'injection de MPTP, chez le singe Saïmiri, entraînait également un syndrome Parkinsonien[23]. Les symptômes induits pouvaient être atténués par la lévodopa, un précurseur de la dopamine, principal traitement de la maladie de Parkinson. Les structures cérébrales affectées et les manifestations pathologiques générées par l'injection de MPTP récapitulent presque parfaitement celles de la maladie de Parkinson, hormis la formation des corps de Lewy. Le MPTP est ainsi utilisé pour modéliser la maladie de Parkinson, chez l'animal, en vue d'étudier la physiopathologie de cette maladie et d’évaluer des traitements potentiels. Des études sur la souris ont montré que la sensibilité au MPTP augmentait avec l'âge.
Il a été postulé que la maladie de Parkinson pourrait être provoquée par l’accumulation de faibles quantités de MPP+ composées d’un apport exogène par ingestion ou par le biais d'expositions répétées, et que ces substances sont en concentration trop minime pour être détectées de manière significative par des études épidémiologiques[24].
La connaissance du MPTP et son utilisation pour recréer un modèle expérimental fiable de la maladie de Parkinson a incité les scientifiques à étudier les possibilités d'une intervention chirurgicale remplaçant la perte des neurones par des implants de tissus fœtaux et de cellule souche ou la stimulation électrique cérébrale sous-thalamique, recherches[25], qui toutes initialement ont fait preuve d’une réussite provisoire.
En 2000, un autre modèle animal de la maladie de Parkinson a été découvert[26]. Les auteurs de l'étude ont mis en évidence que la roténone, un insecticide, provoquait un syndrome Parkinsonien chez le rat en détruisant les neurones dopaminergiques de la substance noire. Comme le MPP+, la roténone interfère avec le complexe I de la chaîne respiratoire des mitochondries[27].
Effets du Paraquat
S'il présente des analogies structurales avec le MPP+, le paraquat agit sur la physiologie cellulaire différemment. C'est une molécule chargée ne pouvant pas passer la barrière hémato-encéphalique ; elle utilise pour cela les transporteurs des acides aminés neutres[28]. Un mécanisme de transport dépendant du sodium () lui permettrait ensuite de pénétrer dans les neurones[28]. Au niveau cytosolique, le paraquat génère un stress oxydatif important en inhibant, notamment, le recyclage du glutathion[15]. De plus, lors d'une exposition chronique, l'exposition initiale au paraquat déclencherait une réponse de la microglie prédisposant les cellules dopaminergiques à la neurodégénérescence lors des expositions suivantes[29]. La microglie est un type de cellule gliale macrophagique participant à la défense immunitaire et protégeant le système nerveux central. Ces cellules ont la capacité de déclencher une explosion oxydative visant à produire des dérivés réactifs de l’oxygène afin de dégrader les corps étrangers qu'elles phagocytent. Parmi ces dérivés oxydatifs, il y a l'ion superoxyde (O2•–) généré à partir du coenzyme NADPH par la NADPH oxydase. Le paraquat génère un stress oxydant toxique en activant la NADPH oxydase[30]. Le paraquat agirait également en induisant un phénomène d'apoptose via l'activation de Bax et Bak (en), deux protéines de la famille Bcl-2[31].
Chez la souris, l'injection systémique de paraquat permet de modéliser la maladie de Parkinson en induisant une diminution du nombre de neurones dopaminergiques dans la substance noire ainsi qu'une altération de l'activité ambulatoire[32]. Par ailleurs, ce composé augmente l'expression de l'alpha-synucléine, ainsi que son taux d’agrégation, dans les neurones de la substance noire[33]. L'agrégation de l'α-synucléine sous forme de structures appelées corps de Lewy étant une des caractéristiques de la maladie de Parkinson, ces résultats suggèrent une influence de ce pesticide dans la physiopathologie de la maladie. Enfin, la sensibilité au paraquat augmente avec l'age[34].
Bien que le mode d'exposition et les doses utilisées dans les modèles expérimentaux soient, à juste titre, discutés, la recherche s'oriente de plus en plus vers l'effet que pourraient avoir de faibles doses lorsque différents composés chimiques sont mélangés (effet "cocktail")[35] ou lors de périodes de vulnérabilité accrue comme le développement[36] ; conditions qui, en définitive, sont plus proches de la réalité de l'exposition vécue par l’être humain. Il a été ainsi mis en évidence que l'effet du paraquat pouvait être exacerbé lorsqu'il était combiné avec un dithiocarbamate, composé utilisé comme additif pour les pesticides[37]. Paraquat et manèbe ont ainsi un effet synergique sur les atteintes du système dopaminergique et sur l'activité motrice. Par ailleurs, il a été mis en évidence que l'exposition néo-natale, chez la souris, à de faibles doses de paraquat conduisait chez l'adulte à des altérations de la motricité et du métabolisme dopaminergique, spécifiquement dans le striatum. De plus, les atteintes de la motricité s'aggravaient avec le vieillissement[38].
L'exposition au paraquat a permis de mettre au point d'autres modèles animaux de la maladie de Parkinson induits par un facteur environnemental. Chez la mouche, l'ingestion orale de paraquat induit des déficits moteurs, un diminution de l'espérance de vie et une perte des neurones dopaminergiques, de manière spécifique. Ces troubles peuvent être atténués, tout comme chez l'humain, par l'ingestion de L-DOPA[39].
Réglementation
Historique de l'interdiction dans l'Union européenne
L’Union européenne avait - à la demande notamment de la France, qui l'utilisait dans les bananeraies et sur luzerne, et du Royaume-Uni où il est fabriqué - autorisé le paraquat en 2003 en l'inscrivant à l’annexe I de la directive 91/414/CEE par la directive 2003/112/CE. Cette autorisation de mise sur le marché a été décidée en dépit de sa toxicité pour l'Homme et l'environnement.
La Suède, soutenue par le Danemark, l’Autriche, et la Finlande, a alors saisi la commission européenne. Après trois ans d'investigations complémentaires, le verdict devait être annoncé au printemps 2007. Ce n'est que le que le Tribunal de première instance des Communautés européennes, par l'arrêt arrêt T-229/04, a finalement annulé[40] la directive 2003/112/CE autorisant l'usage du paraquat dans les États-membres, considérant qu’il n’avait pas suffisamment été tenu compte du lien entre le paraquat et la maladie de Parkinson, ainsi que d'autres effets de la substance sur la santé des travailleurs et des animaux sauvages. Un nouvel effet délétère de faibles doses a été publié en 2007, sur les cellules souches du système nerveux central (de même que de faibles doses de plomb, de mercure)[13].
Statut réglementaire actuel
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est interdite à la suite de l'arrêt T-229/04 du du Tribunal de première instance des Communautés européennes[40] ;
- pour la France : cette substance active n'est pas autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché. L'avis paru au Journal officiel du retire les autorisations de mise sur le marché des produits phytopharmaceutiques contenant du paraquat (R BIX (AMM no 8700169)), pour tous les usages agricoles et non agricoles, sans délai d'écoulement des stocks que ce soit pour la distribution ou l'utilisation des stocks existants.
Bien que son usage soit interdit dans l'Union européenne, sa production se poursuit et les populations européennes pourraient continuer à y être exposées de manière indirecte. En effet, différentes entreprises localisées en Europe vendent chaque année plusieurs centaines de tonnes de paraquat aux entreprises agricoles brésiliennes. Ces dernières renvoient ensuite leur production agricole, potentiellement contaminée par ce même pesticide, vers les pays européens[41] - [42]. En 2017, la France et la Suisse furent épinglées pour leur exportation de ce pesticide interdit sur leurs territoires vers des tiers[43].
Fraude et dissimulation d'Imperial Chemical Industries
Face à la recrudescence des empoisonnements mortels, l'Agence de protection de l’environnement des États-Unis (EPA) envisage dans les années 1970 de retirer l'autorisation. Pour régler ce problème, Imperial Chemical Industries ajoute, en 1976 un vomitif (PP796), au paraquat. Cependant, le coût du PP796 étant élevé, l'entreprise fausse les résultats de ses recherches pour introduire une dose cinq à dix fois inférieure à celle nécessaire pour générer les vomissements à même d'éviter l'empoisonnement. Les empoisonnements demeurent (1200 morts au Japon pour la seule année 1986) et dans les pays où la réglementation veut interdire le paraquat (Suède, Grande Bretagne, Japon), ICI introduit des versions avec un ratio plus élevé de PP796. Elle choisit délibérément de ne pas généraliser ces mesures pour protéger les bénéfices (le pesticide représente 30 % du profit en 1987). ICI devient Zeneca en 1993, puis Syngenta en 2000 fournit les données faussées à la Commission européenne pour obtenir son autorisation sur le marché unique. Jon Heylings qui a travaillé pour ICI entre 1986 et 2008 lance l'alerte auprès de l'EPA en 2019 pour dénoncer les choix de l'entreprise qui aurait selon lui privilégié sciemment les bénéfices économiques à la santé et à la vie de milliers de personnes[4].
.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Stéphane Horel, « Un demi-siècle de mensonges et de secrets sur le paraquat, pesticide lucratif et poison violent », Le Monde.fr, (lire en ligne, consulté le )
- Mégarbane B., « Intoxication aiguë par le paraquat.», orpha.net, 2000.
- Alain Cwiklinski, « Environnement. Les Antilles contre le paraquat », l'Humanité, (lire en ligne, consulté le ).
- (en) Gheshlaghi F., « Toxic renal injury at a glance. », J Renal Inj Prev., vol. 1, no 1, , p. 15-6 (PMID 25340096, PMCID 4205979, DOI 10.12861/jrip.2012.07, lire en ligne [PDF], consulté le )

- (en) Weng CH, Chen HH, Hu CC, Huang WH, Hsu CW, Fu JF, Lin WR, Wang IK et Yen TH., « Predictors of acute kidney injury after paraquat intoxication. », Oncotarget, vol. 8, no 31, , p. 51345-51354 (PMID 28881652, PMCID 5584253, DOI 10.18632/oncotarget.17975, lire en ligne [EPUB], consulté le )

- (en) Smith JG., « Paraquat poisoning by skin absorption: a review. », Hum Toxicol., vol. 7, no 1, , p. 15-9 (PMID 3278972, DOI 10.1177/096032718800700103, lire en ligne [PDF], consulté le )
- Lise Barnéoud, « Mystérieuse épidémie au Nicaragua », Le Monde, (lire en ligne, consulté le ).
- Sandra Weiss, « Nicaragua. Le village des veuves », Courrier international, (lire en ligne, consulté le ).
- (en) Gunatilake S, Seneff S et Orlando L., « Glyphosate's Synergistic Toxicity in Combination with Other Factors as a Cause of Chronic Kidney Disease of Unknown Origin. », Int J Environ Res Public Health., vol. 16, no 15, , E2734 (PMID 31370256, PMCID 6695815, DOI 10.3390/ijerph16152734, lire en ligne [EPUB], consulté le )

- (en) Li Z, Dong T, Pröschel C et Noble M., « Chemically diverse toxicants converge on Fyn and c-Cbl to disrupt precursor cell function. », PLoS Biol., vol. 5, no 2, , e35 (PMID 17298174, PMCID 1790953, DOI 10.1371/journal.pbio.0050035, lire en ligne [EPUB], consulté le )

- (en) Snyder SH et D'Amato RJ., « Predicting Parkinson's disease. », Nature, vol. 317, no 6034, , p. 198-9 (PMID 3876509, DOI 10.1038/317198a0, lire en ligne [PDF], consulté le )

- (en) Blandini F et Armentero MT., « Animal models of Parkinson's disease. », FEBS J., vol. 279, no 7, , p. 1156-66 (PMID 22251459, DOI 10.1111/j.1742-4658.2012.08491.x, lire en ligne [EPUB], consulté le )

- P. J. Vinken, G. W. Bruyn. Intoxications of the Nervous System., p. 369. Elsevier Health Sciences, 1994. (ISBN 0-444-81284-9)
- (en) Tanner CM, Kamel F, Ross GW, Hoppin JA, Goldman SM, Korell M et al., « Rotenone, paraquat, and Parkinson's disease. », Environ Health Perspect., vol. 119, no 6, , p. 866-72 (PMID 21269927, PMCID 3114824, DOI 10.1289/ehp.1002839, lire en ligne [PDF], consulté le )

- Inserm (direction), Pesticides : Effets sur la santé, Paris, Inserm, coll. « Expertise collective », , XII-1001 p. (ISBN 978-2-85598-905-1, OCLC 875398182, lire en ligne), chap. 12 (« Maladie de Parkinson »), p. 457.

- Inserm 2013, p. 453.
- (en) Anthony Wang, Sadie Costello, Myles Cockburn, Xinbo Zhang, Jeff Bronstein et Beate Ritz, « Parkinson’s disease risk from ambient exposure to pesticides », Eur J Epidemiol., vol. 26, no 7, , p. 547–555 (PMID 21505849, PMCID 3643971, DOI 10.1007/s10654-011-9574-5, lire en ligne [PDF], consulté le )

- (en) Langston JW, Ballard P, Tetrud JW et Irwin I., « Chronic Parkinsonism in humans due to a product of meperidine-analog synthesis. », Science, vol. 219, no 4587, , p. 979-80 (PMID 6823561, DOI 10.1126/science.6823561, lire en ligne, consulté le )
- Fahn, Stanley. The Case of the Frozen Addicts : How the Solution of an Extraordinary Medical Mystery Spawned a Revolution in the Understanding and Treatment of Parkinson's Disease. The New England Journal of Medicine. Dec 26, 1996. Vol. 335, Iss. 26; p. 2002
- (en) Langston JW, Forno LS, Rebert CS et Irwin I., « Selective nigral toxicity after systemic administration of 1-methyl-4-phenyl-1,2,5,6-tetrahydropyrine (MPTP) in the squirrel monkey. », Brain Res., vol. 292, no 2, , p. 390-4 (PMID 6607092, DOI 10.1016/0006-8993(84)90777-7, lire en ligne, consulté le )
- Pesticides and Parkinson's Disease - A critical review. Institute of Environment and Health, Cranfield University, October 2005.
- Nouvelles perspectives dans le traitement de la maladie de Parkinson
- (en) Betarbet R, Sherer TB, MacKenzie G, Garcia-Osuna M, Panov AV et Greenamyre JT., « Chronic systemic pesticide exposure reproduces features of Parkinson's disease. », Nat Neurosci., vol. 3, no 12, , p. 1301-6 (PMID 11100151, DOI 10.1038/81834, lire en ligne [PDF], consulté le )

- (en) Sandra Blakeslee, « Pesticide Found to Produce Parkinson's Symptoms in Rats », The New York Times, , p. 38 (lire en ligne, consulté le ).
- (en) K Shimizu, K Ohtaki, K Matsubara, K Aoyama, T Uezono, O Saito, M Suno, K Ogawa, N Hayase, K Kimura et H Shiono, « Carrier-mediated Processes in Blood--Brain Barrier Penetration and Neural Uptake of Paraquat », Brain Res., vol. 906, nos 1-2, , p. 135-42 (PMID 11430870, DOI 10.1016/s0006-8993(01)02577-x, lire en ligne, consulté le )
- (en) Maya G Purisai, Alison L McCormack, Suzanne Cumine, Jie Li, Martha Z Isla et Donato A Di Monte, « Microglial Activation as a Priming Event Leading to Paraquat-Induced Dopaminergic Cell Degeneration », Neurobiol Dis., vol. 25, no 2, , p. 392-400 (PMID 17166727, PMCID 2001246, DOI 10.1016/j.nbd.2006.10.008, lire en ligne [PDF], consulté le )

- (en) Wu XF, Block ML, Zhang W, Qin L, Wilson B, Zhang WQ, Veronesi B et Hong JS., « The role of microglia in paraquat-induced dopaminergic neurotoxicity. », Antioxid Redox Signal., vol. 7, nos 5-6, , p. 654-61 (PMID 15890010, DOI 10.1089/ars.2005.7.654, lire en ligne, consulté le )
- (en) Fei Q, McCormack AL, Di Monte DA et Ethell DW., « Paraquat neurotoxicity is mediated by a Bak-dependent mechanism. », J Biol Chem., vol. 283, no 6, , p. 3357-64 (PMID 18056701, DOI 10.1074/jbc.M708451200, lire en ligne [PDF], consulté le )

- (en) Brooks AI, Chadwick CA, Gelbard HA, Cory-Slechta DA et Federoff HJ., « Paraquat elicited neurobehavioral syndrome caused by dopaminergic neuron loss. », Brain Res., vol. 823, nos 1-2, , p. 1-10 (PMID 10095006, DOI 10.1016/s0006-8993(98)01192-5, lire en ligne, consulté le )
- (en) Manning-Bog AB, McCormack AL, Li J, Uversky VN, Fink AL et Di Monte DA., « The herbicide paraquat causes up-regulation and aggregation of alpha-synuclein in mice: paraquat and alpha-synuclein. », J Biol Chem., vol. 277, no 3, , p. 1641-4 (PMID 1707429, DOI 10.1074/jbc.C100560200, lire en ligne [PDF], consulté le )

- (en) McCormack AL, Thiruchelvam M, Manning-Bog AB, Thiffault C, Langston JW, Cory-Slechta DA et Di Monte DA., « Environmental Risk Factors and Parkinson's Disease: Selective Degeneration of Nigral Dopaminergic Neurons Caused by the Herbicide Paraquat. », Neurobiol Dis., vol. 10, no 2, , p. 119-27 (PMID 12127150, DOI 10.1006/nbdi.2002.0507, lire en ligne, consulté le )
- (en) Graillot V, Takakura N, Hegarat LL, Fessard V, Audebert M et Cravedi JP., « Genotoxicity of pesticide mixtures present in the diet of the French population. », Environ Mol Mutagen., vol. 53, no 3, , p. 173-84 (PMID 22389207, DOI 10.1002/em.21676, lire en ligne, consulté le )
- (en) Grandjean P, Bellinger D, Bergman A et al., « The faroes statement: human health effects of developmental exposure to chemicals in our environment. », Basic Clin Pharmacol Toxicol., vol. 102, no 2, , p. 73-5 (PMID 18226057, DOI 0.1111/j.1742-7843.2007.00114.x, lire en ligne [EPUB], consulté le )

- (en) Thiruchelvam M, Brockel BJ, Richfield EK, Baggs RB et Cory-Slechta DA., « Potentiated and preferential effects of combined paraquat and maneb on nigrostriatal dopamine systems: environmental risk factors for Parkinson's disease? », Brain Res., vol. 873, no 2, , p. 225-34 (PMID 10930548, DOI 10.1016/s0006-8993(00)02496-3, lire en ligne, consulté le )
- (en) Fredriksson A, Fredriksson M et Eriksson P., « Neonatal exposure to paraquat or MPTP induces permanent changes in striatum dopamine and behavior in adult mice. », Toxicol Appl Pharmacol., vol. 122, no 2, , p. 258-64 (PMID 8212007, DOI 10.1006/taap.1993.1194, lire en ligne, consulté le )
- (en) Chaudhuri A, Bowling K, Funderburk C, Lawal H, Inamdar A, Wang Z et O'Donnell JM., « Interaction of genetic and environmental factors in a Drosophila parkinsonism model. », J Neurosci., vol. 27, no 10, , p. 2457-67 (PMID 17344383, PMCID 6672491, DOI 10.1523/JNEUROSCI.4239-06.2007, lire en ligne [PDF], consulté le )

- « Communiqué du Tribunal de première instance des Communautés européennes » [PDF], sur curia.europa.eu, (consulté le )
- Guy Pichard, « Comment des pesticides interdits en Europe se retrouvent dans nos jus, notre café et nos assiettes via le Brésil », (consulté le )
- (en) Larissa Mies Bombardi, A Geography of Agrotoxins use in Brazil and its Relations to the European Union, Sao Paulo, Universidade de São Paulo, coll. « Faculdade de Filosofia, Letras e Ciências Humanas », , 267 p. (ISBN 978-85-7506-359-0, DOI 10.11606/9788575063590, lire en ligne)
- Lise Loumé, « La France exporte un pesticide interdit sur son sol vers des pays en développement », Sciences et Avenir, (lire en ligne, consulté le )
Voir aussi
Bibliographie
- Agarwal R, Srinivas R, Aggarwal AN, Gupta D. Immunosuppressive therapy in lung injury due to paraquat poisoning: a meta-analysis. Singapore Med J. 2007; 48(11): 1000–1005
- Allègre J. Les adsorbants dans le traitement de l’intoxication au paraquat. Médecine d’Urgence Hospitalière.2004; 1-14
- Castello P, Drechsel D, Patel M. Mitochondria are a major source of paraquat-induced reactive oxygen species production in the brain. J Biol Chem.2007; 282: 14186-14193.
- CIP. Centre d’Information sur le Paraquat de Syngenta crop protection AG. (2016) Fiche technique paraquat.
- Ernouf D, Boussa N, Legras A, Lanotte R Intoxication aiguë au paraquat associée à une forte consommation d’alcool. J Pharm Clin.1997; 16(2):90-96.
- Garnier R, Saviuc P, Tuppin P et Cochet A . Etude rétrospective des observations notifiées au système français de toxicovigilance (2004-2006). Rapport CCTV. Intoxication par le paraquat, 2007 : 1-183.
- Gil HW, Hong JR2, Jang SH3, Hong SY. Diagnostic and therapeutic approach for acute paraquat intoxication. J Korean Med Sci.2014;29(11):1441-9.
- Grunbaum AM, Gosselin S. Intoxication aigüe au paraquat : Description d’un cas. Bull Inform Toxicol.2012; 28(1):1-13.
- Hausburg MA, Gregory K, De Krey K, Salmen L, Michelle R,. Gardiner K Effects of paraquat on development of preimplantation embryos in vivo and in vitro. Reproductive Toxicology, 2005; 20: 239–246.
- Houze P, Baud FJ, Mouy R, Bismuth C, Bourdon R, Scherrmann JM (). Toxicokinetics of paraquat in humans. Hum Exp Toxicol. 1990; 9: 5-12.
- INRS, (2016) .Fiche toxicologique de paraquat N°182, les effets de paraquat sur la reproduction. www.inrs.fr/fichetox
- Kervégant M, Merigot L, Glaizal M, Schmitt C, Tichadou L, de Haro L. Paraquat Poisonings in France during the European Ban: Experience of the Poison Control Center in Marseille. J Med Toxicol. 2013; 23: 144–147.
- Kuter K, Nowak P, Gołembiowska K, Ossowska K. Increased reactive oxygen species production in the brain after repeated low-dose pesticide paraquat exposure in rats. Neurochem Res. 2010; 35(8):1121-30.
- Ossowska K, Wardas J, Kuter K, Nowak P, Dabrowska J. Influence of paraquat on dopaminergic transporter in the rat brain. Pharmacol Rep. 2005; 57: 330-335.
- Ossowska K, Wardas J, Smialowska M, Kuter K, Lenda T. A slowly developing dysfunction of dopaminergic nigrostriatal neurons induced by long term paraquat administration in rats. Eur J Neurosci. 2005; 22: 1294-1304.
- Petit-Paitel A. Toxicité de l’herbicide paraquat. Bulletin de veille scientifique.2004; N°25 :71-74 .
- Rappold P, M, Cui, M, Chesser, A. S, Tibbett, J, Grima, J. C, Duan, L, Sen, N, Javitch, J. A, Tieu, K. Paraquat neurotoxicity is mediated by the dopamine transporter and organic cation transporter-3. Proceedings of the national academy of sciences, 2011; 108(51): 20766-20771.
- Thany SH, Reynier P et Lenaers G., « Neurotoxicité des pesticides : Quel impact sur les maladies neurodégénératives ? », Med Sci (Paris)., vol. 29, no 3, , p. 273-8 (PMID 23544381, DOI 10.1051/medsci/2013293013, lire en ligne, consulté le ).
- Umesh GL, Anish A. Survival after massive intentional overdose of paraquat. Afr. med. J. 2008; 98 (5):370-371.
- Yeh ST, Guo HR, Su YS, Lin HJ, Hou CC, Chen HM, Chang MC, Wang YJ. Protective effects of N-acetylcysteine treatment post-acute paraquat intoxication in rats and in human lung epithelial cells. Toxicology. 2006; 223 (3):181-90.
