Cyanure d'hydrogène
Le cyanure d'hydrogène est un composé chimique de formule chimique H-C≡N. Une solution aqueuse de cyanure d'hydrogène est appelée acide cyanhydrique (ou acide prussique).
| Cyanure d'hydrogène | |
  |
|
| Identification | |
|---|---|
| Nom UICPA | cyanure d'hydrogène |
| Synonymes |
Acide cyanhydrique |
| No CAS | |
| No ECHA | 100.000.747 |
| No CE | 200-821-6 |
| No RTECS | MW6825000 |
| PubChem | 768 |
| SMILES | |
| InChI | |
| Apparence | liquide ou gaz incolore, d'odeur caractéristique[1] |
| Propriétés chimiques | |
| Formule | HCN |
| Masse molaire[2] | 27,025 3 ± 0,001 1 g/mol C 44,44 %, H 3,73 %, N 51,83 %, |
| pKa | 9,2 - 9,3 |
| Moment dipolaire | 2,985 188 D[3] |
| Propriétés physiques | |
| T° fusion | −13 °C[1] |
| T° ébullition | 26 °C[1] |
| Solubilité | dans l'eau : miscible[1], miscible à l'éthanol |
| Paramètre de solubilité δ | 24,8 MPa1/2 (25 °C)[4] |
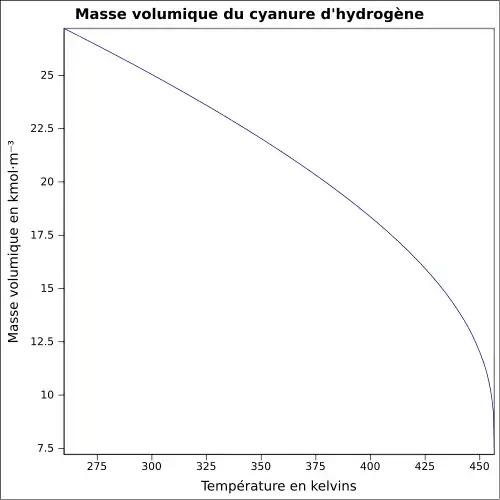
| Masse volumique | 0,69 g cm−3 (liquide)[1]
|
| T° d'auto-inflammation | 538 °C[1] |
| Point d’éclair | −18 °C (coupelle fermée)[1] |
| Limites d’explosivité dans l’air | 5,6–40,0 %vol[1] |
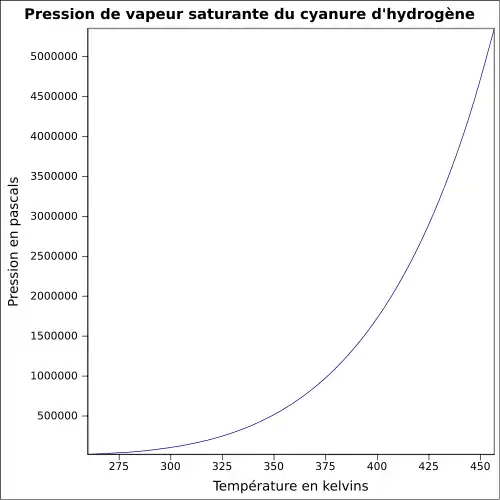
| Pression de vapeur saturante | à 20 °C : 82,6 kPa[1]
|
| Viscosité dynamique | 0,192 mPa s (20 °C) |
| Point critique | 53,9 bar, 183,55 °C[6] |
| Thermochimie | |
| S0liquide, 1 bar | 109 kJ/mol |
| ΔfH0liquide | 113,01 J mol−1 K−1 |
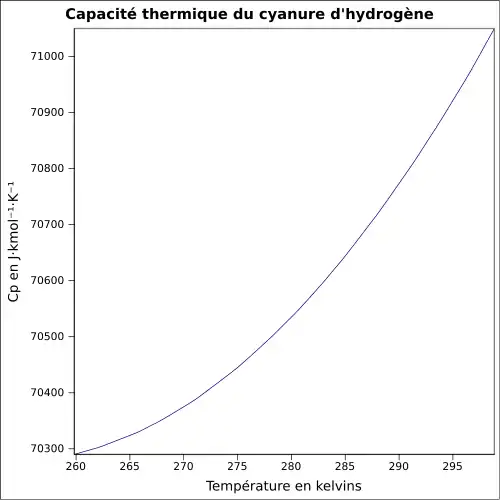
| Cp | 71,09 J mol−1 K−1 (20 °C, liquide) 35,85 J·mol-1·K-1 (25 °C, gaz) |
| PCS | 671,5 kJ mol−1 (25 °C, gaz)[8] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 13,60 ± 0,01 eV (gaz)[9] |
| Précautions | |
| SGH[10] - [11] | |
   Danger   Danger |
|
| SIMDUT[12] | |
   B2, D1A, F, |
|
| NFPA 704 | |
| Transport | |
| Inhalation | Très toxique |
| Peau | Très toxique |
| Yeux | Provoque des conjonctivites |
| Ingestion | Très toxique |
| Écotoxicologie | |
| LogP | −0,25[1] |
| Seuil de l’odorat | bas : 2 ppm haut : 10 ppm[13] |
| Unités du SI et CNTP, sauf indication contraire. | |
Il s'agit d'un produit extrêmement toxique et qui peut être mortel, car il cause une anoxie du fait de l’analogie structurale de l’ion CN− avec la molécule d’O2 et de son affinité pour la molécule d’hémoglobine qui transporte l’oxygène dans le sang. Dans la nature, il est souvent associé au benzaldéhyde qui dégage une odeur d’amande amère caractéristique, à laquelle certaines personnes ne sont pas sensibles.
Histoire
Le cyanure d'hydrogène fut initialement isolé d'un pigment bleu (le bleu de Prusse), connu depuis 1704, mais dont on ignorait la structure. On sait aujourd'hui que c'est un polymère de coordination, avec une structure complexe et une formule empirique de ferrocyanure de fer hydraté.
En 1752, le chimiste français Pierre Macquer montra que le bleu de Prusse pouvait être converti en oxyde de fer et un composé volatil, et que la combinaison de ces deux produits redonnait le bleu de Prusse. Le nouveau composé était précisément le cyanure d'hydrogène. Après Macquer, le chimiste suédois Carl Wilhelm Scheele synthétisa le cyanure d'hydrogène en 1782, et le nomma Blausäure (lit. « acide de bleu »), ayant reconnu son acidité. En anglais, il fut davantage connu sous le nom de prussic acid.
En 1787, le chimiste français Claude Louis Berthollet montra que le cyanure d'hydrogène ne contenait pas d'oxygène, ce qui fut essentiel pour la théorie des acides, Lavoisier ayant postulé que tous les acides contenaient de l'oxygène (le nom de l'oxygène provient du grec qui signifie « qui engendre l'acidité », tout comme pour l'allemand Sauerstoff). En 1811, Joseph Louis Gay-Lussac parvint à liquéfier le cyanure d'hydrogène pur, puis, en 1815, il en établit la formule chimique.
Sources naturelles
Extrêmement toxique, l'acide cyanhydrique est produit naturellement par certains végétaux, et peut être trouvé notamment dans les amandes amères, les noyaux de pêche (et plus généralement les noyaux des fruits du genre Prunus), de nèfles, les feuilles de cerisier (Prunus avium) et de laurier-cerise (Prunus laurocerasus), le sorgho (jeune plante et graines non mûres), le sureau hièble et le manioc. Il intervient aussi dans l’arôme des cerises (comme le benzaldéhyde).
Il est présent dans les cyanhydrines comme les mandélonitriles, et peut en être extrait par voie chimique. Certains millepattes dégagent du cyanure d'hydrogène comme mécanisme de défense. Il est contenu dans les gaz d'échappement des véhicules à combustion interne, dans la fumée de tabac, dans les fumées chirurgicales et dans la fumée de combustion de certaines matières plastiques contenant de l'azote — typiquement, le polyacrylonitrile et les copolymères associés, ABS et SAN, mais aussi le polyuréthane.
Préparation et synthèse
Le cyanure d'hydrogène est produit en grande quantité par deux procédés :
- dans le procédé Degussa, l'ammoniac et le méthane réagissent à 1 200 °C sur un catalyseur de platine.
- CH4 + NH3 → HCN + 3 H2
- Cette réaction est semblable à celle du méthane et de l'eau pour former CO et H2 (procédé dit « du gaz à l'eau ») ;
- dans le procédé Andrussow, on ajoute du dioxygène :
- CH4 + NH3 + 1,5 O2 → HCN + 3 H2O
- Cette réaction se produit sur un catalyseur constitué de fils en alliage platine/rhodium (généralement 90/10 %) à une température d'environ 1 100 °C.
- Le procédé Shawinigan est assez semblable aux précédents mais utilise des coupes d'hydrocarbures avec comme principal composant le propane :
- C3H8 + 3 NH3 → 3 HCN + 7 H2
- La réaction a lieu dans un lit fluidisé avec des particules de coke à une température supérieure à 1 300 °C. Aucun catalyseur n'est nécessaire.
- Au laboratoire, de petites quantités d'HCN sont produites par action d'acide sur un cyanure alcalin.
- H+ + NaCN → HCN + Na+
Cette réaction est la source d'empoisonnements accidentels.
Propriétés
Propriétés physiques
Le cyanure d'hydrogène se présente, à l'état pur, sous la forme d'un liquide incolore très volatil, ou d'un gaz incolore exhalant une odeur caractéristique d'amande amère. Il bout à 26 °C.
Il est miscible en toutes proportions avec l'eau et l'éthanol, soluble dans l'oxyde de diéthyle (éther).
Le cyanure d'hydrogène gazeux dans l'air est explosif à partir d'une concentration de 56 000 ppm (5,6 %).
Propriétés chimiques
Le cyanure d'hydrogène pur est stable.
Moins pur, comme il est commercialisé, et s'il n'est pas stabilisé, il polymérise en donnant un dépôt brun. Ce processus, exothermique et autocatalytique, s'accélère en présence d'eau et de produits à réaction alcaline, et peut ainsi conduire à une réaction explosive. Le stabilisant le plus fréquent est l'acide phosphorique, employé dans des proportions de 50 à 100 ppm.
Le cyanure d'hydrogène est faiblement acide et produit des ions cyanure CN− en solution aqueuse. Les sels de l'acide cyanhydrique sont appelés « cyanures ».
Réactions
- HCN + R-CO-R' (cétone ou aldéhyde) → R-C(OH)(CN)-R' (cyanhydrine)
Le cyanure d'hydrogène brûle dans l'air en donnant de l'eau, du dioxyde de carbone et du diazote.
Chimie prébiotique
L'acide cyanhydrique se serait formé grâce à la dissociation de l'azote moléculaire présent dans l'atmosphère. Les rayons ultraviolets pourraient réaliser cette réaction, à condition d'être suffisamment énergétiques (longueur d'onde inférieure à 100 nm), ce qui exclut toute réaction dans les couches les plus basses de l'atmosphère où les ultraviolets les plus énergétiques sont absorbés. La voie préférentielle pour synthétiser l'acide cyanhydrique à partir de l'azote semble être les éclairs, qui libèrent une énergie considérable sur leurs parcours, propre à casser de nombreuses molécules. Une fois la molécule de diazote brisée, un atome d'azote peut réagir avec une molécule de méthane (CH4) pour donner de l'acide cyanhydrique et de l'hydrogène.
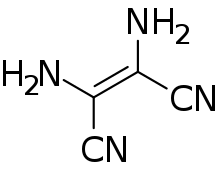
Le tétramère diaminomaléonitrile (en) se forme par polymérisation du cyanure d'hydrogène. Par une réaction photochimique, il se transforme en son isomère 4-amino-imidazole-5-carbonitrile, qui permet ensuite la synthèse de nombreux hétérocycles[14] - [15]. De ce fait, il est considéré comme un composé candidat possible dans l'origine de la chimie prébiotique.
Utilisations
Le cyanure d'hydrogène est utilisé pour la fabrication :
- de fumigateurs, de pesticides ;
- de nitriles et de résines monomères (l'acrylonitrile, notamment, est utilisé pour la fabrication des fibres acryliques, de matières plastiques) ;
- il est l'élément principal du Zyklon B, utilisé dans les chambres à gaz des camps d'extermination nazis.
Sécurité
Voir la section Étiquetage selon les directives CE, à la fin de cet article.
Risques d'incendie
Le cyanure d'hydrogène, dont le point d'éclair est de −17,8 °C (coupelle fermée), est extrêmement inflammable. Il peut former des mélanges explosifs avec l'air et ses limites d'explosivité sont de 5,6 et 41 % en volume.
Établissements recevant du public (ERP)
En France, l'arrêté du 4 novembre 1975 modifié impose que la masse des matériaux inflammables utilisés dans les aménagements intérieurs des établissements recevant du public n'entraîne pas une quantité d'azote pouvant être libérée sous forme d'acide cyanhydrique supérieure à cinq grammes par mètre cube du volume du local considéré.
Toxicité pour l'Homme
L'intoxication aiguë peut survenir par ingestion, par inhalation, ou par contact avec la peau. Une concentration de 300 ppm dans l'air tue un homme en quelques minutes. Sa toxicité est due à l'ion cyanure. Le cyanure d'hydrogène est utilisé aux États-Unis comme méthode d'exécution de la peine de mort et a été utilisé par le régime nazi (sous le nom de Zyklon B) dans les camps d'extermination comme outil « d'extermination de masse ». Le même produit est toujours fabriqué actuellement en République tchèque, sous le nom « Uragan D2 », et utilisé comme pesticide.
Le seuil de perception olfactive est inférieur à 1 ppm chez les sujets attentifs, sains et non habitués ; cependant, de nombreuses personnes, pour des raisons génétiques, ne perçoivent pas ou peu l'odeur du cyanure d'hydrogène.
Des taux de concentration atmosphériques supérieurs à 50 ppm respirés pendant plus d'une demi-heure représentent un risque important, alors que des taux de 200 à 400 ppm ou plus sont considérés comme pouvant entraîner la mort après une exposition de quelques minutes. À titre indicatif, la dose létale 50 pour le rat est de 484 ppm pour une exposition de cinq minutes.
Source
- Institut national de recherche et de sécurité, Cyanure d'hydrogène et solutions aqueuses [PDF], fiche toxicologique no 4, 1997, Paris, 5 p.
Dans la littérature
- Dans Thérèse Raquin d'Émile Zola (1867), c'est avec de l'acide cyanhydrique que Thérèse et Laurent se suicident.
- Dans Le Portrait de Dorian Gray d'Oscar Wilde (1890), on suspecte que c'est le poison qui a donné la mort à Sybil Vane.
- Dans Meurtre au champagne d'Agatha Christie (1945), la victime est empoisonnée à l'acide cyanhydrique.
- Dans SAS Magie noire à New York de Gérard de Villiers (1968), Malko Linge échappe de justesse à une tentative d'assassinat à l'acide prussique.
- Dans Embargo (1976), Gérard de Villiers imagine que des terroristes tuent leurs victimes à l'aide d'acide cyanhydrique.
Au cinéma
- La solution aqueuse de cyanure d'hydrogène apparaît sous son nom d'acide prussique lors d'un dialogue entre Bernard Blier et Annie Girardot dans le film Elle cause plus... elle flingue (1972) de Michel Audiard, évoquant un ancien dîner en tête à tête entre ces deux personnages et qui avait mal fini.
- Utilisé sous le nom d'acide prussique dans le film En secret (2014) par les amants Laurent et Thérèse Raquin pour mettre fin à leurs jours.
- Utilisé dans le film Jurassic World: Fallen Kingdom dans le manoir Lockwood.
- Utilisé dans le film Skyfall sorti en 2012 lors d’un dialogue entre M et l’ex-agent Da Silva du MI6.
- Le service King's Man essaie d'assassiner Raspoutine avec un gâteau à l'amande (The King's Man). Raspoutine découvre le poison à cause de la similitude connue entre l'amande et le cyanure d'hydrogène.
Notes et références
- CYANURE D'HYDROGENE, LIQUEFIE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 9-50.
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, États-Unis, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1-3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press, , 83e éd., 2664 p. (ISBN 0849304830, présentation en ligne), p. 5-89.
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, Boca Raton, CRC Press/Taylor & Francis, , 89e éd., 2736 p. (ISBN 9781420066791, présentation en ligne), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- « Cyanure d'hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- « Hydrogen cyanide », sur hazmap.nlm.nih.gov (consulté le ).
- Tom Maimone, PrebioticChemistry, sur scripps.edu.
- Cleaves, H.J., Prebiotic Chemistry: What We Know, What We Don't, Evo. Edu. Outreach, 2012, 5, 342.
Voir aussi
Liens externes
- Fiche toxicologique [PDF], INRS
- Fiche internationale de sécurité
- Fiche [PDF], INERIS