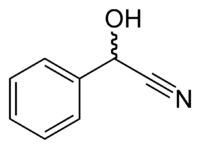
Mandélonitrile
Le mandélonitrile est un composé aromatique de formule C8H7NO. C'est le nitrile de l'acide mandélique ou la cyanhydrine du benzaldéhyde. Chiral, il existe sous la forme de deux énantiomères R et S, mais c'est principalement l'isomère (R)-(+) qui est présent dans la nature.
| Mandélonitrile | ||
| ||
-Mandelonitrile-3D-balls.png.webp) | ||
| Identification | ||
|---|---|---|
| Nom systématique | 2-hydroxy-2-phénylacétonitrile | |
| Synonymes |
α-hydroxybenzèneacétonitrile |
|
| No CAS | ((R)-(+)) ((S)-(-)) |
|
| No ECHA | 100.007.758 | |
| PubChem | 10758 | |
| SMILES | ||
| InChI | ||
| Apparence | liquide jaune[1] | |
| Propriétés chimiques | ||
| Formule | C8H7NO [Isomères] |
|
| Masse molaire[2] | 133,147 3 ± 0,007 4 g/mol C 72,17 %, H 5,3 %, N 10,52 %, O 12,02 %, |
|
| Propriétés physiques | ||
| T° fusion | −10 °C[1] 28 à 30 °C (R)[3] |
|
| T° ébullition | 170 °C (décompoition)[1] | |
| Solubilité | faible dan l'eau (< 1 g·L-1 (eau)[1]) bonne dans l'éthanol, le trichloroéthane et l'éther diéthylique[4] |
|
| Masse volumique | 1,12 g·cm-3 (20 °C)[1] 1,117 g·cm-3 (R, 25 °C)[3] |
|
| Point d’éclair | 86 °C[1] | |
| Propriétés optiques | ||
| Indice de réfraction | = 1,530[3] | |
| Précautions | ||
| SGH[1] | ||
  |
||
| Transport[1] | ||
| Écotoxicologie | ||
| DL50 | 5 600 μg·kg-1 (souris, i.v.)[5] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Occurrence
De petites quantités de mandélonitrile sont présentes dans les noyaux de certains fruits. Le mandélonitrile est l'aglycone de nombreux glycosides cyanogènes ; l'énantiomère R est ainsi notamment l'aglycone de la prunasine (glucoside), de l'amygdaline (gentiobioside) et de la vicianine (vicianoside), l'énantiomère S étant celui de la sambunigrine (glucoside). La prunasine bêta-glucosidase est une enzyme catalysant la réaction entre la prunasine et l'eau pour donner le D-glucose et le mandélonitrile[6].
Le mandélonitrile peut être séparé en cyanure et benzaldéhyde, une réaction catalysée par l'enzyme mandélonitrile lyase (en).
Propriétés
Le mandélonitrile est un liquide jaune difficilement inflammable (point d'éclair de 86 °C), très peu soluble dans l'eau, mais soluble dans l'éthanol, le trichloroéthane et l'éther diéthylique[4]. Il se décompose lorsqu'il est chauffé à plus de 170 °C[1].
Synthèse
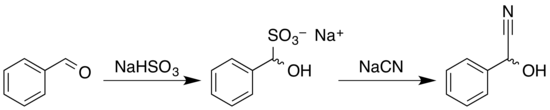
Le mandélonitrile racémique peut être obtenu de la même façons que de nombreuses autres cyanhydrines. Dans un synthèse monotope, le benzaldéhyde est mis à réagir avec le bisulfite de sodium pour donner l'adduit correspondant ; celui-ci réagit ensuite avec une solution aqueuse de cyanure de sodium ou de cyanure de potassium[7] pour donner le produit racémique[8] - [4] :
Utilisation
L'énantiomère (R)-(+) naturel est utilisé comme intermédiaire dans la synthèse de nombreux composés optiquement actifs tels que des acides α-hydroxylés, des α-hydroxyaldéhydes, des α-hydroxycétones et des 2-aminoalcools[4].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Mandelonitril » (voir la liste des auteurs).
- Entrée « Mandelonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 29 mars 2020 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Mandelonitrile, consultée le 29 mars 2020.
- (de) « Mandelsäurenitril », sur Römpp Online, Georg Thieme Verlag (consulté le )
- U.S. Army Armament Research & Development Command, Chemical Systems Laboratory, NIOSH Exchange Chemicals. Vol. NX#07767,
- (de) Emil Lehnartz, Einführung in die Chemische Physiologie, Springer-Verlag, (ISBN 978-3-662-36817-6), p. 267
- (de) Franz v. Bruchhausen, Gerd Dannhardt, Siegfried Ebel, August W. Frahm, Eberhard Hackenthal, Ulrike Holzgrabe, Hagers Handbuch der Pharmazeutischen Praxis Band 8 : Stoffe E-O, Springer-Verlag, (ISBN 978-3-642-57994-3), p. 808
- Corson, B. B.; Dodge, R. A.; Harris, S. A.; Yeaw, J. S., Mandelic Acid, Org. Synth., coll. « vol. 1 », , p. 336