Glycoside cyanogène
Les glycosides cyanogènes, cyanoglycosides ou hétéroside cyanogénétiques, sont des toxines végétales (phytotoxines) très répandues, du groupe des glycosides. Ils se composent d'un glycoside, c'est-à-dire la combinaison d'un alcool et d'un hydrate de carbone (sucre), qui porte en outre un groupe nitrile –CN . La décomposition de ce dernier par hydrolyse sous l'effet de certaines enzymes libère, entre autres, du cyanure d'hydrogène (HCN), substance très toxique également appelée acide cyanhydrique (d'où le nom de cyanogène). Ce processus est appelé « cyanogenèse »[1]. Ce sont des métabolites secondaires des plantes qui assurent notamment des fonctions de défense des plantes contre leurs prédateurs herbivores ou phytophages.
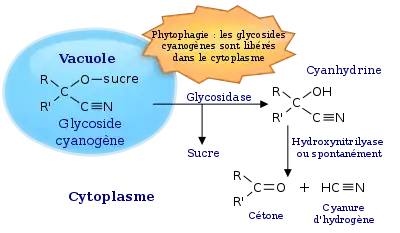
Ces composés, qui peuvent être définis chimiquement comme des glycosides d'α-hydroxinitriles, sont dérivés d'acides aminés constituants des plantes. Ils sont présents dans plus de 2500 espèces végétales[2].
Certains « types biosynthétiques » de glucosides cyanogènes semblent avoir plusieurs origines évolutives tandis que d'autres semblent n'être apparus qu'une seule fois, et ont par conséquent une distribution limitée à seulement quelques taxons végétaux apparentés.
- Les glycosides cyanogènes dérivés des acides aminés ramifiés sont communs chez les sous-familles des Amygdaloideae et Maloideae parmi les Rosaceae ; et des composés similaires se trouvent chez les Fabaceae et Sapindaceae.
- Les glycosides cyanogènes dérivés de la tyrosine sont communs chez de nombreuses familles de Magnoliales et de Laurales.
Structure
Les glycosides cyanogènes sont des molécules composées de deux éléments : l'aglycone, partie non-glucidique, constituée de cyanhydrine (α-hydroxinitrile), stabilisée par un sucre (ou ose), souvent du glucose, constituant le glycone. Leur structure est variée, on en connaît plus de 60 formes différentes, les différences provenant soit de variations de l'aglycone, soit de glycosylation additionnelle du glycone. L'atome de carbone central est souvent asymétrique, de ce fait la structure est chirale et peut se présenter sous les deux formes R et S (énantiomères)[3].
A quelques exceptions près, les glycosides cyanogènes connus se classent dans six groupes, dérivés de cinq acides aminés protéiques (valine, isoleucine, leucine, phénylalanine et tyrosine) et un acide aminé non-protéique (cyclopentényglycine)[3].
| Précurseurs | Structures de base | Exemples de dérivés |
|---|---|---|
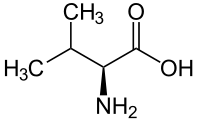 Valine | Linamarine | Linustatine |
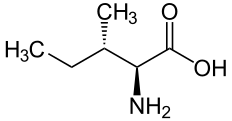 Isoleucine | R-Lotaustraline, S-Néolotaustraline | Néolinustatine |
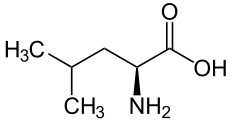 Leucine | R-Hétérodendrine, S-Épihétérodendrine | Proacacipétaline, Cardiospermine, Proacacibérine |
| Cyclopentényglycine | R-Déidacline, S-Tétraphylline A | Taraktophylline, Gynocardine |
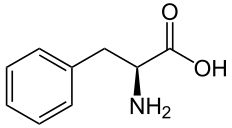 Phénylalanine | R-Prunasine, S-Sambunigrine | Amygdaline, Holocaline, Vicianine |
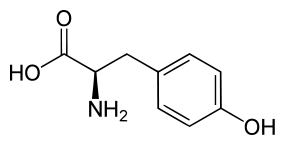 Tyrosine | R-Dhurrine, S-Taxiphylline | Protéacine, Nandinine |
Distribution
La présence de glycosides cyanogènes a été reconnue chez au moins 2650 espèces de plantes, dans plus de 550 genres et 130 familles. Cette détection repose sur des tests colorimétriques simple, mais les composés cyanogènes ont été réellement isolés et étudié chez environ 475 espèces végétales, et la structure chimique de ces composés a été publiée dans seulement 60 cas[2]. La plupart des familles concernées appartiennent aux angiospermes, principalement les dicotylédones, mais il y a des exceptions comme les Polypodiaceae (ptéridophytes) et les Taxaceae (gymnospermes)[4].
Certains glycosides cyanogènes ont une large distribution et sont présents dans de nombreuses familles de plantes. Ainsi la linamarine et la lotaustraline se trouvent dans cinq familles : Asteraceae, Euphorbiaceae, Linaceae, Papaveraceae et Fabaceae, tandis que la prunasine est présente dans six familles (Polypodiaceae, Myrtaceae, Rosaceae, Saxifragaceae, Scrophulariaceae et Myoporaceae). Le cas le plus général est qu'un composé cyanogène particulier n'apparaît que dans une ou deux familles. À l'inverse, le plus souvent, une famille donnée ne contient qu'un ou deux glycosides caractéristiques. C'est le cas par exemple des Poaceae (dhurrine), des Asteraceae (linamarine), des Polypodiaceae (prunasine et vicianine), des Rosaceae (amygdaline et prunasine). Cette distribution particulière donne à ces composés un caractère chimiotaxinomique[4].
De nombreuses espèces de bactéries et de champignons possèdent également des composés cyanogènes, mais ceux-ci sont généralement labiles[2].
Dans le règne animal, la présence de glycosides cyanogènes semble être limitée aux Arthropodes. Certains insectes, souvent à coloration aposématique, peuvent soit synthétiser ces substances cyanogènes de novo, soit les séquestrer de leurs plantes-hôtes[5] - [6].
Exemples
| Glycoside cyanogène | Espèce de plantes | |
|---|---|---|
| Nom vernaculaire | Nom scientifique | |
| Amygdaline | Amandier (amandes) | Prunus amygdalus |
| Dhurrine | Sorgho | Sorghum bicolor, Sorghum album |
| Linamarine | Manioc | Manihot esculenta, Manihot carthaginensis |
| Haricot de Lima | Phaseolus lunatus | |
| Lotaustraline | Manioc | Manihot carthaginensis |
| Haricot de Lima | Phaseolus lunatus | |
| Prunasine | Fruits à noyau | Prunus spp., par exemple : Prunus avium, Prunus padus, Prunus persica, Prunus macrophylla |
| Taxiphylline | Pousse de bambou | Bambusa vulgaris |
Polymorphisme de la cyanogenèse chez le trèfle blanc
On connaît en Europe depuis près d'un siècle, un polymorphisme génétique de la cyanogenèse chez diverses populations de trèfle blanc (trifolum repens). Ce polymorphisme, qui se manifeste par la libération ou non de cyanure en cas d'atteintes aux tissus des plantes et sous l'effet de l'enzyme appropriée, est commandé par deux gènes indépendants, Ac et Li.
Le gène Ac détermine la capacité de la plante à produire des glycosides cyanogènes (lotaustraline et linamarine). Ces glycosides sont stockés dans les vacuoles des cellules des feuilles et des tiges. Une plante doit porter au moins un allèle Ac dominant pour produire des glucosides cyanogènes, une plante récessive homozygote (génotype acac) n'en produit pas.
Le gène, Li, détermine la présence ou l'absence de l'enzyme, la linamarase, qui est nécessaire pour l'hydrolyse des glucosides cyanogènes et la libération du cyanure, et est donc plus dangereux. La linamarase est stockée dans la paroi des cellules épidermiques foliaires, donc c'est seulement en cas de rupture des cellules que l'enzyme peut entrer en contact avec les glycosides et que la libération de cyanure peut se produire. Une plante qui porte deux allèles récessifs du gène Li (génotype lili) ne produit pas de linamarase.
On a donc quatre types différents de trèfles par rapport à leur toxicité potentielle par cyanogenèse. Le phénotype cyanogène est déterminé par la présence d’un allèle dominant à chaque locus :
- AcLi : glycosides et enzyme,
- Acli : glycosides seulement,
- acLi : enzyme seulement,
- acli : ni glucosides, ni enzyme.
C'est seulement lorsque les deux gènes sont dominants qu'un effet toxique est possible. Dans les autres cas, soit les glycosides, soit l'enzyme, soit les deux sont absents et la plante ne peut pas libérer de cyanure (plante acyanogène)[8] - [9] - [10].
Utilisation
La prunasine et l'amygdaline contenues dans les feuilles fraîches de l'amandier ou du laurier-cerise sont traditionnellement considérées comme des substances active en phytothérapie. On leur attribue des propriétés anesthésiques et antispasmodiques en dermatologie[11].
On prépare à partir de feuilles fraîche de laurier-cerise (Prunus laurocerasus), qui sont riches en prunasine (120 à 180 mg/100 g), l'« eau distillée de laurier-cerise », titrée à 100 mg/100 g d'HCN total. Cette préparation était inscrite à la pharmacopée française (10e édition) et utilisée comme aromatisant, antispasmodique et stimulant respiratoire[12].
Notes et références
- (en) Hegnauer R., « Cyanogenic compounds as systematic markers in Tracheophyta », Plant Syst Evol., vol. Suppl 1, , p. 191-209.
- (en) David S. Seigler, « Cyanogenic Glycosides and Cyanolipids », dans Plant Secondary Metabolism, Springer Science & Business Media, , 759 p. (ISBN 9780412019814, lire en ligne), p. 273-299.
- (en) Michael Wink, Biochemistry of Plant Secondary Metabolism, t. 2, CRC Press, coll. « Sheffield Annual Plant Reviews », , 374 p. (ISBN 978-0-8493-4085-7, lire en ligne), p. 79-106.
- (en) János Vetter, « Plant cyanogenic glycosides », Toxicon, vol. 38, no 1, , p. 11-36 (lire en ligne).
- (en) Matthias Lechtenberg, « Cyanogenesis in Higher Plants and Animals », eLS, John Wiley & Sons Ltd, (DOI 10.1002/9780470015902.a0001921.pub2, résumé).
- (en) Mika Zagrobelny, Søren Baka, Anne Vinther Rasmussen, Bodil Jørgensen, Clas M. Naumann, Birger Lindberg Møller, « Cyanogenic glucosides and plant–insect interactions », Phytochemistry, vol. 65, , p. 293–306 (lire en ligne).
- (en) G. Speijers, « Cyanogenic Glycosides », sur IPCS INCHEM, International Programme on Chemical Safety (IPCS) (consulté le )
- (en) M. A. Hughes, « The cyanogenic polymorphism in Trifoliumrepens L. (white clover) », Heredity, vol. 66, , p. 105—115 (lire en ligne).
- « Variation dans les populations naturelles » (consulté le ).
- (en) « Laboratory: Clover Cyanogenesis », sur Arts & Sciences, Washington University in St. Louis, (consulté le ).
- Émilie Lebreton, « Plantes à usage cutané chez l'enfant (thèse) », Université Joseph Fourier - UFR de pharmacie de Grenoble= (consulté le ).
- Jean Bruneton, Pharmacognosie, phytochimie, plantes médicinales (4e éd.), Lavoisier, , 1292 p. (ISBN 978-2-7430-1904-4, lire en ligne).
Voir aussi
Bibliographie
- (en) Judd, W. S. Campbell, C. S. Kellogg, E. A. Stevens, P.F. Donoghue, M. J., « Secondary Plant Compounds (chap. 4, Structural and Biochemical Characters) », dans Plant systematics: a phylogenetic approach, Second Edition, Sunderland (Massachusetts, Sinauer Associates, , 576 p..
- (en) Jonathan E. Poulton, « Cyanogenesis in Plants », Plant Physiol., vol. 94, , p. 401-405 (lire en ligne).
- (en) János Vetter, « Plant cyanogenic glycosides », Toxicon, vol. 38, no 1, , p. 11-36 (lire en ligne).
- (en) Ilza A. Francisco & Maria Helena Pimenta Pinotti, « Cyanogenic Glycosides in Plants », Brazilian Archives of Biology and Technology, vol. 43, no 5, (ISSN 1678-4324, lire en ligne).
- (en) David S. Seigler, « Cyanogenic Glycosides and Cyanolipids », dans Plant Secondary Metabolism, Springer Science & Business Media, , 759 p. (ISBN 9780412019814, lire en ligne), p. 273-299.
Liens externes
- (en) « Cyanogenic Glycosides - Information sheet », sur MPI Food Safety, Ministry for Primary Industries (Nouvelle-Zélande) (consulté le ).