Chloramphénicol
Le chloramphénicol est un antibiotique bactériostatique de la famille des phénicolés. Cet antibiotique peut être utilisé pour traiter la méningite, la peste, le choléra, la fièvre typhoïde uniquement lorsque les antibiotiques plus sûrs ne peuvent pas être employés. Lors du traitement, il est recommandé de contrôler tous les deux jours la composition sanguine.
| Chloramphénicol | |
| |
 |
|
| Identification | |
|---|---|
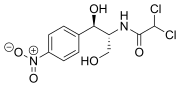
| Nom UICPA | 2,2-dichloro-N-[1,3-dihydroxy-1-(4-nitrophényl)propan-2-yl]acétamide |
| No CAS | |
| No ECHA | 100.000.262 |
| No CE | 200-287-4 |
| Code ATC | D06 D10 G01 J01 S01 S02 S03 |
| DrugBank | DB00446 |
| PubChem | 5959 |
| SMILES | |
| InChI | |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | C11H12Cl2N2O5 [Isomères] |
| Masse molaire[1] | 323,129 ± 0,016 g/mol C 40,89 %, H 3,74 %, Cl 21,94 %, N 8,67 %, O 24,76 %, |
| Propriétés physiques | |
| T° fusion | 150,5 °C |
| Solubilité | 2,5 g·L-1 eau à 25 °C. 5 à 20 mg·mL-1 éthanol absolu. 150,8 mg·mL-1 propylène glycol. Sol. dans méthanol, éthanol, butanol, acétone et acétate d'éthyle. Peu sol. dans éther. Insol. dans benzène, éther de pétrole. |
| Précautions | |
| SIMDUT[2] | |
 D2A, |
|
| Directive 67/548/EEC | |
 T |
|
| Classification du CIRC | |
| Groupe 2A : Probablement cancérogène pour l'homme[3] | |
| Écotoxicologie | |
| DL50 | 1 500 mg·kg-1 souris oral 110 mg·kg-1 souris i.v. 400 mg·kg-1 souris s.c. 1 100 mg·kg-1 souris i.p. |
| Données pharmacocinétiques | |
| Métabolisme | hépatique |
| Demi-vie d’élim. | 2 h 30 |
| Excrétion |
reins (5-15 %), selles 4 % |
| Considérations thérapeutiques | |
| Classe thérapeutique | Bactériostatique |
| Voie d’administration | orale, intramusculaire et intraveineuse |
| Unités du SI et CNTP, sauf indication contraire. | |
Le chloramphénicol est isolé en 1947 à partir de Streptomyces venezuelae (en). Cet antibiotique fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé. Il agit en inhibant la synthèse peptidique en se fixant sur le ribosome bactérien. La molécule est disponible par voie intraveineuse, par voie orale et comme une pommade ophtalmique. Elle présente cependant une toxicité importante qui peut entraîner dans certains cas une aplasie médullaire et n'est pratiquement plus utilisée que par voie locale en médecine humaine du fait de sa toxicité potentielle.
Usage médical
Le chloramphénicol est un antibiotique de la famille des phénicolés, c'est le seul antibiotique à disposer d'un groupement nitro. Il a été prescrit d'abord dans le traitement de la fièvre typhoïde, mais l'émergence de souches Salmonella typhi multirésistantes a limité son utilisation. Il est utilisé dans le traitement de cette maladie uniquement si la souche est sensible. Le chloramphénicol est utilisé comme agent de seconde ligne dans le traitement du choléra lorsque la souche Vibrio cholerae résiste à la tétracycline.
Le chloramphénicol est une molécule qui franchit plus efficacement la barrière hémato-encéphalique que les céphalosporines. Il est le traitement de premier choix en cas d'abcès cérébral par staphylocoques ou par organismes mixtes ou inconnus. Cet antibiotique est actif contre les trois principales souches responsables de la méningite bactérienne : Neisseria meningitidis, Streptococcus pneumoniae et Haemophilus influenzae[4]. De ce fait, dans les pays occidentaux, le chloramphénicol reste le médicament de choix dans le traitement de la méningite pour les patients atteints présentant une allergie sévère à la pénicilline ou aux céphalosporines. Il est recommandé aux médecins généralistes de disposer de chloramphénicol par voie intraveineuse dans leur sac.
Le chloramphénicol est utilisé aux États-Unis dans le traitement empirique initial des enfants atteints de fièvre et d'éruption pétéchiale lorsque le diagnostic différentiel inclut à la fois une septicémie due à Neisseria meningitidis et la fièvre des montagnes Rocheuses, en attendant les résultats des analyses. L'antibiotique est également efficace contre Enterococcus faecium, il peut donc être utilisé dans le traitement d'entérocoques résistant à la vancomycine.
Sensibilité de souches bactériennes
| Microorganisme | CMI50 (μg/ml) | CMI90 (μg/ml) | gamme (μg/ml) |
|---|---|---|---|
Neisseria gonorrhoeae, Neisseria meningitidis, Haemophilus influenzae, salmonelles (en particulier Salmonella enterica sérotype Typhi), shigelles, mais ces dernières sont bien moins sensibles aux phénicolés qu'aux céphalosporines (C3G) ou aux fluoroquinolones. Actifs sur les anaérobies, et sur des bactéries intra-cellulaires dont les rickettsioses.
Actuellement, certains Enterococcus faecium et certaines souches de Pseudomonas aeruginosa sont résistantes au chloramphénicol. Des Veillonella spp. et des souches de Staphylococcus capitis ont également développé une résistance au chloramphénicol à des degrés variables.
Fiche technique
- Incompatible avec les substances suivantes : les agents oxydants forts, les acides forts, les chlorures d'acides, les anhydrides d'acides.
Précautions de sécurité
- Éviter tout contact direct avec la peau.
- Porter un appareil de protection des yeux et en cas de ventilation insuffisante.
- Porter un appareil respiratoire approprié.
- Ne pas manger et ne pas boire pendant l'utilisation.
Effets secondaires et contre-indications
Anémie aplasique
Le traitement au chloramphénicol présente des effets secondaires dont le plus grave est l'anémie aplasique, maladie irréversible et mortelle, mais d'incidence faible (environ 0,1 % des cas). Elle se déclare plusieurs semaines à plusieurs mois après l'arrêt du traitement et pourrait être associée à une prédisposition génétique. Afin de prévenir le développement de la maladie, une numération globulaire du sang doit être réalisée chez les patients. La maladie a une incidence de 1 pour 24 000 à 40 000 patients pour le chloramphénicol ingéré par voie orale[5] et tombe à 1 pour 224 716 patients pour le chloramphénicol appliqué sous forme de gouttes oculaires[6]. Pour cette raison, il n'est plus utilisé qu'en application externe dans les pays occidentaux (collyres dans les infections ophtalmiques) ou parfois dans le cas d'infections sévères et résistantes en milieu hospitalier. L'organisation mondiale de la santé (OMS) le conserve sur sa liste des médicaments autorisés considérant que malgré ce risque, il peut apporter un bénéfice important.
Autres effets
Le chloramphénicol a un effet toxique direct sur les mitochondries humaines[7] et peut provoquer des dysfonctionnements de la moelle osseuse au cours du traitement. Cet effet se manifeste d'abord par une chute du taux d'hémoglobine lorsque le patient reçoit une dose cumulative de 20 g. L'anémie est entièrement réversible une fois que le médicament est arrêté et ne prédit pas le développement futur de l'anémie aplasique. Des études chez les souris ont suggéré que les dommages de la moelle osseuse résultant des effets toxiques du chloramphénicol sont aggravés si la moelle osseuse est initialement endommagée[8]. Chez l'enfant, le risque de leucémie est augmenté avec la durée du traitement[9].
L'utilisation de chloramphénicol intraveineux est associée au syndrome du bébé gris (en)[10]. Les nourrissons ne disposant pas encore des enzymes hépatiques entièrement fonctionnelles (comme l'UDP-glucuronyl transférase) ne métabolisent pas le chloramphénicol qui reste dans le corps. Cette présence provoque plusieurs effets indésirables dont l'hypotension et la cyanose. Ce syndrome peut être limité en utilisant le médicament aux doses recommandées et en surveillant les taux sanguins[11] - [12] - [13].
Mode d'action
Mécanisme standard
Le chloramphénicol est un antibiotique bactériostatique qui limite la synthèse des protéines en inhibant l'activité peptidyltransférase du ribosome bactérien. L'antibiotique se lie spécifiquement aux résidus A2451 et A2452 de l'ARNr 23S[14] de la sous-unité 50S du ribosome bactérien et empêche la formation de la liaison peptidique. Le chloramphénicol et les macrolides ont les mêmes effets d'inhibition de la synthèse de peptides, le chloramphénicol interagit directement sur le ribosome alors que les macrolides bloquent stériquement la progression de la croissance peptidique[15] - [16] - [17].
Mécanisme de résistance
Il existe trois mécanismes de résistance au chloramphénicol[18] : une réduction de la perméabilité membranaire de l'antibiotique, une mutation sur la sous-unité 50S du ribosome bactérien et la présence d'une enzyme appelée chloramphénicol acétyltransférase.
Le mécanisme le plus commun pour des résistances de faible intensité au chloramphénicol est une baisse de la perméabilité membranaire à l'antibiotique. La mutation de la sous-unité 50S est extrêmement rare. La résistance la plus forte à l'antibiotique provient de la présence du gène cat qui code une enzyme appelée chloramphénicol acétyltransférase qui dérive de la S-acétyl-coenzyme A. Cette enzyme permet d'acétyler un ou deux groupements hydroxyle du chloramphénicol et ainsi d’empêcher sa fixation sur le ribosome.
Le gène cat codant la résistance au chloramphénicol peut être trouvé sur des plasmides portant des résistances à d'autres molécules. Ainsi, le plasmide Accot (Ampicilline, Chloramphénicol, cotrimoxazole, tétracycline) est un plasmide qui régule la résistance multidrogues chez le Bacille d'Eberth, responsable de la fièvre typhoïde[19].
Pharmacocinétique
Le chloramphénicol est une molécule fortement soluble dans les lipides ; c'est une molécule de faible poids moléculaire et qui se lie peu aux protéines. Elle pénètre efficacement dans tous les tissus du corps, y compris le cerveau mais sa distribution est non uniforme. Les concentrations de chloramphénicol les plus élevées sont trouvées dans le foie et les reins, les plus faibles concentrations étant trouvées dans le cerveau et le liquide céphalorachidien avec une concentration d'environ 30 à 50 % de la concentration moyenne du corps. Lorsque les méninges sont enflammées, la concentration de chloramphénicol dans les méninges correspond à 89 % de la concentration moyenne.
Le chloramphénicol est métabolisé par le foie en une molécule inactive, le chloramphénicol glucuronate. En cas d'insuffisance hépatique, la dose de chloramphénicol doit être ajustée en fonction des concentrations plasmatiques mesurées.
Le chloramphénicol est un inhibiteur très efficace des isoformes CYP2C19 et CYP3A4 du cytochrome P450 dans le foie[20]. L'inhibition de l'isoforme CYP2C19 entraîne une diminution du métabolisme et donc une augmentation de la concentration d'antidépresseurs, d'antiépileptiques, d'inhibiteurs de la pompe à protons et d'anticoagulants si ces molécules sont administrées en association avec l'antibiotique. L'inhibition de l'isoforme CYP3A4 entraîne une augmentation de la concentration des inhibiteurs calciques, des immunosuppresseurs, des médicaments chimiothérapeutiques, des benzodiazépines, des antifongiques azolés, des antidépresseurs tricycliques, des antibiotiques macrolides, des ISRS, des statines, des antiarythmiques cardiaques, des antiviraux, des anticoagulants et des inhibiteurs de la PDE5.
Le chloramphénicol est un antagoniste de la plupart des céphalosporines, l'utilisation associée de ces deux molécules doit être évitée dans le traitement des infections.
Découverte
Le chloramphénicol est isolé en 1947 à partir de culture Streptomyces venezuelae (en) par John Ehrlich[21]. Il est synthétisé pour la première fois par la chimiste Mildred Rebstock à partir de produits chimiques facilement disponibles en [22]. Il devient le premier antibiotique synthétisé industriellement à grande échelle. Les derniers produits (topiques) disponibles ont été retirés du marché français en 2008[23].
Autres Usages
Le chloramphénicol est également utilisé en médecine vétérinaire, son emploi est cependant très limité. Il est actuellement considéré comme le traitement le plus efficace de chlamydioses chez les koalas[24] - [25]. Des études tendent à démontrer que l'antibiotique pourrait être employé dans le traitement de la chytridiomycose des amphibiens.
Il est utilisé en association avec la gentamicine dans des milieux de culture en mycologie pour empêcher la croissance des bactéries et favoriser ainsi celle des champignons.
Il est utilisé notamment en Chine et en Argentine dans les ruches pour augmenter la ponte des reines et donc la production de miel[26].
Divers
Le chloramphénicol fait partie de la liste des médicaments essentiels de l'Organisation mondiale de la santé (liste mise à jour en )[27].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chloramphenicol » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Chloramphénicol » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 24 avril 2009
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Évaluations Globales de la Cancérogénicité pour l'Homme, Groupe 2A : Probablement cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le ).
- (en) JJ Jr Rahal et MS Simberkoff, « Bactericidal and bacteriostatic action of chloramphenicol against memingeal pathogens. », Antimicrobial agents and chemotherapy, vol. 16, no 1, , p. 13-18 (PMID 38742, PMCID PMC352780)
- (en) R Wallerstein, P Condit, C Kasper, J Brown et F Morrison, « Statewide study of chloramphenicol therapy and fatal aplastic anemia », The Journal of the American Medical Association, vol. 208, no 11, , p. 2045-2050 (PMID 5818983, DOI 10.1001/jama.208.11.2045)
- (en) T Lancaster, AM Stewart et H Jick, « Risk of serious haematological toxicity with use of chloramphenicol eye drops in a British general practice database », British Medical Journal, vol. 316, no 7132, , p. 667 (PMID 9522792, PMCID 28473, DOI 10.1136/bmj.316.7132.667, lire en ligne)
- (en) AA Yunis, « Chloramphenicol toxicity: 25 years of research. », The American journal of medecine, vol. 87, no 3N, , p. 44N-48N (PMID 2486534)
- (en) A Morley, K Trainor et J Remes, « Residual marrow damage: possible explanation for idiosyncrasy to chloramphenicol. », British journal of haematology, vol. 32, no 4, , p. 525-531 (PMID 1259934, DOI 10.1111/j.1365-2141.1976.tb00955.x)
- (en) XO Shu, YT Gao, MS Linet, LA Brinton, RN Gao, F Jin et JF Jr Fraumeni, « Chloramphenicol use and childhood leukaemia in Shanghai. », Lancet, vol. 2, no 8565, , p. 934-937 (PMID 2889862)
- (en) V Piñeiro-Carrero et E Piñeiro, « Liver », Pediatrics, vol. 113, no 4 Supplément, , p. 1097–1106 (PMID 15060205, lire en ligne)
- (en) H Feder, « Chloramphenicol: what we have learned in the last decade », Southern Medical Journal, vol. 79, no 9, , p. 1129–1134 (PMID 3529436, DOI 10.1097/00007611-198609000-00022)
- (en) A Mulhall, J de Louvois et R Hurley, « Chloramphenicol toxicity in neonates: its incidence and prevention », British Medical Journal (Clinical Research Edition), vol. 287, no 6403, , p. 1424–1427 (PMID 6416440, PMCID 1549666, DOI 10.1136/bmj.287.6403.1424)
- (de) J Forster, C Hufschmidt, H Niederhoff et W Künzer, « [Need for the determination of chloramphenicol levels in the treatment of bacterial-purulent meningitis with chloramphenicol succinate in infants and small children] », Monatsschrift Kinderheilkunde, vol. 133, no 4, , p. 209–213 (PMID 4000136)
- (en) JM Schifano, R Edifor, JD Sharp, M Ouyang, RN Husson et NA Woychik, « Mycobacterial toxin MazF-mt6 inhibits translation through cleavage of 23S rRNA at the ribosomal A site. », Proceedings of the National Academy of Sciences of the United States of America, vol. 110, no 21, , p. 8501-8506 (PMID 23650345, PMCID PMC3666664, DOI 10.1073/pnas.1222031110)
- (en) O Jardetzky, « Studies on the Mechanism of Action of Chloramphenicol - The Conformation of Chloramphenicol in Solution. », The Journal of Biological Chemistry, vol. 238, no 7, , p. 2498-2508 (PMID 13957484, PMCID PMC3666664, DOI 10.1073/pnas.1222031110, lire en ligne)
- (en) AD Wolfe et FE Hahn, « Mode of Action of Chloramphenicol. IX. Effects of Chloramphenicol Upon a Ribosomal Amino Acid Polymerization System and Its Binding to Bacterial Ribosome », Biochimica et Biophysica Acta, vol. 95, , p. 146-155 (PMID 14289020, DOI 10.1016/0005-2787(65)90219-4)
- (en) FE Hahn, CL jr Wisseman et HE Hopps, « Mode of Action of Chloramphenicol III. : Action of Chloramphenicol on Bacterial Energy Metabolism », Journal of Bacteriology, vol. 69, no 2, , p. 215-223 (PMID 14353832, PMCID 357505)
- « RESISTANCE AUX ANTIBIOTIQUES », sur http://anne.decoster.free.fr
- (en) TM Al-Sanouri, B Paglietti, A Haddadin, M Murgia, D Bacciu, M Youssef et S Rubino, « Emergence of plasmid-mediated multidrug resistance in epidemic and non-epidemic strains of Salmonella enterica serotype Typhi from Jordan. », Journal of Infection in Developing Contries, vol. 2, no 4, , p. 295-301 (PMID 19741292)
- (en) JY Park, KA Kim et SL Kim, « Chloramphenicol Is a Potent Inhibitor of Cytochrome P450 Isoforms CYP2C19 and CYP3A4 in Human Liver Microsomes. », Antimicrobial Agents and Chemotherapy, vol. 47, no 11, , p. 3464–3469 (PMID 14576103, PMCID 253795, DOI 10.1128/AAC.47.11.3464-3469.2003)
- (en) O. Pongs et Fred E. Hahn, Mechanism of Action of Antibacterial Agents, Berlin, Heidelberg, Springer Berlin Heidelberg, coll. « Antibiotics Volume V Part 1 », , 26–42 p. (ISBN 978-3-642-46403-4), « Chapter 3: Chloramphenicol »
- (en) William Rosen, Miracle Cure: The Creation of Antibiotics and the Birth of Modern Medicine, Penguin, (ISBN 978-0-698-18410-7, lire en ligne).
- « CEBENICOL - Chloramphénicol - Posologie, Effets secondaires, Grossesse », sur Doctissimo (consulté le ).
- M. Govendir, J. Hanger, J. J. Loader, B. Kimble, JE Griffith, LA Black, MB Krockenberger et DP Higgins, « Plasma concentrations of chloramphenicol after subcutaneous administration to koalas (Phascolarctos cinereus) with chlamydiosis », Journal of Veterinary Pharmacology and Therapeutics, vol. 35, no 2, , p. 147–154 (ISSN 0140-7783, DOI 10.1111/j.1365-2885.2011.01307.x).
- (en) JE Griffith et DP Higgins, « Diagnosis, treatment and outcomes for koala chlamydiosis at a rehabilitation facility (1995–2005). », Australian Veterinary Journal, vol. 90, no 90, , p. 457–463 (PMID 23106328, DOI 10.1111/j.1751-0813.2012.00963.x)
- B. F, « Dix miels retirés de la vente par Meli ! », sur DHnet (consulté le )
- WHO Model List of Essential Medicines, 18th list, avril 2013
Voir aussi
Articles connexes
Liens externes
- Ressources relatives à la santé :
- ChEMBL
- DrugBank
- (en) International Union of Pharmacology
- (en) Medical Subject Headings
- (en + es) MedlinePlus
- (en) National Drug File
- (en) PatientLikeMe
- (cs + sk) WikiSkripta
- Notices dans des dictionnaires ou encyclopédies généralistes :
- chloramphénicol sur la BIAM, Banque de Données Automatisée sur les Médicaments (Web Archive)
- Compendium suisse des médicaments : spécialités contenant Chloramphénicol
- Spectre infrarouge et spectre de masse sur NIST
- Reptox