Propylène glycol
Le propylène glycol (PG) ou propane-1,2-diol, appelé aussi 1,2-dihydroxypropane ou méthyl glycol, est un diol de formule chimique CH3–CHOH–CH2OH ayant de nombreux usages industriels ou agropharmaceutiques, à faible dose comme additif alimentaire (E1520) et depuis peu dans les cigarettes électroniques (liquide à vapoter).
| Propylène glycol | |
| |
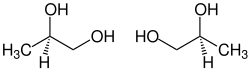
| Énantiomères (R)-(–) à gauche et (S)-(+) à droite. | |
| Identification | |
|---|---|
| Nom UICPA | Propane-1,2-diol |
| Synonymes |
propane-1,2-diol |
| No CAS | (racémique) (S+) (R-) |
| No ECHA | 100.000.307 |
| No CE | 200-338-0 |
| PubChem | 1030 |
| No E | E1520 |
| FEMA | 2940 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, inodore, hygroscopique, visqueux[1]. |
| Propriétés chimiques | |
| Formule | C3H8O2 [Isomères] |
| Masse molaire[2] | 76,094 4 ± 0,003 6 g/mol C 47,35 %, H 10,6 %, O 42,05 %, |
| pKa | 14,8 (25 °C)[3] |
| Moment dipolaire | 2,25 D [4] |
| Diamètre moléculaire | 0,533 nm [4] |
| Propriétés physiques | |
| T° fusion | −59 °C[1] |
| T° ébullition | 188,2 °C[1] |
| Solubilité | Soluble dans l'éther[3]. Insoluble dans les huiles |
| Paramètre de solubilité δ | 25,8 J1/2·cm-3/2 (≤20 °C)[4] |
| Miscibilité | Miscible à l'eau[3], l'acétone[3], le chloroforme[3], l'alcool. |
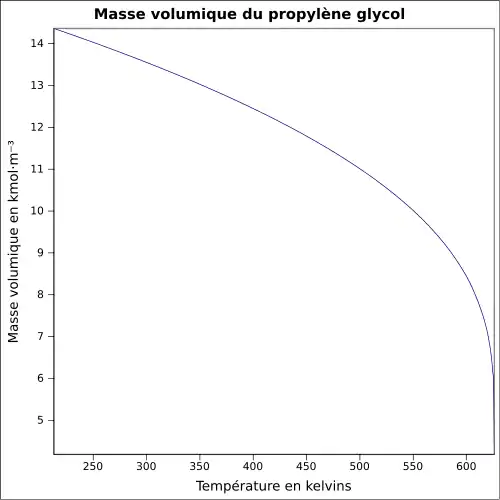
| Masse volumique | 1,036 g·cm-3 (25 °C)[3]
|
| T° d'auto-inflammation | 371 °C[1] |
| Point d’éclair | 99 °C (coupelle fermée); 107 °C (coupelle ouverte)[1] |
| Limites d’explosivité dans l’air | 2,6–12,6 %vol[1] |
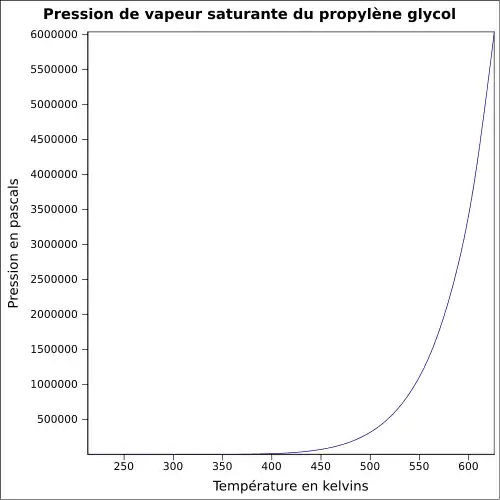
| Pression de vapeur saturante | à 20 °C : 10,6 Pa[1]
|
| Viscosité dynamique | 0,581 poise (20 °C)[3] |
| Thermochimie | |
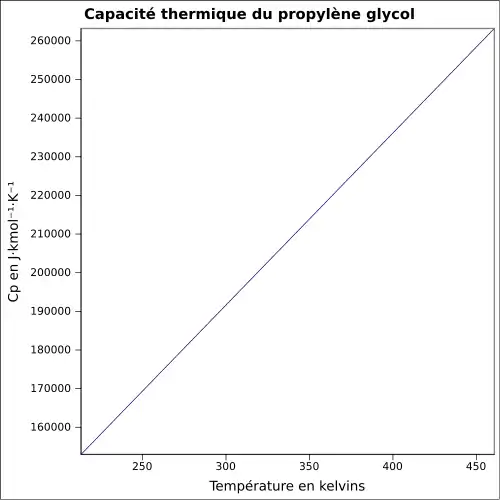
| Cp | |
| Propriétés optiques | |
| Indice de réfraction | 1,4314 [4] |
| Précautions | |
| SIMDUT[7] | |
Produit non contrôlé |
|
| NFPA 704 | |
| Directive 67/548/EEC | |
 Xi |
|
| Écotoxicologie | |
| DL50 | 10 à 30 g·kg-1[8] |
| Autre | S'enflamme au contact de KMnO4 après 40 secondes. |
| LogP | -0,92[1] |
| Données pharmacocinétiques | |
| Métabolisme | Oxydé dans le foie en acide lactique puis acide pyruvique[8] |
| Demi-vie d’élim. | 4 heures[8] |
| Composés apparentés | |
| Isomère(s) | Propane-1,3-diol |
| Unités du SI et CNTP, sauf indication contraire. | |
Le propylène-glycol est obtenu à partir de la réaction de l'oxyde de propylène avec l'eau pour former du monopropylène glycol (MPG), les réactions ultérieures produisant des di-(DPG), tri-(TPG) et autres propylène-glycols.
Stéréochimie
L'atome de carbone 2 est asymétrique. Le propane-1,2-diol est donc chiral et se présente sous la forme d'une paire d'énantiomères, l'énantiomère R étant lévogyre tandis que le S est dextrogyre. Le propylène glycol est le plus souvent sous la forme d'un racémique.
Production
La société PKN Orlen produit du propylène glycol à partir de glycérol issu de la production de biogazole dans son usine de Trzebinia en Pologne[9].
Utilisations
Le propylène glycol est utilisé principalement dans la fabrication de résines de polyesters insaturés[10]
C'est une molécule abondamment utilisée, notamment dans les domaines suivants :
- L'industrie alimentaire l'utilise à faibles doses comme émulsifiant (E1520), dans les plats préparés (sauces et assaisonnements) et/ou comme solvant de certains arômes dans certains arômes liquides.
- Dans les cigarettes électroniques, en tant que liquide de remplissage dans lequel sont éventuellement ajoutés glycérol, arômes et nicotine, afin de produire un aérosol simulant la fumée du tabac.
- L'industrie pharmaceutique et les médecins l'utilisent également : il compte par exemple pour 40 % de la composition d'un médicament à base de phénytoïne (Dilantin).
- L'Industrie cosmétique en fait un humectant anti-moisissure dans certains cosmétiques, tout comme l'industrie du tabac. Il remplace souvent la glycérine comme excipient, et parfois abusivement présenté comme hydratant (tout comme la glycérine, qui ne peut que freiner une éventuelle déshydratation par la peau).
- L'industrie textile le mobilise pour la fabrication de certaines fibres (polyester).
- Les éleveurs de ruminants le donnent oralement aux bestiaux comme composé dont une partie sera modifiée en propionates par le microbiote du rumen. Ce propionate et le propylène glycol restant sont des précurseurs de la néoglucogenèse hépatique, d’où leur intérêt pour éviter l'acétonémie en début de lactation.
- L'industrie du spectacle (discothèque, théâtre, cinéma, plateaux de TV) l'utilise pour alimenter les machines à fumées : son évaporation permet de produire un aérosol réputé non toxique[11] et permettant des effets spéciaux (fausses vapeurs, brumes artificielles, matérialisation des rayons laser ou lumineux...), a priori sans danger pour les acteurs ou les spectateurs.
- L'industrie aéronautique, l'aviation civile ou militaire l'utilisent en aspersion sur les ailes des avions afin d'y réduire la formation de glace : le givre est à l'origine d'environ 10 % des accidents d'avions[12]). Et l'industrie des systèmes de climatisation/chauffage l'utilise parfois comme antigel non-corrosif et améliorant les transferts de chaleur[13] dans les circuits et applications sensibles (ex. : compresseurs de gaz de pompes à chaleur, capteurs solaires, chambres froides alimentaires…) où il remplace l'éthylène glycol, moins coûteux mais toxique pour l'Homme et l'environnement.
- Il permet de produire des solutions de nanoparticules sans qu'elles ne s'agglomèrent[14] (avec un risque toxicologique et écotoxicologique alors renforcé par une bioassimilabilité plus importante de ces nanoparticules).
Toxicologie
Voie orale
Le propylène-glycol est principalement absorbé par voie digestive. Il est oxydé dans le foie en acide lactique, puis en acide pyruvique, qui est utilisé par le corps humain comme source d'énergie. Chez l'être humain il est éliminé du sang avec une demi-vie de deux heures et de l'organisme avec une demi-vie de quatre heures [8].
Des volontaires ont été exposés à environ 309 mg/m³ pendant une minute. Une légère obstruction significative des voies respiratoires (diminution 2 % VEMS/CVF) a été observée[10].
À la suite de l'ingestion de très fortes doses de propylène glycol chez l'homme et l'animal, des effets hématologique, hyperosmotique, cardiovasculaire et des effets sur le système nerveux central ont été rapportés. Une forte concentration sanguine de propylène glycol peut amener de l'acidose métabolique et des changements hyperosmotiques dans le sang[10].
Les cas d'intoxication au propylène glycol sont plus généralement liés à une administration intraveineuse ou à l'ingestion accidentelle de grandes quantités par des enfants[15] - [16].
L'inhalation de 321 ppm de propylène glycol pendant 90 jours chez le rat cause un épaississement de l'épithélium respiratoire et un grossissement des cellules caliciformes. Une diminution du compte des globules blancs a également été observée chez le rat femelle tandis que l'exposition à 707 ppm cause une diminution de la concentration moyenne d'hémoglobine et du compte des globules blancs. Aucun changement dose-réponse des globules rouges n'a été observé chez le rat mâle[10].
Voie cutanée
Le contact prolongé avec la peau n'est pas ou peu irritant[17]. On constate une irritation modérée en cas de contact cutané occlusif ou de projection de produit non-dilué [8]. Il existe toutefois des cas d'allergie[18] ou d’eczéma de contact (par exemple lors de l'utilisation de crèmes dermiques utilisées pour traiter l'herpès labial[19]). Il est fortement irritant pour les yeux. De manière générale, il est recommandé d'éviter le contact du produit avec la peau ou les yeux.
Voie respiratoire
Lors d'une étude par inhalation d'aérosol contenant 10 % de propylène glycol (dans l'eau déionisée) chez l'homme (diamètre moyen en masse de l'aérosol : 4,8 à 5,4 µm, pendant 1 h), il y a eu moins de 5 % du brouillard qui est pénétré dans l'organisme[10].
Des effets hématologique, hyperosmotique, cardiovasculaire et des effets sur le système nerveux central ont été rapportés. Une forte concentration sanguine de propylène glycol peut amener de l'acidose métabolique et des changements hyperosmotiques dans le sang[10].
Effets cancérigènes
Les données disponibles ne montrent pas d'effet cancérogène chez le rat et la souris[8] - [20].
Effets sur le système reproducteur
Le propylène-glycol n’agit ni sur la fertilité ni sur le développement des animaux[8].
Toxicité indirecte
Comme tout solvant, le propylène glycol peut présenter une toxicité indirecte, étant capable de solubiliser un grand nombre de produits potentiellement toxiques issus de la chimie organique[21]. En tant que surfactant ou solvant, sa capacité à augmenter la toxicité de certains pesticides tels que le diuron, l'atrazine et l'aminotriazole est discutée[22].
Intoxication
Elle peut être due à une ingestion accidentelle, mais aussi par l'injection, à fortes doses, de certains médicaments, dont le propylène glycol constitue le diluant[23].
Dose létale et concentration létale
la dose létale a été établie chez l'animal[10].
| Rat (Orale) : | 21,7 g/kg |
|---|---|
| Souris (Orale) : | 24,8 g/kg |
| Cochon d'Inde (Orale) : | 18,3 g/kg |
| Lapin (Orale) : | 19,3 g/kg |
A fortes doses, la molécule peut provoquer une insuffisance rénale, une insuffisance hépatique. Au niveau biologique, il existe une acidose lactique, une hyperosmolarité. Le traitement repose sur l'hémodialyse[24].
Notes et références
- PROPYLENEGLYCOL, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « PROPYLENE GLYCOL », sur Hazardous Substances Data Bank (consulté le ).
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 978-0-471-98369-9, LCCN 98018212).
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 978-0-07-049841-9, LCCN 96051648), p. 2-50.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C8 to C28, vol. 1, Huston, Texas, Gulf Pub. Co., , 396 p. (ISBN 978-0-88415-857-8, LCCN 96036328).
- « Propylène glycol » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- Fiche toxicologique FT 226 de l'Institut national de recherche et de sécurité (INRS), 1994.
- (en) Alex Scott, « Orlen opens biopropylene glycol plant in Poland »
 , sur Chemical & Engineering News, (consulté le ).
, sur Chemical & Engineering News, (consulté le ). - « Fiche complète pour Glycol de propylène - CNESST », sur www.csst.qc.ca (consulté le )
- Werley MS, McDonald P, Lilly P, Kirkpatrick D, Wallery J, Byron P, Venitz (2011) Non-clinical safety and pharmacokinetic evaluations of propylene glycol aerosol in Sprague-Dawley rats and Beagle dogs. J. Toxicology. 2011 Sep 5; 287(1-3):76-90. Epub 2011 Jun 12 ().
- « How does ice cause a plane to crash? », sur Scientific American (consulté le ).
- Holfield, R. (1995). Glycol coolants improve heat transfer and corrosion control. Pipeline & gas journal, 222(3), 28-30 (résumé).
- Bonet, F., Delmas, V., Grugeon, S., Herrera Urbina, R., Silvert, P. Y., & Tekaia-Elhsissen, K. (1999) Synthesis of monodisperse Au, Pt, Pd, Ru and Ir nanoparticles in ethylene glycol. NanoStructured Materials, 11(8), 1277-1284.
- Guillot M.; Bocquet G.; Eckart P.; Amiour M.; El-Hachem C.; Garnier R.; Galliot-Guilley M.; Haguenoer J. M., « Environnement domestique et intoxication aiguë au propylène glycol chez un nourrisson de deux ans. À propos d'une observation inhabituelle. », sur http://cat.inist.fr, Archives de pédiatrie, 2002, vol. 9, no4, pp. 382-384, e.
- National Library of Medicine;.Propylene glycol is used in antifreezes Human Toxicity Excerpts: CAS Registry Number: 57-55-6 (1,2-Propylene Glycol). Selected toxicity information from HSDB. 2005.
- Agency for Toxic Substances and Disease Registry (2008). Addendum to the Toxicological Profile for Propylene Glycol. p. 7.
- Fisher, A. A. (1990). Use of glycerin in topical minoxidil solutions for patients allergic to propylene glycol. Cutis, 45(2), 81-82.
- Claverie, F., Giordano-Labadie, F., & Bazex, J. (1997). Eczéma de contact au propylène glycol: Concentration et véhicule adaptés pour les tests épicutanés. In Annales de dermatologie et de vénéréologie (Vol. 124, No. 4, p. 315-317). Masson.
- (en) U.S. DEPARTMENT OF HEALTH AND HUMAN SERVICES Public Health Service Agency for Toxic Substances and Disease Registry, « ATSDR - Toxicological Profile: Propylene Glycol » [PDF], sur www.atsdr.cdc.gov, (consulté le ).
- Neipp, L. (1957). Action du propylène-glycol et d’autres substances à fonction alcool sur l’activité antibactérienne. Pathobiology, 20(2), 150-160. (extrait ).
- Brinquin, L., Rousseau, J. M., Corbe, H., DIRAISON, Y., & BONSIGNOUR, J. (1993). Intoxication aiguë volontaire par herbicide à base de diuron, d'atrazine et d'aminotriazole: toxicité du solvant, le propylène-glycol?. Journal européen des urgences, 6(1), 20-22 (résumé).
- Kraut JA, Mullins ME, Toxic alcohols, N Engl J Med, 2018;378:270-280.
- Zar T, Graeber C, Perazella MA, Recognition, treatment, and prevention of propylene glycol toxicity, Semin Dial, 2007;20:217-219.
Voir aussi
Articles connexes
Liens externes
Bibliographie
- (en) Vasilevskaya, V. V., Khokhlov, A. R., Matsuzawa, Y., & Yoshikawa, K. (1995). Collapse of single DNA molecule in poly (ethylene glycol) solutions. The Journal of chemical physics, 102(16), 6595.
- (en) Sawhney, A. S., Pathak, C. P., & Hubbell, J. A. (1993). Bioerodible hydrogels based on photopolymerized poly (ethylene glycol)-co-poly (. alpha.-hydroxy acid) diacrylate macromers. Macromolecules, 26(4), 581-587.