Polonium 210
Le polonium 210, noté 210Po, est l'isotope du polonium dont le nombre de masse est égal à 210. C'est le plus abondant des trente-trois isotopes du polonium[2]. Sa demi-vie est de 138,376 jours. Il a été découvert en 1898 par Marie Curie[2]. Ce radionucléide naturel n'est présent dans l'air et l'eau qu'à l'état de traces, mais il est omniprésent dans l’environnement terrestre où il peut être concentré par certains réseaux trophiques. Il est généralement conjointement trouvé avec ses deux précurseurs directs (radon 222, plomb 210).
| Demi-vie | 138,376(2) jours[1] |
|---|---|
| Produit de désintégration | 206Pb |
| Masse atomique | 209,9828737(12) u |
| Spin | 0+ |
| Excès d'énergie | −15 953,1 ± 1,1 keV[1] |
| Énergie de liaison par nucléon | 7 834,346 ± 0,005 keV[1] |
C'est un élément très dangereux par son extrême radiotoxicité. Il est en effet très volatil, et rapidement assimilé par les organismes vivants en raison de sa chimie proche de celles du tellure et du bismuth. Il est cancérigène[3] - [4]. C'est lui qui explique en partie au moins le cancer du poumon du fumeur et celui du mineur exposé à des résidus d'uranium[5] - [6]. Il peut être retrouvé dans certaines eaux de boisson[7].
Propriétés physiques
C'est un radioélément très volatil : un échantillon pur perd 50 % de sa masse en 45 heures en étant chauffé qu'à 55 °C (son point de fusion est de 254 °C), peut-être par désagrégation à l'échelle atomique induite par sa très forte radioactivité α, laquelle a d'ailleurs pour effet de le maintenir à température élevée.
Son noyau atomique compte 84 protons et 126 neutrons avec un spin 0+ pour une masse atomique de 209,982 87 g/mol. Il est caractérisé par un excès de masse de −15 953,1 ± 1,1 keV et une énergie de liaison nucléaire par nucléon de 7 834,34 keV[1].
Production artificielle
Il peut être obtenu par transmutation, en bombardant du bismuth 209 avec des neutrons, ce qui génère du bismuth 210, lequel se transforme en polonium 210 selon une demi-vie de 5,012 jours[2].
Cycle naturel
Il est présent à l'état de traces dans tous les compartiments du milieu naturel (eau, air, sols, écosystèmes), où il provient de la désintégration du radon 222.
Avec le 210Pb, il est géographiquement assez largement répandu dans l'environnent terrestre en tant qu'élément de la chaine de désintégration de 238U (très présent dans le manteau et en profondeur dans la croûte terrestre)[8].
- Dans l'air (basse troposphère), il peut provenir de la désintégration du 222Rn diffusant depuis des murs de granit, le sol ou le sous-sol (d'où il remonte via les galeries de mines, les failles, etc.). Sa gamme des concentrations d'activité dans l'air au niveau du sol varie de 0,03 à 0,3 Bq/m3 (à comparer à 0,2 à 1,5 Bq/m3 pour le plomb 210 (210Pb)[8].
- Dans l'eau de puits, sa concentration d'activité est d'environ 7 à 48 mBq/L (à comparer à environ 11 à 40 mBq/L pour le 210Pb). Cependant l'eau potable distribuée par les réseaux de distribution est d'environ 3 mBq/L (de même pour le 210Pb)[8].
- Dans les sols, provenant à la fois de la décroissance radioactive du radon 222 présent dans le sol et des retombées sèches du 210Po en suspension dans l’air, il s'adsorbe sur l'argile mais aussi sur des colloïdes organiques dans les premiers cm du sol ; sa concentration d'activité varie dans le sol selon la nature du substrat et le sous-sol (naturellement plus ou moins riche en uranium, faillé ou non, etc.). Toutes choses égales par ailleurs, la teneur du sol en polonium 210 est aussi corrélée avec la quantité de précipitations atmosphériques, les eaux météoritiques le rabattant vers le sol s'il n'a pas été capté au passage par des végétaux. Les niveaux moyens de radioactivité du 210Po dans les sols varient de 20 à 240 Bq/kg[8] (10 à 200 Bq/kg sur sol selon l'IRSN[2]). Des pics de concentration sont relevés dans les sols formés sur des stériles ou autres résidus d’exploitation de mines d’uranium (15 000 et jusqu'à 22 000 Bq/kg)[2].
Origines
Son précurseur étant un gaz radioactif (le radon 222), le polonium 210 est formé en grande partie en suspension dans l'air (concentration atmosphérique moyenne : dans l’air de l’ordre de 50 Bq/m3. Une seconde source d'émissions — elle est importante — est le volcanisme[2].
Cinétique environnementale
Les modèles de biocinétique sont encore en construction[9], mais on sait que les plantes se contaminent par des radionucléides radioactifs à la fois par absorption racinaire via l'eau du sol et via les éléments solubilisés par les acides organiques produits par leurs racines, ainsi que via leur réseau mycorhizien. Elles se contaminent aussi via leurs parties aériennes (feuilles principalement) à partir des dépôts (secs et/ou humides) de retombées radioactives[8].
Dans les feuilles fraîches de végétaux terrestres, le niveau de 210Po est particulièrement élevé (par rapport au reste de la plante) en raison de ces dépôts directs des produits de décomposition radioactive du radon (222Rn). Cette contamination est plus importante dans les contextes granitiques et uranifères (en présence de déchets industriels et miniers riches en uranium)[8]. Le tabac est connu pour en absorber des quantités particulièrement élevées (radioactivité équivalant en moyenne à 13 ± 2 Bq/kg), et, pour des raisons mal comprises, ce taux semble presque constant dans le temps et pour les origines géographiques (un phénomène assez similaire est constaté pour le 210Pb, souvent associé au 210Po)[8].
Les végétaux de la strate mucinale (bryophytes (mousses) et lichens croissant en contact direct avec le sol ou sur les roches, ainsi que dans les tourbières) peuvent efficacement capter à la fois le 210Po et le 210Pb à partir des retombées atmosphériques d'une part et à partir d’émanations du sol ou du sol et des eaux de ruissellement ou de la nappe superficielle d'autre part.
- Les tapis de mousses qui couvrent le sol en contiennent à hauteur de 0,5 à 5 kBq/m2.
- Les lichens en contiennent environ 0,6 kBq/m2. L’activité radioactive moyenne des lichens (en poids sec) se situe aux environs de 250 Bq/kg selon Persson et al. en 2011[8].
Les lichens et mousses épiphytes sont eux principalement exposés aux dépôts aériens[8].
Dans la toundra et la taïga, le renne et le caribou sont deux espèces qui, pour se nourrir, broutent de grandes quantités de lichen et un peu de bryophytes. Il s'ensuit dans leur chair une concentration d'activité de 210Po et de 210Pb équivalent à 1 à 15 Bq/kg.
Parce que ces animaux produisent du lait, divers sous-produits et de la viande consommée par l’homme (en zone périarctique principalement, mais le renne a été introduit dans certaines parties de l'hémisphère sud ; il en existe une population importante dans les îles Kerguelen). La chaine alimentaire lichen → renne ou caribou → être humain a fait l’objet d’études et a même été considérée comme un modèle pour étudier l'absorption et la rétention de 210Po (et du 210Pb) et les risques associés chez l'homme[8].
Dans les milieux subaquatiques (eau douce et environnement marin), les animaux (filtreurs tout particulièrement) bioconcentrent le 210Po et de 210Pb, ce qui explique que les fruits de mer en contiennent des doses plus élevées (et donc une radioactivité plus significative) que les algues ou aliments végétariens terrestres. Les consommateurs réguliers de fruits de mer sont exposés à une dose radioactive efficace qui « pourrait être 5 à 15 fois plus élevée » que s’ils ne consommaient que des produits végétaux[8]. Une étude a montré qu'en zone arctique les oiseaux marins absorbent préférentiellement le polonium 210 par rapport à son ancêtre le plomb 210[10].
Chez l'Homme
L'exposition humaine a d'autres sources que l'alimentation (inhalation d'air contaminé par du polonium ou du radon, tabagisme et inhalation de fumée ou cendres de bois notamment), mais certaines sources alimentaires sont plus concernées ; beaucoup d'aliments végétaux contiennent de faibles doses de 210Po et 210Pb, mais qui peuvent être concentrés via la chaine alimentaire chez les herbivores puis les carnivores ou nécrophages : selon les données disponibles au début des années 2010, outre les fruits de mer (voir plus haut), un consommateur régulier de viandes de renne ou de caribou (venaison issue de gibier chassé ou viande provenant d'élevage extensif, c'est-à-dire d'animaux ayant vécu dans leur milieu naturel et nourris avec des aliments industriels) sont exposés à une dose annuelle efficace de radioactivité due au 210Po et au 210Pb d’environ 260 μSv pour la consommation de renne et de 132 μSv pour la consommation de caribou[8].
Il en résulte des apports nutritionnels journaliers moyens médians (calculés pour la population mondiale adulte) qui seraient environ de 160 mBq et 110 mBq respectivement[8]. Ceci correspond à des doses efficaces annuelles de 70 μSv pour le 210Po et 28 μSv pour le 210Pb qui lui est souvent associé[8] ; alors que les apports alimentaires strictement végétariens ne sont que d’environ 70 mBq/jour pour le 210Po et 40 mBq/jour pour le 210Pb (soit des doses annuelles efficaces de 30,6 μSv et 10 μSv, respectivement)[8].
Radioactivité
Un gramme de polonium 210 présente une radioactivité élevée : 166,4 TBq (soit 1,66 × 1014 Bq par gramme de 210Po)[11].
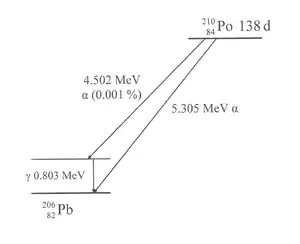
Il donne du plomb 206 par désintégration α avec une énergie de désintégration de 5 304,330 keV, une puissance spécifique[12] de 141,3 kW/kg, et une période radioactive de 138,376 jours[13] qui se déposent immédiatement et très localement dans la matière (après quelques microns de trajet) et à 0,001 % de rayonnements gamma d’énergie à 0,80 MeV[2].

- .
C'est donc un émetteur de rayonnement α particulièrement puissant : un milligramme de polonium 210 émet autant de particules α que 4,5 grammes de radium 226.
Le polonium 210 se désintègre en n'émettant que des particules α de 5 304,33 keV, sauf statistiquement, dans un cas sur cent mille environ, où il libère une particule α de 4 516,53 keV suivie d'un photon γ de 803,1 keV résultant de la désexcitation du noyau 206Pb produit transitoirement dans un état métastable. La faible énergie de ce rayonnement γ, ainsi que sa très faible quantité, rend la détection du polonium 210 par spectroscopie γ plutôt délicate ; la spectroscopie α reste le plus sûr moyen pour caractériser le 210Po. Toutefois la présence de ce rayonnement peut être précieuse s'il est impossible de tester directement au contact (par exemple, présence de polonium uniquement à l'intérieur d'un autre matériau qu'on ne souhaite pas détruire).
Utilisation comme source radioactive
Les particules α sont rapidement absorbées par la matière environnant la source qui les émet, leur énergie étant convertie en chaleur, ce qui a fait utiliser le polonium 210 par le passé comme source d'énergie dans les générateurs de chaleur et les générateurs électriques à radioisotopes de sondes spatiales et de robots d'exploration planétaires tels que les Lunokhod soviétiques, où il a servi pour maintenir les instruments à température suffisante pendant la nuit lunaire. Néanmoins, la relative brièveté de sa décroissance le rend surtout adapté aux applications nécessitant de libérer beaucoup d'énergie en peu de temps, de sorte qu'un radioisotope à plus longue période radioactive comme le plutonium 238 (près de 88 ans) répond bien mieux aux besoins d'une mission spatiale à destination de planètes lointaines.
Outre le domaine spatial, le polonium 210 est également utilisé dans les applications antistatiques, telles que certaines brosses industrielles pour matériels sensibles à l'électricité statique (le polonium 210 ionise l'air, ce qui supprime l'électricité statique[2]).
Associé au béryllium, il peut également être utilisé comme source de neutrons (les sources β lui sont cependant généralement préférées car nettement moins dangereuses)[2].
Radiotoxicité
Les seuils de radiotoxicité du polonium 210 sont de 0,51 µSv/Bq quand il est ingéré, et 2,5 µSv/Bq quand il est inhalé. Il est près d'un million de fois plus toxique que le cyanure de sodium ou de potassium[2].
Doses létales
- La dose létale médiane (DL50) : lors d'un syndrome d'irradiation aiguë, elle est de l'ordre de 4,5 Sv, la mort étant pratiquement certaine au-delà du double de cette valeur. Le 210Po ayant une activité massique de 166 TBq/g (4,500 Ci/g), une dose fatale à 50 % peut être obtenue par l'ingestion de 8,8 MBq (238 µCi), c'est-à-dire seulement 50 ng, ou par l'inhalation de 1,8 MBq (48 µCi), de l'ordre de 10 ng ; et une dose sûrement fatale correspond au double de ces doses.
- La dose létale pour une contamination chronique est a priori faible, mais encore mal définie.
Cinétique dans l'organisme humain
Elle est étudiée depuis les années 1950-1960 chez l'Homme[14] et l'animal de laboratoire : 50 % environ du polonium 210 absorbé à des doses non-mortelles est éliminé dans l'urine[15] avec une période biologique d'environ 50 jours (délai nécessaire pour éliminer de l'organisme la moitié du polonium incorporé). L’autre moitié circule dans le sang[16] et se fixera (via certaines protéines dites métallothionéines[17], notamment) au niveau du foie, de la rate, des reins[18] et de la moelle osseuse où il pourra continuer à faire des dégâts[2] (en particulier, dans la moelle osseuse, il va détruire les cellules souches qui produisent les cellules sanguines (globules rouges, globules blancs et plaquettes sanguines) en causant une anémie et une perte grave des défenses immunitaires de la personne[2] - [19] - [20] - [21] - [22] - [23] - [24] - [25] - [26] - [27].
Symptômes
Il n'y a pas de symptômes spécifiques pour l'intoxication chronique à très faible dose, mais les symptômes de l'intoxication aiguë sont ceux du syndrome d'irradiation aiguë (nausées, vomissements, perte de cheveux et immunodépression)[2].
Exemples
- Le polonium 210 est le poison qui a été utilisé pour assassiner en 2006 Alexandre Litvinenko[28]. Il est aussi suspecté comme cause de la mort de Yasser Arafat[29].
- Il est assimilé par les organismes vivants en raison d'une biochimie proche de celles du tellure et du bismuth : on a montré que certains micro-organismes sont capables de méthyler le polonium à l'aide de méthylcobalamine, de la même façon qu'elles peuvent méthyler le mercure, le sélénium et le tellure[30] - [31].
- On retrouve du polonium 210 dans les cigarettes, les mégots et la fumée du tabac[32]. La présence de polonium 210 sur les feuilles de tabac est liée à l'absorption de radon émanant du sol par la feuille et/ou de l'utilisation de certains engrais riches en phosphate[2] (engrais extraits de mines d'apatites, une roche qui contient du radium et du polonium).
Notes et références
-
(en) « Live Chart of Nuclides: 210
84Po
126 », sur https://www-nds.iaea.org/, AIEA, (consulté le ). - IRSN Les effets sur l'Homme Impact du polonium 210 sur l'homme (consulté le 3 février 2017)
- Yuile C.L, Berke H.L et Hull T (1967), Lung cancer following polonium-210 inhalati0,00on in rats, Radiation Research, 31(4), 760-774.
- Little J.B, McGandy R.B et Kennedy A.R (1978), Interactions between polonium-210 α-radiation, benzo (a) pyrene, and 0.9% NaCl solution instillations in the induction of experimental lung cancer, Cancer Research, 38(7), 1929-1935.
- Wagoner J.K., Archer V.E., Lundin Jr. F.E., Holaday D.A. et Lloyd J.W., Radiation as the cause of lung cancer among uranium miners, New England Journal of Medicine, 1965, 273(4), 181-188.
- Novak L.J. et Panov D., Polonium-210 in blood and urine of uranium mine workers in Yugoslavia, Am. Ind. Hyg. Assoc. J., mars 1972, 33(3):192-6
- Gerasimo P. et Laroche P., Surveillance radiologique des eaux de boissons, Revue française des Laboratoires, 2004 (364), 55-62.
- Persson B.R et Holm E (2011), Polonium-210 and lead-210 in the terrestrial environment: a historical review, Journal of Environmental Radioactivity, 102(5), 420-429.
- Leggett RW et Eckerman KF, A systemic biokinetic model for polonium, Sci. Total Environ., juillet 2001, 25;275(1-3):109-25.
- (en) Violeta Hansen, Anders Mosbech, Jens Søgaard-Hansen et Frank Farsø Rigét, « 210Po and 210Pb activity concentrations in Greenlandic seabirds and dose assessment », Science of The Total Environment, vol. 712, , p. 136548 (DOI 10.1016/j.scitotenv.2020.136548, lire en ligne, consulté le )
- Eric Ansoborlo, Philippe Berard, Christophe Den Auwer et Rich Leggett, « Review of Chemical and Radiotoxicological Properties of Polonium for Internal Contamination Purposes », Chemical Research in Toxicology, vol. 25, no 8, , p. 1551–1564 (ISSN 0893-228X, DOI 10.1021/tx300072w, lire en ligne, consulté le )
- (en) « Polonium », Argonne National Laboratory (consulté le )
- (en) « Désintégration du 210Po » (consulté le )
- Hill C.R., Polonium-210 in man, Nature, octobre 1965, 30;208(9):423-8.
- Casarett LJ, Morrow PE (1964), Distribution and excretion of polonium 210, XI. Autoradiographic studies after intratracheal administration in the rabbit, Radiat. Res., 51:SUPPL 5:175+.
- Campbell JE et Talley LH, Association of polonium-210 with blood, Proc. Soc. Exp. Biol. Med., octobre 1954, 87(1):221-3.
- Aposhian HV et Bruce DC (1991), Binding of polonium-210 to liver metallothionein, Radiat. Res., juin, 126(3):379-82
- Bruenger FW, Lloyd RD, Taylor GN, Miller SC et Mays CW (1990), Kidney disease in beagles injected with polonium-210, Radiat. Res., juin;122(3):241-51
- Baratta EJ, Apidianakis JC et Ferri ES, Cesium-167, lead-210 and polonium-210 concentrations in selected human tissues in the United States, Am. Ind. Hyg. Assoc. J., septembre-octobre 1969, 30(5):443-8.
- Berke HL et Dipasqua AC (1964), Distribution and excretion of polonium-210. VIII. After inhalation by the rat, Radiat. Res. ;51:SUPPL 5:133+
- Casarett L.J., Distribution and excretion of polonium 210. IX. Deposition, retention, and fate after inhalation by « nose only » exposure, with notes on mechanics of deposition and clearance and comparison of routes of administration, Radiat. Res., 1964;51:SUPPL 5:148+
- Casarett LJ (1964), Distribution and excretion of polonium-210. V. Autoradiographic study of effects of route of administration on distribution of polonium, Radiat. Res., 51:Suppl 5:93
- Cohen BS, Eisenbud M, Wrenn ME, Harley NH. (1979), Distribution of polonium-210 in the human lung, Radiat. Res., juillet, 79(1):162-8.
- Fellman A, Ralston L, Hickman D, Ayres L et Cohen N, Polonium metabolism in adult female baboons, Radiat. Res., février 1994, 137(2):238-50
- Finkel MP, Norris WP, Kisieleski WE et Hirsch GM, The toxicity of polonium 210 in mice. I. The thirty day LD50, retention, and distribution, Am. J. Roentgenol. Radium Ther. Nucl. Med., septembre 1953, 70(3):477-85.
- Lanzola EE, Allegrini ME, Taylor DM., The binding of polonium-210 to rat tissues, Radiat. Res., novembre 1973, 56(2):370-84.
- Morrow PE, Smith FA, Dellarosa RJ, Casarett LJ et Stannard JN (1964), Distribution and excretion of polonium-210. II. The early fate in cats, Radiat. Res., 51:SUPPL 5:60-6
- Nathwani AC, Down JF, Goldstone J, Yassin J, Dargan PI, Virchis A, Gent N, Lloyd D, Harrison JD, Polonium-210 poisoning: a first-hand account, Lancet, 2016;388:1075–1080
- (en) « Arafat et le polonium : l'imbroglio qui passe par Lausanne », Tribune de Genève (consulté le )
- (en) Momoshima N., Song L.X., Osaki S. et Maeda Y., « Formation and emission of volatile polonium compound by microbial activity and polonium methylation with methylcobalamin », Environ. Sci. Technol., vol. 35, no 15, , p. 2956–2960 (DOI 10.1021/es001730+, lire en ligne)
- (en) Momoshima N., Song L.X., Osaki S. et Maeda Y., « Biologically induced Po emission from fresh water », J. Environ. Radioact., vol. 63, , p. 187 (DOI 10.1016/S0265-931X(02)00028-0)
- Khater A.E., Polonium-210 budget in cigarettes, Journal of Environmental Radioactivity, 2004, 71(1), 33-41, lire en ligne.
Voir aussi
Articles connexes
Liens externes
- Notice dans un dictionnaire ou une encyclopédie généraliste :
- Argonne National Laboratory, Polonium.
Bibliographie
- Deus P., Petschat U. et Schmidt P. (1998), Transfer soil-wood of radionuclides of uranium decay series. In Radioactivity in man and environment, Pt. 2, résumé.
- D'Souza T.J. et Mistry K.B. (1970), Comparative uptake of thorium-230, radium-226, lead-210 and polonium-210 by plants, Radiation Botany, 10(3), 293-5, résumé
- Hill C.R. (1960), Lead-210 and polonium-210 in grass, Nature, 187, 211-212,résumé.
- Holtzman R.B. et Ilcewicz F.H. (1976), Lead-210 and polonium-210 in wood and the circulation of lead in trees, ANL-7615, 38-43.
- Howard B.J., Beresford N.A., Copplestone D., Telleria D., Proehl G., Fesenko S.… et Johansen M.P. (2013), The IAEA handbook on radionuclide transfer to wildlife, Journal of Environmental Radioactivity, 121, 55-74, résumé.
- Little J.B., Radford Jr. E.P. et Holtzman R.B. (1967), Polonium-210 in bronchial epithelium of cigarette smokers, Science, Washington, 155, 606-7, résumé
- Persson B.R. et Holm E. (2011), Polonium-210 and lead-210 in the terrestrial environment: a historical review, Journal of Environmental Radioactivity, 102(5), 420-429.
- Rajewsky B. et Stahlhofen W. (1966), Polonium-210 activity in the lungs of cigarette smokers, Nature, 209, 1312-13.
- Rowell J.B., Stakman E.C. et Butler E.E. (1952), The mutagenic action of dilute colloidal polonium on fungi, résumé.
- Sultzer M. et Hursh J.B. (1954), Polonium in urine of miners exposed to radon, Arch. Indust. Hyg. & Occupational Med., 9(2), 89-100, résumé.
- Tóth A., Kovács T. et Szeglet P. (2009), The polonium-210 content of some Hungarian macrofungi, Mikológiai Közlemények Clusiana, 48(1), 63-67.
| 1 | H | He | ||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og |
![{\displaystyle \mathrm {^{210}_{\ 84}Po\ {\xrightarrow[{138,376\ jours}]{\alpha \ 5,407\ MeV}}\ _{\ 82}^{206}Pb} }](https://img.franco.wiki/i/e0ade1b51470a611f575bdd40a9e0187bf560d0b.svg)