Faibles doses d'irradiation
Les faibles doses d'irradiation désignent en radiobiologie, épidémiologie et en physique médicale des expositions (externes ou internes) à des rayonnements ionisants qui se situent à un niveau faible (inférieures à 100 milligray) ou à de faibles débits de dose (moins de 5 milligray par heure), situation rencontrée « dans un large éventail de contextes médicaux, industriels, militaires et commerciaux »[1] et très largement inférieur à celui où apparaît un effet déterministe (brûlures, voire syndrome d'irradiation aiguë pour des expositions supérieures au gray). Il est sous les limites actuelles de détection des effets stochastiques (leucémies ou autres formes de cancers, voire peut-être mutations génétiques).
« Les expositions professionnelles aux rayonnements ionisants se produisent principalement à de faibles doses et peuvent accumuler des doses efficaces pouvant atteindre plusieurs centaines de milligray »[2]. Le domaine des doses inférieures à une dizaine de millisieverts par an, correspond à ce que reçoit la plus grande partie de la population, principalement via une exposition externe (induite par la radioactivité naturelle et les examens radiologiques) et moindrement via une exposition interne (notamment due au radon, à certains traitements ou examens médicaux ou à l'ingestion accidentelle de radionucléides). Hors accidents graves et accidents nucléaires, l'exposition induite par l'industrie nucléaire concerne surtout sur ses travailleurs. Ceci en fait un sujet complexe et polémique, et qui a une incidence sur l'optimisation des politiques de radioprotection et de santé publique. Mi-2022, les Académies américaines des sciences, de l'ingénierie et de la médecine suggèrent de relancer la recherche sur ce sujet, estimant que 100 millions de dollars par an seraient nécessaires durant 15 ans pour cela[1].
Questions ouvertes
En 2022, selon un rapport conjoint des Académies américaines des Sciences, de l'ingénierie et de médecine, « les effets de l'exposition à ces niveaux ne sont pas entièrement compris et on craint depuis longtemps qu'une telle exposition puisse avoir des effets négatifs sur la santé humaine. Bien que le cancer soit lié à l'exposition aux rayonnements à faible dose depuis des décennies, il existe de plus en plus de preuves qu'il peut également être associé à des maladies cardiovasculaires, des troubles neurologiques, un dysfonctionnement immunitaire et des cataractes ». Parmi les questions ouvertes :
- L'effet macroscopique reste difficile à évaluer pour des expositions inférieures au centigray car il ne peut être statistiquement étudié que par des études épidémiologiques classiques, basées sur l’extrapolation des effets cancérogènes observés entre 0,2 et 3 sieverts[3]. En outre, cet effet dépend à la fois de la dose reçue et du débit de dose radioactive, d'une manière encore mal comprise.
- Quelques exemples d'irradiation de cohorte statistique existent toutefois, comme le cas des 10 000 habitants d'immeubles contaminés de Taïwan, un exemple exceptionnel du point de vue de l'étude des faibles doses.
- Au niveau microscopique, pour un rayonnement traversant un tissu biologique, l'effet physique et chimique élémentaire dépend de la nature du rayonnement. Le gray, la grandeur de dose absorbée est l'une des grandeurs physiques en cause (énergie du rayonnement) ; l'effet dépend aussi du type de rayonnement et de contamination (externe, interne ou mixte) ainsi que du nombre et de la vulnérabilité des tissus et cellules traversés et dans une certaine mesure, du hasard. La traduction biologique de cet effet au niveau macroscopique (mesurée en Sievert) est un processus complexe encore en cours d'exploration.
Monde des faibles doses
Sources et modes d'irradiation
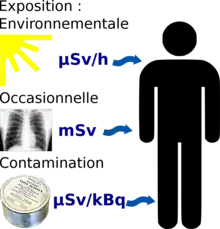
Les faibles doses d'irradiations peuvent être reçues suivant trois modalités. La principale source d'irradiation est naturelle, Le niveau d'exposition variant alors selon le lieu, généralement dans le rapport de un à trois. Localement, il peut être beaucoup plus élevé[4].
Les mesures d'irradiation et la radioactivité s'expriment en unité SI (sievert, becquerel...).
- le gray mesure l'irradiation physique, une énergie fournie par unité de masse, indépendamment de ses effets biologiques.
- le rad autrefois utilisé dans de nombreuses publications, correspond au centigray (ce qui explique que ce sous-multiple soit fréquemment utilisé).
- le sievert est utilisé pour mesurer les effets stochastiques d'une irradiation sur un organisme, avec des termes correctifs permettant de prendre en compte la dangerosité relative des différents rayonnements et la sensibilité relative des tissus.
- le becquerel, mesure le nombre de désintégrations radioactives par seconde. Il représente indirectement la quantité de matière radioactive présente si l'on connaît par ailleurs l'activité massique du radionucléide concerné.
Trois modes d'exposition sont :
- L'exposition à de faibles doses ponctuelles. Reçues en une seule fois, elles sont mesurées en millisieverts. Pour le public, il s'agit surtout d'examens radiologiques (radiographies, gammagraphies, scanners...).
- L'exposition (chronique ou épisodique) à un environnement irradiant. Il expose à un débit de dose plus ou moins élevé, mesuré en microsieverts par heure. Ce peut être un environnement de travail (cabinet médical de radiologie, mines ou installation de l'industrie nucléaire) ou habitation (vie en altitude ou dans une région riche en uranium ou en thorium, présence de radon...).
- La contamination interne par des radionucléides (acquis par inhalation, ingestion, en passage percutané ou via une blessure). Elle expose l'organisme à des rayonnements faibles, mais directement en contact avec les tissus, et sur une durée potentiellement longue (fonction de la période biologique du radioisotope, de son mode d'ingestion, de son état chimique...). Ces contaminations se mesurent en becquerels ; la plus ou moins grande radiotoxicité de la substance est évaluée en sieverts par becquerel (l'unité typique étant le µSv/kBq). Dans ce cas l'effet du rayonnement peut être aggravé par une éventuelle toxicité chimique du radionucléide[2]. Par rapport au rayonnement externe qui expose les organes de manière homogène, la contamination interne implique une exposition hétérogène des organes[2]. Par exemple l'iode radioactif sera fortement concentré dans la thyroïde.
Quand commence-t-on à parler de faibles doses ?
La limite des faibles doses est mal définie, car elle dépend de la vulnérabilité de l'organisme ou de l'organe étudié, et du domaine scientifique considéré[5] - [6] - [7] : le plafond proposé varie ainsi de 1 mGy pour la microdosimétrie à 200 mGy pour l'épidémiologie, en passant par 20 mGy pour la radiobiologie[8]. Pour la radioprotection, on s'intéresse généralement à la limite en dessous de laquelle aucun effet nocif des radiations n'est démontré, soit ≈100 mGy[5] - [9] - [10] : c'est donc cette limite qui est la plus couramment rencontrée[11] - [12].
Les « faibles doses » correspondent donc à des domaines de doses ou de débits variés mais souvent amalgamés. On peut facilement détecter des radioactivités de l'ordre du becquerel, qui correspondent à une irradiation de l'ordre du nano- voire pico-sievert, mais on est alors très en deçà des plafonds communément admis pour ce domaine, même si l'on prend la valeur de 1 mSv considéré pour la microdosimétrie. La différence entre l'irradiation détectable par les moyens modernes et celle dont on sait qu'elle a des effets prouvés est de neuf ordres de grandeur - quantitativement c'est la même différence qu'entre boire une larme (0,1 cm3) de whisky dans toute sa vie, et en boire dix litres par jour.
Ordres de grandeurs des faibles doses
En général, le domaine des faibles doses correspond aux doses inférieures à 10 mSv en radiobiologie, et aux doses inférieures à 100 mSv en radioprotection.
Une dose peut être considérée comme reçue en une seule exposition quand la durée d'irradiation est plus faible que le temps de réparation des cassures de l'ADN par la cellule, de l'ordre de l'heure.
| Niveau | Augmentation du risque statistique de cancer mortel par rapport au risque naturel existant dans la population générale d'après l'hypothèse LNT[13] - [14] | Dose en une exposition |
|---|---|---|
| 1 000 mSv =1 sievert |
1 / 20 | Seuil des effets déterministes : apparition de la fièvre des radiations. |
| 100 mSv | 1 / 200 | Limite de l'effet statistiquement observable des excès de cancers sur les survivants de Hiroshima et Nagasaki[4].
La limite d'exposition du personnel d'intervention est de 100 mSv en cas d’urgence radiologique, voire 300 mSv pour des interventions destinées à sauver des vies humaines (France)[15]. Les systèmes de réparation de l’ADN des cellules sont activés à des doses comprises entre 10 et 100 mSv. |
| 10 mSv | 1 / 2000 | En dessous du seuil de 2 cGy (20 mSv) on ne détecte plus d'augmentation de la fréquence d’aberrations chromosomiques[16].
Un scanner comportant dix coupes (voire beaucoup plus pour un scanner coronaire moderne) entraîne une exposition de 15 mSv[17]. Un scanner abdominal correspond à 12 mSv. Le demi million d'habitants des zones faiblement contaminées aux alentours de Tchernobyl recevra une dose cumulée sur 70 ans de l'ordre de 14 mSv[18]. |
| 1 mSv 1 000 µSv |
1 / 20 000 | Une exposition de l’ensemble de l’organisme à 1 mGy entraîne, en moyenne, la traversée de chaque cellule par un électron[19].
L'irradiation par scintigraphie est de l'ordre de 4 mSv lors de l'étude des os, et 2 mSv pour l'examen de la thyroïde[17]. |
| 100 µSv | 1 / 200 000 | Une radiographie des poumons entraîne une dose de 0,3 mSv[20] à 1 mSv[17]. Une radiographie dentaire correspond à une dose de 0,2 mSv. L'exposition moyenne due aux retombées des essais nucléaires atmosphériques a atteint un pic en 1963 avec 0,15 mSv[21]. Une mammographie correspond à une dose effective de 0,13 mSv[22]. |
| 10 µSv | 1 / 2 000 000 | Un voyage Paris-New York aller et retour : 0,06 mSv[20]. |
| 1 µSv | 1 / 20 000 000 | Les radionucléides contenus dans une cigarette entraînent en moyenne une exposition aux rayonnements de 7,3 µSv par cigarette[23] (outre l'exposition aux goudrons cancérigènes). |
Ordres de grandeurs des faibles débits de doses
La limite du domaine des faibles débits de dose, en dessous de laquelle aucun effet biologique n'a été détecté, peut être placée vers 1 mSv/h, voire 100 µSv/h, c'est-à-dire les limites réglementaires des zones contrôlées marquées « zones jaunes » en France. Dans la définition proposée par l'UNSCEAR, cette limite est placée à 0,1 mGy/min (moyennés sur une heure) du point de vue de la radioprotection, soit 6 mGy/h[8].
Ces débits de dose sont mesurés en milli- ou en microsieverts par minute, par heure ou par an.
Il s'agit presque toujours d'une irradiation par rayonnement gamma (ou par rayonnement X pour les cabinets médicaux). Mais les irradiations reçues à proximité immédiate d'un réacteur nucléaire (jusqu'à quelques dizaines de mètres) sont surtout dues aux flux de neutrons qui s'échappent du cœur (des dosimètres spéciaux les mesurent). Des neutrons sont également présents dans le rayonnement cosmique.
Pour une source externe, un faible débit de dose entraîne en pratique une faible irradiation (pour des durées d'exposition raisonnablement limitées). De forts débits de dose, dans des environnements exceptionnels, impliquent une forte irradiation : à la limite entre « zone orange » et « zone rouge », où le débit de dose serait de 100 mSv/h, on peut transiter pendant 6 minutes avant de recevoir une dose de 10 mSv (réglementairement acceptable en circonstances exceptionnelles), et il faut rester plusieurs heures pour atteindre une dose d'un sievert (niveau où apparaît la fièvre des radiations). Pour ces forts débits de dose, l'exposition est normalement exceptionnelle, la durée d'exposition est normalement inférieure à l'heure, et c'est la dose totale reçue en une seule exposition qu'il faut considérer pour en évaluer l'impact sanitaire.
| Niveau | Débit de dose | |
|---|---|---|
| 100 mSv/h |
|
 |
| 10 mSv/h |
|
 |
| 1 mSv/h 1 000 µSv/h |
|
 |
| 100 µSv/h |
|
|
| 100 mSv/an 11 µSv/h |
|
 |
| 10 mSv/an 1,1 µSv/h |
|
 |
| 1 mSv/an 110 nSv/h |
|
 |
| 100 µSv/an 11 nSv/h |
| |
| 10 µSv/an 1,1 nSv/h |
| |
| 1 µSv/an 0,11 nSv/h |
| |
| <1 µSv/an <0,11 nSv/h |
|
Progrès des connaissances en radiobiologie
Études des moyennes et fortes doses
De nombreuses études épidémiologiques ont permis d'estimer les effets stochastiques (principalement l'apparition leucémies à court terme et de cancers à long terme) des rayonnements ionisants pour des expositions entre 200 millisieverts et 5 sieverts. Il n'y a guère de contestation sur le fait que ces doses produisent des effets observables, et ces effets suivent le plus souvent une loi linéaire, c'est-à-dire que le risque de développer un cancer croît proportionnellement aux doses reçues[64]. Certaines exceptions sont cependant connues, par exemple l’observation des cancers osseux induits par le radium 226 (Radium girls[65]) et des cancers du foie induits par le Thorotrast, ou les leucémies induites à Hiroshima et chez les patients traités par l’iode radioactif[40].
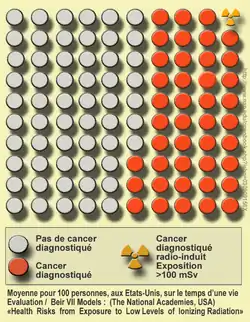
À partir des données sur les survivants des bombardements atomiques au Japon, il a été statistiquement établi qu'une exposition à un rayonnement de 2 sieverts (rayonnement gamma, uniformément réparti sur le corps, et reçu en quelques secondes) conduit à doubler le risque de mourir d'un cancer, c'est-à-dire engendre un « risque relatif » de deux[66]. C'est ce chiffre, associé à l'idée d'une relation linéaire entre dose et effet, qui est à la base de la « règle » qu'une exposition à 100 mSv conduit à un risque relatif de 1.05, ou encore (du fait que le risque « naturel » est de l'ordre de 20 %) qu'une exposition à 100 mSv entraîne une probabilité de 1 % de provoquer un cancer.
Ces études ne permettent d'estimer que les effets de doses supérieures ou égales à 100 mSv chez l'adulte, reçues avec des débits de dose élevés. L’extrapolation des effets des fortes doses à ceux des faibles doses ne reflète absolument pas la réalité[67]. L'extrapolation de ces constantes et de ce modèle linéaire en dessous de cette limite est l'objet du débat sur les faibles doses. Étudier les effets liés à de faibles expositions chroniques est donc primordial.
Limites statistiques des études épidémiologiques
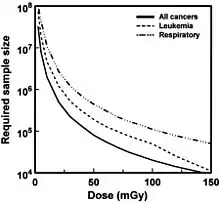
En effet, il n'est pas possible d'observer les éventuels effets de faibles doses d'irradiation, car des cancers apparaissent spontanément dans la population, avec une certaine moyenne (ligne de base), et des variations aléatoires autour de cette moyenne (bruit statistique). Pour qu'un excès de cancer radio-induit soit observable, il doit être nettement supérieur à ces variations aléatoires ; en d'autres termes, le rapport signal sur bruit doit être suffisant. En règle générale, le signal croît proportionnellement à la taille N de la population alors que le bruit des fluctuations, proportionnel à l'écart-type, croît avec la racine carrée de N; le rapport signal/bruit s'améliore donc comme la racine carrée de la taille N de la cohorte.
Ainsi, sur la base du modèle linéaire sans seuil, 500 personnes exposées suffisent , théoriquement, à détecter (8 fois sur 10) les effets d'une dose de 1 000 mSv. Pour détecter les effets d'une dose dix fois moindre (100 mSv),il faut une population exposée d'au moins 50 000 personnes. Et pour 10 mSv il faudrait une cohorte 100 fois plus grande (soit 5 millions de personnes exposées)[18].
En 2001, Maurice Tubiana et l'Académie de médecine (2001) estimaient « important de remarquer que l'incidence des cancers dans la plupart des populations exposées à de faibles suppléments de doses de radiation n’a pas été trouvée augmentée et que, dans la plupart des cas, cette incidence semble avoir été réduite »[40] (cette apparente réduction étant cependant plus faible que l'écart statistiquement significatif attendu).
En 2005, sur le plan épidémiologique, le fait qu’il n’y a pas de preuve d’un effet cancérogène pour des doses inférieures à 100 mSv[55] n'est pas contesté. « Les études épidémiologiques disponibles ne décèlent aucun effet pour des doses inférieures à 100 mSv, soit qu’il n’en existe pas, soit que la puissance statistique des enquêtes ait été insuffisante pour les détecter »[25]. En effet, un problème méthodologique est que les cohortes exposées (et suivies sur un temps assez long pour détecter des effets tels que des cancers) atteignent rarement 100 000 individus. Ceci a longtemps limité les chercheurs à l'étude des doses supérieures ou égales à ≈100 mSv. Le nombre de cohortes suivies augmentant avec le temps, un moyen de dépasser ces limitations liées à la taille des cohortes est la méta-analyse (qui agrègent les données provenant de plusieurs cohortes)[68].
Puis en 2009, une étude[2] conduite par 6 chercheurs allemands s’est donné comme objectif d’évaluer les preuves de risques de cancer induits par des débits de dose faibles et modérés mais cumulées (exposition chronique). Ce travail s’est appuyé sur les principales études épidémiologiques alors disponibles sur l'incidence du cancer et les risques de mortalité dus à de telles expositions (publiées de 2002 à 2007), et sur la mise à jour de l'étude du registre national britannique pour les travailleurs exposé aux radiation. Pour chaque étude les auteurs ont comparé le risque pour les mêmes types de cancer chez les survivants de la bombe atomique (à doses égales et avec la même proportion de sexe et en tenant compte de l'âge moyen atteint et de l'âge moyen à l'exposition)[2]. Les études présentaient toutes des limitations rendant leurs résultats à eux-seuls non significatifs (puissance statistique insuffisante, âge de fin de suivi encore jeune…), mais selon les auteurs puis d’autres chercheurs[69] une conclusion peut néanmoins être tirée de leur analyse combinée : les estimations de relation dose-effet sont positives dans toutes les études (ou égale à zéro dans une étude). Et pour 7 de ces 13 études, la relation dose-effet a été estimée statistiquement significative. Enfin, l'excès de risque relatif par dose était comparable à la valeur correspondante pour les survivants de la bombe atomique. Les auteurs ont conclu que les données disponibles « ne confirment pas que le risque de cancer par exposition chronique à des débits de dose faibles et modérés est plus faible que pour les survivants de la bombe atomique », ajoutant que « ce résultat remet en question les valeurs de risque de cancer actuellement supposées pour les expositions professionnelles » ; autrement dit : les études épidémiologiques ne peuvent détecter un éventuel risque lié aux faibles doses d’irradiation, mais elles sont pareillement incapables d’exclure l’existence d'un tel risque.
Cancérogenèse
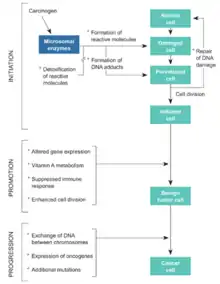
Dans le modèle monoclonal à étapes multiples de la cancérogenèse, on pensait que le cancer était l'aboutissement d'une succession de mutations spécifiques d'une cellule unique, indépendamment de son environnement : ce modèle monocellulaire relativement simple était une condition importante pour justifier une relation dose-effet de type linéaire sans seuil. Des études plus récentes remettent en cause ce schéma classique : en réalité, l'évolution tumorale d'une cellule mutée se heurte à des mécanismes efficaces de défense à l’échelle du tissu et de l’organisme, par un processus faisant intervenir des relations complexes entre la cellule mutée et les cellules environnantes.
Au niveau du tissu, les mécanismes qui interviennent dans l’embryogenèse (et pour diriger la réparation tissulaire après une agression) semblent jouer un rôle pour contrôler la prolifération d’une cellule, même quand celle-ci est devenue autonome. Ce mécanisme pourrait expliquer l’absence d’effets cancérigènes après contamination par de faibles quantités de radioéléments émetteurs α (phénomène dans lequel un petit nombre de cellules ont été fortement irradiées mais sont environnées par des cellules saines) avec l’existence, dans ce cas, d’un seuil chez l’homme comme chez l’animal[25]. L'effet biologique des irradiations ne paraît pas déterminé par le nombre de mutations élémentaires qu'elles créent, mais plutôt par la charge qu'elle font peser sur le système de réparation de l'ADN[70] :
« Vu le mécanisme en plusieurs étapes de la carcinogenèse, on ne sait pas si la linéarité dose-effet pour la lésion primaire complexe de l'ADN et les lésions cellulaires fixées, qui sont critiques, entraîne une relation dose-effet linéaire en ce qui concerne les cancers induits par l'exposition aux rayonnements»[71].
Mécanismes de réparation
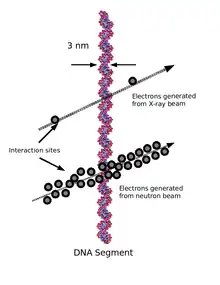
L'idée d'une loi linéaire s'appuie initialement sur l'observation des ruptures de l'ADN provoquées par les radiations ionisantes. On observe en effet que le nombre de ruptures est directement proportionnel à la dose, sans effet de seuil : il y a un effet possible dès le premier rayonnement. Cette observation de base n'est pas contestée, mais doit être complétée par l'étude du devenir de ces ruptures à travers les mécanismes que la cellule met en œuvre pour réparer l'ADN.
Dans la vie normale de la cellule, l'ADN est en permanence attaqué par des composés très réactifs, les radicaux oxygénés produits par le métabolisme cellulaire[72]. Une première ligne de défense contre ces attaques est la présence de molécules qui neutralisent les espèces réactives oxygénées, les antioxydants: les vitamines C et E, le glutathion, la catalase, la superoxyde dismutase,...
Mais les antioxydants ne font pas tout, et l'ADN a d'autres ennemis (perte de bases, déamination, dimérisation des thymines par les rayons ultra-violets...). Finalement, les cellules subissent en permanence de nombreuses ruptures de l'ADN, qu'elle doivent en permanence réparer. La réparation de l'ADN fait intervenir les enzymes les plus remarquables que l'on connaisse[73] : « les ruptures simple brin sont réparées en quelques secondes ou minutes ; la plupart des autres lésions sont réparées en quelques heures. »
L'étude de l'effet des rayonnements ionisants sur les dommages de l'ADN montre que les dommages constatés sont de même nature que ceux que subissent spontanément les cellules, mais dans des proportions différentes. L'exposition d'une cellule à des rayonnements ionisants créé moins de lésions isolées et davantage de groupes de lésions (lésions en grappe), ce qui augmente la proportion de cassures double brin et de ponts ADN/ADN et ADN/protéine[71].
| Dommage ADN | Lésions spontanées/cellule/j | Lésions radio-induites/Gy |
 Réparation de l'ADN : DNA ligase I réparant des dommages causés à un chromosome |
| Cassures simple brin | 10 000 à 55 000 | 1000 | |
| Perte de base | 12 600 | Non évaluée | |
| Dommage de base | 3 200 | 2 000 | |
| Cassure double brin | 8 | 40 | |
| pont ADN/ADN | 8 | 30 | |
| pont ADN-proteine | quelques | 150 | |
| sites multilésés | Non évalué | quelques |
L'existence d'un système de réparation n'est pas en soi une objection à l'hypothèse linéaire. Les effets stochastiques des rayonnements sont la conséquence lointaine des erreurs de réparation, et il n'y a pas de raison de supposer que ces erreurs disparaissent en dessous d'un certain seuil : à partir du moment où un taux d'erreur existe, les erreurs du système se produiront en proportion de la dose.
Cependant, l'existence de ces agressions permanentes sur l'ADN montre que la question de l'effet des rayonnements ionisants ne se limite pas à créer des cassures double brin « normales », qui dérèglent ensuite le fonctionnement de la cellule. On estime en effet que les radicaux libres, les molécules ionisées ou excitées naturellement présents dans la cellule provoquent des ruptures équivalentes à ce que provoquerait une dose de radiation de 200 mGy par jour (soit 8.3 mGy par heure)[74]. De toute évidence, ce n'est ni la dégradation de l'ADN ni sa correction par le système de réparation de l'ADN qui peuvent entraîner des conséquences biologiques significativement différentes d'un fonctionnement cellulaire normal : si c'était le cas, le taux de cancer observé naturellement serait beaucoup plus élevé qu'il ne l'est en réalité. Les rayonnements ionisants produisent donc nécessairement un signal spécifique, qui oriente le système de réparation vers un fonctionnement différent de son fonctionnement naturel.
Il semble que ce signal spécifique corresponde au fait que dans le cas des lésions provoquées par un rayonnement ionisant, plusieurs dégradations de l'ADN tendent à se concentrer sur de petits segments d'ADN, alors qu'elles se répartisent aléatoirement quand l'agression est le fait d'agents internes à la cellule[75]. De ce fait, une dose suffisante de rayonnements ionisants est nécessaire pour activer ces systèmes de réparation à partir d'un premier seuil, lesquels perdront ensuite leur efficacité quand la dégradation dépasse un certain seuil.
Effets sur la fertitlité et le sex-ratio
Selon une étude[76], l'exposition in utero à de faibles doses d'irradiation est aussi une préoccupation. On constate depuis plusieurs décennies que le nombre de naissances, mais aussi le sex-ratio à la naissance sont statistiquement significativement modifiés à proximité des installations nucléaires[76]. La modification du sex-ratio montre qu'il ne s'agit pas ou pas uniquement d'effets liés à une volonté de ces personnes de faire moins d'enfants.
Ce constat avait déjà été fait après la période des essais nucléaires atmosphériques, et après la catastrophe de Tchernobyl. Une étude récente (2019) s'est intéressée aux changements dans le nombre de naissances allant de pair avec des changements significatifs dans les sex-ratios autour des installations nucléaires (dans un rayon de 35 km où les habitants courent plus de risque d'être exposé à de faibles doses d'irradiation) ; ce travail s'est appuyé sur le dénombrement annuel des naissances par commune et par sexe, mis à jour de 2016 en France et en 2017 en Allemagne[76].
- En France en 2000 autour du Centre de stockage de l'Aube, dans un rayon de 35 km autour de cette installation, le nombre de naissance est moindre qu'attendu statistiquement, et le sex-ratio à la naissance est anormalement "favorable" aux garçons (Il y a 3,44% de garçons nés en moins, pour 8,44% de naissances de filles en moins)[76].
- En Allemagne, la différence dans le taux de natalité est encore plus marquée en périphérie (très urbanisée) de la centrale nucléaire de Philippsburg avec 5,56% de garçons en moins, et 6,92% de filles en moins[76].
Ces chiffres confirment et précisent des observations plus anciennes. Les auteurs de l'étude invitent donc à « intensifier la recherche biophysique sur les mécanismes d'exposition et les voies d'exposition aux rayonnements ionisants naturels ou artificiels, y compris le rayonnement neutronique et d'activation neutronique. La recherche biologique et épidémiologique renforcée devrait viser à clarifier les conséquences génétiques et cancérogènes associées au niveau de la population »[76].
Effets non linéaires
Les travaux récents sur la réparation de l'ADN montrent que certains systèmes intracellulaires qui gouvernent la réparation ne sont déclenchés qu'au-dessus d'un seuil d'irradiation[55]. À partir du moment où ces mécanismes de réparation sont activés par une irradiation suffisante, le métabolisme cellulaire est modifié, et la réponse de la cellule aux irradiations ultérieures change de nature. La diminution après une première irradiation à faible dose de la radiosensibilité in vivo et in vitro est bien établie (phénomène d’adaptation)[55] - [16].
Sous ce seuil, les défauts créés par les faibles doses et débits de dose ne sont pas réparés. On constate expérimentalement une hypersensibilité individuelle des cellules aux très faibles doses, l'effet macroscopique de cette hypersensibilité étant plus que compensé par la faiblesse de la dose. Cette hypersensibilité, qui ne se manifeste plus pour des débits de dose importants, montre que la nature de la réaction cellulaire dépend de la dose. Elle montre également que certains effets, qui n'apparaissent qu'à faible dose, sont donc nécessairement sous-estimés par la loi linéaire sans seuil, même s'il n'est pas possible de déterminer si ces effets sont nocifs pour l'organisme dans son ensemble.
L'effet à long terme dépend donc de la dose et du débit de dose : pour de nombreux gènes, la transcription des gènes cellulaires est modifiée par des doses beaucoup plus faibles (de l’ordre du mSv) que celles pour lesquelles on observe une mutagenèse ; et donc selon la dose et le débit de dose ce ne sont pas les mêmes gènes qui sont transcrits[77].
- Pour de très faibles doses d'irradiation (<10 mSv), les lésions ne sont pas réparées et le contrôle qualité de la cellule fonctionne en tout ou rien. Les lésions sont éliminées par la disparition des cellules, soit directement par apoptose (suicide cellulaire programmé par l'apparition d'un génome anormal), soit au moment d'une mitose ultérieure (l'anomalie génétique empêchant la division cellulaire, mais pas son fonctionnement). Pour ces faibles doses et débits de doses, les anomalies sont suffisamment rares pour que l'élimination des cellules anormales n'entraîne pas d'effet somatique sur le tissu.
- Des doses un peu plus élevées endommagent un nombre notable de cellules, et sont donc susceptibles de causer des lésions tissulaires. Pour des doses comprises entre 10 et 100 mSv, les systèmes de réparation de l’ADN sont activés. La réparation permet alors la survie cellulaire, mais peut générer des erreurs. Le nombre de réparations fautives mutagènes est petit mais son importance relative, par unité de dose, croît avec la dose et le débit de dose.
Par la suite, une mutation sera transmise lors de la division cellulaire, mais l'évolution de la cellule anormale dépendra de son environnement : le processus de cancérogenèse se heurte à des mécanismes efficaces de défense à l’échelle du tissu et de l’organisme, qui doivent eux-mêmes être mis en défaut pour qu'un cancer apparaisse.
Il faut enfin tenir compte de facteurs tels que la sensibilité génétique individuelle et du caractère interne ou externe de l'exposition[78].
Effets épigénétiques
Des invertébrés exposés à de faibles doses de rayonnements présentent des anomalies transmissibles sur plusieurs générations. Une question était de savoir s'il s'agit d’une mutation génétique (qu’on ne trouve pas toujours) ou s'il pouvait s’agir d’un effet épigénétique (processus induisant une modification de l’expression de certains gènes sans impliquer de modification de l'ADN)[79]. L'IRSN, parmi d'autres, a cherché à le savoir : Il note (en 2019) que des altérations d’ADN entraînant des variations de l’information génétique ont déjà été décrites, mais que dans le cas d’une faible irradiation, une modifications de la méthylation de l’ADN – processus épigénétique n’affectant pas la séquence – a effectivement mises en évidence in situ chez des grenouilles et des pins sylvestres vivant dans les zones contaminées par la catastrophe de Tchernobyl et par celle de Fukushima[79].
Et plus récemment en laboratoire le phénomène a été observé chez des daphnies exposées à un faible rayonnement gamma[80].
Effet « bystander » et adaptatifs
Un effet de proximité (en anglais, « bystander » désigne celui qui assiste à un accident) a été identifié dans certaines expériences, en particulier des thérapies anti-tumorales[81].
On sait depuis quelques années que la réponse d'un tissu exposé à des radiations est coordonnée, faisant intervenir des réponses adaptatives y compris de la part de cellules qui n'avaient pas été elles-mêmes irradiées. Les mécanismes impliqués sont encore mal compris, mais on ne détecte pas de relation dose-effet simple aux faibles doses. Les cellules qui déclenchent une mort programmée par apoptose ne sont pas nécessairement celles qui ont été irradiées (!) et des irradiations peuvent déclencher des instabilités du génome, persistant sur plusieurs générations cellulaires[82] - [83].
Ce domaine est à peine exploré[84], mais il est clair que si l'effet d'une faible dose d'irradiation est une réponse globale du tissu, la relation dose-effet peut présenter des seuils et des hystérésis, et aussi bien être en forme de "J" avec effet de seuil ou en forme de "n" avec une sur-réaction aux faibles doses. La seule chose certaine est que, si cet effet est généralisé et possède un impact suffisant, la logique justifiant le modèle linéaire sans seuil, qui présuppose entre autres l'addition de réponses indépendantes de chaque cellule isolée, n'a pas de justification réelle, ce qui interdirait d'extrapoler aux faibles doses d'irradiation les effets observés aux doses plus fortes.
Débat sur l'effet des faibles doses
Partisans et opposants à l'hypothèse linéaire sans seuil
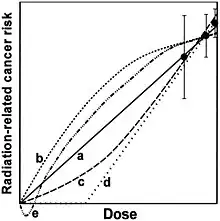
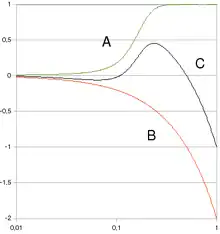
(a) Extrapolation linéaire.
(b) Supralinéaire en n (pente diminuant avec la dose).
(c) Courbe en J (pente augmentant avec la dose).
(d) Linéaire à effet de seuil.
(e) Hormèse, effet bénéfique des faibles doses.
Les premières normes en matière de radioprotection fixaient une limite de 0,2 rad/jour (soit 2 mGy/jour); et personne n'a jamais constaté de problème de santé induit dans le respect de cette limite[85]. Cette norme initiale a été remise en cause dans les années 1950, non pas sur la base de résultats scientifiques nouveaux, mais dans le but politique de provoquer l'arrêt des essais nucléaires atmosphériques, en jouant sur la peur qu'inspirent les faibles doses d'irradiation[85] - [86] - [87]
L'utilisation du modèle linéaire (plus exactement du modèle linéaire-quadratique) sans seuil[88] est soutenue depuis les années 1970 par la grande majorité des comités d'experts en épidémiologie et en radioprotection[89] : le National Research Council (NRC) de l'Académie des sciences ou le National Council on Radiation Protection and Measurements (en) (NCRP) aux États-Unis[72] - [90], le Comité scientifique des Nations Unies pour l'étude des effets des rayonnements ionisants aux Nations unies[8]. Ce modèle est également soutenu, ou au moins accepté en vertu du principe de précaution, par de grandes agences officielles de santé publique : la Health Protection Agency (en) britannique[91], l'Environmental Protection Agency américaine[92], la Commission canadienne de sûreté nucléaire[93].
Cependant, le consensus sur l'utilisation de ce modèle dans le domaine de la radioprotection ne signifie pas qu'il correspond à la vérité. La position de l'Organisation mondiale de la santé sur la modélisation des agents cancérigènes en général est plus nuancée[94] : « Le choix du modèle d'extrapolation dépend de l'état actuel de nos connaissances sur les mécanismes de la cancérogenèse, et il n'existe pas de méthode mathématique universelle qui puisse être considérée comme parfaitement adaptée à ce problème. »
Concernant les émetteurs de rayons X et γ, le Centre international de recherche sur le cancer (CIRC) de l'OMS considère que[95] : « En l'absence de données fiables sur les effets des faibles doses, on suppose fréquemment que l'extrapolation aux faibles doses devrait être linéaire et sans seuil. Cette hypothèse demeure controversée, certains opposant qu'il y a en réalité un seuil, d'autres opposant que les risques réels sont plus élevés que ceux prévus par une relation linéaire, alors que d'autres encore font valoir que de faibles expositions pourraient être bénéfiques. »
À l'opposé, le modèle linéaire sans seuil a également ses opposants, et en premier lieu l'industrie nucléaire. En effet, si la dose la plus infime peut être dangereuse, aucune mesure de protection n'est jamais suffisante, et les coûts s'envolent en proportion. Des coûts de la radioprotection à ceux de l'enfouissement des déchets en passant par la question des rejets[96], de la reconnaissance des cancers radio-induits comme maladies professionnelles[97] - [98] - [99] à l'indemnisation des habitants exposés aux retombées d'essais nucléaires (les downwinders (en))[100] - [101], les enjeux financiers sont énormes[102].
À titre d'exemple, un débat fait rage aux États-Unis depuis plusieurs décennies entre différentes agences gouvernementales sur l'objectif de décontamination à viser pour les anciens sites des essais nucléaires dans le Nevada. En effet, les coûts de décontamination s'élèvent à 35 millions de dollars si l'on veut ramener la radioactivité ambiante à 1 mSv/an, 100 millions de dollars pour descendre à 0,25 mSv/an et atteignent 1 milliard de dollars si l'on vise un objectif idéal de 50 μSv/an[103]. On s'en doute aisément, les associations professionnelles de l'industrie nucléaire sont fortement opposées au modèle linéaire sans seuil[104] - [105], et financent activement des recherches qui pourraient démontrer que les faibles doses sont inoffensives voire bénéfiques[106] - [107].
Au fur et à mesure de son usage, le modèle linéaire sans seuil a aussi soulevé des questions parmi les physiciens responsables de sa mise en pratique. En effet, appliquer le principe ALARA est un travail sans fin et peu gratifiant : quand on a atteint les limites réglementaires à 20 mSv/an, on doit optimiser pour viser 15, puis 10, puis 5, et ainsi de suite. Au fur et à mesure que le risque théorique diminue, sur la base d'un modèle théorique d'extrapolation dont personne ne peut garantir s'il est juste, certains se demandent si ces budgets et ce travail sont réellement justifiés. Cette préoccupation a été très explicitement exprimée en 1979 par l'un des principaux opposants au modèle linéaire sans seuil, le physicien nucléaire B. L. Cohen[108] :
« On estime que réduire la limite d'exposition d'un facteur dix coûterait à l'industrie nucléaire 500 millions de dollars par an, et ne réduirait même pas la dose collective ; cela ne ferait que redistribuer cette dose sur davantage de personnes. Mais même si cela permettait de supprimer toute exposition, on pourrait difficilement justifier de dépenser 500 millions de dollars pour sauver 10 vies quand on peut sauver une vie pour chaque tranche de 25 000$ investis dans un programme de dépistage médical ou pour chaque tranche de 100 000$ investis en dispositifs de sécurité sur les voitures ou les autoroutes. »
Dans le prolongement de ces considérations, quelques associations professionnelles de radiophysiciens, et en premier la Health Physics Society américaine, ont officiellement pris parti contre l'utilisation du modèle linéaire sans seuil en dessous de 50 mSv[109] - [110] - [111]. En France ce modèle est aussi contesté depuis la fin des années 1990 par deux Académies :
Rapport conjoint des académies françaises
Approuvé en 2005 à la quasi-unanimité par les Académie des sciences et Académie de médecine françaises, il affirme qu'« il n’est pas justifié d’utiliser une relation linéaire sans seuil (RLSS) pour estimer le risque cancérogène des faibles doses. » (...) « la relation linéaire sans seuil peut constituer un outil pragmatique utile pour fixer les règles de la radioprotection pour des doses supérieures à une dizaine de mSv ; mais, n’étant pas fondée sur des concepts biologiques correspondant à nos connaissances actuelles, elle ne peut pas être utilisée sans précaution pour estimer par extrapolation l’effet des faibles et surtout des très faibles doses (< 10 mSv). » Issu d'un groupe de travail emmené par les professeurs André Aurengo et Maurice Tubiana[25], ce rapport fait grand bruit dans le débat sur les faibles doses en contestant les conclusions du National Research Council et de la Commission internationale de protection radiologique. Le rapport conclut que les travaux récents en radiobiologie et en carcinogenèse suggèrent l’existence d'une relation dose-effet non linéaire, avec un seuil de dose sous lequel aucun effet n'est constaté, voire montrent un effet d'hormèse.
Ce modèle se fonde en effet sur deux hypothèses implicites, qui sont :
- la constance de la probabilité de mutation (par unité de dose) quels que soient la dose et le débit de dose ;
- l'indépendance des cellules dans le tissu, qui permet au processus de cancérogenèse, après avoir été initié dans une cellule, d'évoluer indépendamment des cellules environnantes.
Mais un organisme diffère d'un dosimètre ou d'une pellicule photographique en deux points : la relation dose-effet n'est pas nécessairement linéaire, elle peut comporter des seuils sous lesquels la nature ou l'efficacité des mécanismes de défense peut changer radicalement ; et surtout une cellule ou un organisme pluricellulaire sont des systèmes complexes régulés, capables dans une certaine mesure de se réparer et de maintenir leur fonctionnement malgré des perturbations internes ou externes.
On savait que l’efficacité de la réparation de l'ADN est meilleure à faible débit de dose, mais les Académies considèrent ici qu'en montrant l’ampleur de ces différences, on a maintenant enlevé tout fondement scientifique aux extrapolations des fortes doses vers les faibles doses[25]. Les données expérimentales montrent que l’efficacité des systèmes de réparation varie selon la dose ou du débit de dose, en raison de divers mécanismes (activation des systèmes de réparation, arrêt temporaire du cycle, augmentation de l’efficacité de la réparation quand le nombre de lésion est petit, etc.)[55].
La remise en cause de la validité des hypothèses sur lesquelles se fonde l'approche linéaire sans seuil ne signifie pas qu'il n'y a pas d’effet cancérogène pour des faibles doses, et de fait, les données ne permettent pas d’exclure un effet cancérogène. Cependant, cet effet peut être beaucoup plus faible par unité de dose que ce que prédit la théorie linéaire sans seuil. Il pourrait par exemple exister une relation dose-effet sans seuil mais non linéaire avec une baisse considérable de l’efficacité pour des doses inférieures à une dizaine de mSv, et un effet trivial pour des doses de l’ordre d’un mSv ou inférieures[55]. Certains supposent même que la superposition d'effets à seuil pourrait conduire à des effets d'hormèse, où de petites irradiations auraient en réalité des effets bénéfiques sur la santé.
Le débat officiellement ouvert par les académies françaises en 2005 continue donc[55] - [112]. En 2005, juste après ce rapport, une étude épidémiologique du Centre international de recherche sur le cancer a porté sur plus de 400 000 travailleurs du nucléaire exposés à des faibles doses de radiations, mais pas aux doses très faibles habituelles en radiodiagnostic (médiane : 19 mSiev)[113]. Des articles pour ou contre le modèle linéaire sans seuil continuent à paraître régulièrement sans qu'aucun des camps change significativement de position[64] - [114] - [115] - [116].
Hypothèse d'un effet d'hormèse
D'après le rapport des académies françaises[25], « la méta-analyse qui a été faite des résultats de l’expérimentation animale montre dans 40 % de ces études une diminution de la fréquence spontanée des cancers chez les animaux après de faibles doses, observation qui avait été négligée car on ne savait pas l’expliquer. » Ces résultats ne sont pas compatibles avec une loi linéaire sans seuil, mais suggèrent au contraire un effet d'hormèse (effet inverse d’un agent qui est toxique à fortes doses mais a un effet favorable protecteur à petites doses)[117] - [118].
Les radiations de l'ordre du mGy ont globalement un double effet sur les cellules et leur ADN. D'une part, il y a une faible probabilité pour que l'ADN soit endommagé, et cette probabilité croît avec la dose. L'autre effet découle de la réponse adaptative de la cellule contre tout dommage important de l'ADN, quelle qu'en soit la source. Si des cellules exposées à une faible dose (1 cGy) de rayons X sont ultérieurement exposées à une forte dose (1 Gy), on n'observe que la moitié des ruptures d'ADN normalement observées à cette forte dose[119]. Cette protection adaptative stimule le système de protection et de réparation de la cellule. La réponse apparaît en quelques heures, et peut durer plusieurs jours voire des mois. Elle sature puis décroît fortement au-delà de doses d'une centaine de mGy, et n'apparaît plus au-delà de 500 mGy[120].
À faible dose d'irradiation, l'avantage provenant de cette réponse adaptative pourrait l'emporter sur les dommages primaires induits sur l'ADN : une irradiation ponctuelle de l'ordre du cGy stimulerait la radiorésistance et diminuait l'effet d'autres doses.
Selon certains experts tels que G. Meyniel (1998) « ce faisceau de présomptions de plus en plus serré et étoffé montre qu'aujourd'hui, compte tenu des données épidémiologiques et des conditions expérimentales objectives, il est nécessaire d'informer la société afin de tenter de dédramatiser les dangers d'exposition aux faibles doses»[121].
Régions à radioactivité naturelle élevée
Dans ces régions, généralement désignées par les acronymes anglais HLNRA (High Levels of Natural Radiation Areas) ou HBRA (High Background radiation Areas), l'environnement est source d'une exposition annuelle supérieure à 5 mSv/an (soit deux fois l'exposition annuelle moyenne, toutes sources confondues dans le monde (2,4 mSv)[36].
Ainsi à Ramsar (Iran), les habitants des quartiers à haute radioactivité (environ 2 000 personnes) subissent des doses pouvant dépasser 100 mSv/an, avec une moyenne de 10 mSv/an et un maximum estimé à 260 mSv/an[122]. À quarante ans, un habitant de la cinquantaine de maisons où la dose atteint 100 mSv/an a reçu une dose cumulée supérieure à 4 sieverts ; selon le modèle linéaire sans seuil, ils devraient déclarer 20 % de cancers en plus (par rapport à des habitants normalement exposés). Rien de tel n'est observé[123] - [124]. Mais la cohorte concernée est beaucoup trop petite, et il n'y a pas de données fiables sur l'épidémiologie du cancer de cette population[124] - [125] - [126]. Une étude cas-témoins constate par ailleurs à Ramsar un taux de stérilité féminine trois fois plus élevé que dans le groupe témoin retenu, mais le taux d'études universitaires est aussi trois fois plus élevé, ces deux facteurs étant significativement corrélés[127].
La région de Yangjiang (Chine) est plus radioactives que la moyenne, à cause de sables contenant de la monazite (un minerai de thorium). Près de 80 000 personnes sont exposées à un débit de dose d'environ 6.4 mSv/an, soit 4 mSv/an au-dessus de la moyenne mondiale. Elle a fait l'objet d'études répétées[128]. L'étude statistique de l'excès relatif de cancer ne montre pas là d'effet statistiquement significatif. Le taux de cancer tend même à être plus faible que la moyenne. Une étude (2000) sur 125 079 sujets comparés à un groupe témoin sur 1,7 million d'hommes/année et 1003 décès par cancer, a trouvé un risque relatif de 0,99 (intervalle de confiance : 0,87 à 1,14,) soit aucune augmentation de risque, le risque calculé en appliquant la LNT se situant lui à 1,2, donc au-dessus de l'intervalle de confiance[129]. Mais l'interprétation de ces résultats doit être prudente, car l'étude est de type « écologique » sans mesure individuelle de l'exposition aux radiations et des différences faibles de style de vie en particulier sur le nombre de fumeurs ou le taux d'infection peuvent être l'explication de l'écart[130].
Les études menées dans les régions HBRA montrent souvent des anomalies microbiologiques mais sans élévation significative du risque de cancer, ce qui contredit le modèle linéaire sans seuil[131] - [132]. La prise en compte de ces résultats reste compliquée par le manque de données épidémiologiques fiables dans des régions situées dans des pays émergents ou en développement.
Étude des liquidateurs de Tchernobyl
Les quelque 600 000 liquidateurs qui étaient intervenus sur le site de la catastrophe de Tchernobyl reçurent en moyenne une dose de l'ordre de 100 millisieverts (de 10 à 500 mSv)[133].
L'incidence des cancers (hors thyroïde) ne semble pas significativement différente chez les liquidateurs et dans le reste de la population : des études signalent une légère augmentation des cancers chez les liquidateurs et d'autres études concluent à une légère diminution[134] - [135]. Les cancers de la thyroïde pourraient avoir augmenté parmi les liquidateurs, mais on n'a pas trouvé de relation dose-effet probante (il semble cependant y avoir une relation au temps de séjour dans les territoires contaminés)[136].
L'incidence des leucémies a augmenté chez les liquidateurs (l’année qui a suivi l'accident), mais les premiers résultats d'ensemble manquaient de cohérence du point de vue de la relation dose-effet[137] - [138] - [139]. L'absence de relation dose-effet pourrait être due aux imprécisions sur le suivi dosimétrique : en reconstruisant a posteriori la dosimétrie des liquidateurs plutôt qu'en utilisant les chiffres des registres officiels, les auteurs retrouvent bien une corrélation statistique entre dose absorbée et risque de leucémie[140].
Si les premières études indiquaient plutôt un « effet travailleur sain », les liquidateurs semblent sur le long terme souffrir d'autres maux, principalement de cataractes radio-induites, de problèmes cardiovasculaires et de troubles psychologiques (syndrome post-traumatique, dépression, suicide)[141] - [142]. Pour les problèmes cardiovasculaires, le doute persiste entre une éventuelle origine radio-induite et un lien avec un mode vie à risque (alcoolisme, tabagisme, surpoids)[143].
Débat sur le radon
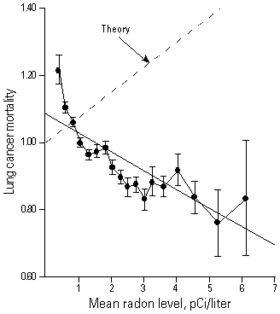
Le Pr Cohen était physicien à l'Université de Pittsburgh, spécialisé dans la gestion et l'enfouissage des déchets nucléaires. Dans les années 1980, il teste le modèle linéaire sans seuil en comparant le taux de cancer du poumon et l'exposition au radon pour 1601 comtés couvrant près de 90 % de la population des États-Unis[144]. Il montre que le risque relatif de cancer du poumon diminue quand le taux de radon augmente. Ceci contredit le modèle linéaire sans seuil testé (le modèle BEIR IV de 1988), l'écart atteignant 20 écarts types. Cette étude examine l'effet possible de 54 facteurs socioéconomiques et 7 variables géographiques ou climatiques, sans identifier de variable explicative. Des observations similaires ont pu être faites en France[145] ou dans d'autres pays durant les années 1990.
Peut-on pour autant affirmer qu'il existe un effet d'hormèse ? En théorie, à partir d'une étude écologique, non car même quand l'effet de certains facteurs explicatifs potentiels a été écarté (ici, le tabac et le niveau de vie), la nature même de l'étude ne permet pas de garantir que tous les facteurs explicatifs potentiels ont été pris en compte. Mais selon le Pr. Cohen[144], même si son existence reste logiquement possible, le portrait robot d'un facteur explicatif bénéfique agissant par accident à l'inverse de la concentration en radon serait très contraignant :
- Il doit être très corrélé avec le cancer du poumon, à un niveau comparable à celui du tabagisme, mais n'a pas encore été identifié ;
- Il doit être fortement et négativement corrélé avec le niveau ambiant de radon ;
- Il ne doit être corrélé avec aucune des 54 variables socio-économiques examinées par l'étude ;
- Il doit rester valide dans de nombreuses régions géographiques, indépendamment de l'altitude ou du climat.
Si l'on admet les résultats de cette étude, l'explication naturelle du résultat statistique est que la stimulation d'un mécanisme biologique par le radon fait plus que compenser l'induction de cancers annoncée par la théorie, et que le radon agit en pratique comme un agent protecteur, réduisant le risque de cancer dans la gamme des faibles doses et de faibles débits de dose[146]. De ce fait, ces résultats jettent le doute sur le bien-fondé des politiques de lutte contre le radon, mises en place par ailleurs, ce qui conduit à un débat. Après plus de 20 ans de débat (aux États-Unis surtout), de nombreux experts et organismes officiels considèrent que le raisonnement du Pr Cohen est incorrects, parmi lesquels le National Research Council et l'Environmental Protection Agency[147] - [148], le Centre international de recherche sur le cancer de l'OMS[149], etc. En Europe, la plupart des recommandations officielles sur le radon ignorent les travaux de Cohen.
Ces études statistiques sont dites études écologiques car elles comparent des populations supposées présenter les mêmes caractéristiques mais vivant dans des milieux différents. Elles s'opposent aux études épidémiologiques de cohortes (où une population particulière, choisie pour être représentative, est identifiée a priori et suivie dans le temps), qui sont beaucoup plus précises, mais bien plus coûteuses. Il est reconnu en épidémiologie que des études de type écologique ne peuvent pas servir de base à des relations dose-effet, parce qu'elles ne permettent pas d'accéder aux doses individuellement reçues, et que l'effet réel d'une dose moyenne n'est généralement pas le même que l'effet moyen d'une dose réelle : des phénomènes de non-linéarité et/ou de couplage entre facteurs peuvent conduire à des effets très différents de l'effet réel, pouvant aller jusqu'à l'inverser. C'est entre autres sur ces bases que la communauté des épidémiologues rejette les études écologiques, arguant que par nature ces études n'autorisent pas de conclusion fiable[150] - [151].
Cohen a toujours considéré avoir correctement pris en compte d'éventuels biais statistiques, notamment ceux liés au tabagisme, un biais régulièrement invoqué par la communauté des épidémiologues, qui montrent sur des modèles théoriques qu'il peut facilement conduire à une inversion des résultats[152] - [153] - [154] - [149] - [155] - [156] - [157].
Cependant, le Pr Cohen considère que l'argument avancé par les épidémiologues est incorrect[158] - [159] - [160] car son étude vise à mettre à l'épreuve l'hypothèse linéaire sans seuil, non à évaluer l'effet cancérigène du radon et un effet d'hormèse éventuel. L'hypothèse linéaire sans seuil revient précisément à dire que le risque de cancer est directement proportionnel à la dose reçue. On peut alors montrer mathématiquement que dans cette hypothèse particulière, la dose moyenne détermine directement le risque moyen, parce que -par hypothèse- un effet non linéaire a été exclu dans ce cas. Par conséquent, selon le Pr Cohen, si l'hypothèse linéaire sans seuil est correcte, une étude écologique doit trouver le résultat annoncé ; et comme le résultat annoncé n'est pas trouvé, c'est bien que l'hypothèse linéaire sans seuil est incorrecte. Le Pr Cohen en conclut que si l'on ne peut pas dire quel est l'effet réel (puisqu'une étude écologique ne le permet pas), on peut affirmer que l'hypothèse linéaire sans seuil est invalide pour les faibles doses d'irradiation.
En résumé, pour le Pr. Cohen[144], « l'existence d'un tel facteur explicatif hypothétique est irréaliste » ; pour ses détracteurs, le facteur explicatif est simplement une prise en compte incorrecte du tabagisme et du déplacement des populations dans l'étude de Cohen. En particulier pour le CIRC[149], des résultats comparables dans 3 études ont été invalidés une fois des données plus précises prises en compte, 8 études de cas sur des mineurs et l'exposition résidentielle au radon donnent des valeurs incompatibles avec son résultat pour des niveaux d'exposition équivalents, en sorte que[161] « le poids des éléments de preuve disponibles montrent que les analyses écologiques de Cohen peuvent être écartées ». Une nouvelle évaluation du risque radon a conclu que le risque augmente pour une exposition domestique inférieure à 200 Bq/m3 durant 25 ans, concluant que le radon est le 2e facteur de risque après le tabac[162]
Constructions contaminées de Taïwan
À Taïwan, dans les années 1980, des constructions neuves sont édifiées avec de l'acier de recyclage fortement contaminé au cobalt 60 (de demi-vie 5,2714 ans), exposant environ dix mille personnes à des doses moyennes de 400 mSv (avec pour les 10 % les plus exposés un débit de dose dépassant souvent largement 15 mSv/an). En 2004, une étude estime que d'après le modèle linéaire sans seuil on aurait dû observer pour cette population sur les 20 dernières années environ 232 cancers mortels spontanés plus un excès de 70 cancers mortels radio-induits, mais qu'on observe seulement 7 cancers en tout et pour tout, donc seulement 3 % du chiffre attendu. Les auteurs concluent que l'exposition chronique à des faibles radiations améliore les défenses naturelles (hormèse) contre le cancer[163], contrairement à ce que l'hypothèse LNT (Linear No-Threshold model; loi linéaire sans seuil) aurait conduit à attendre[164]. Cependant, pour déterminer le taux "théorique" de cancer, les auteurs de cette étude n'avaient pas analysé l'effet de la distribution des âges des résidents, à laquelle ils n'avaient pas accès, et qu'ils avaient supposé être identique à celle de la population de Taiwan.
En 2006, des travaux plus approfondis ont porté sur une cohorte de 7 271 habitants, 141 ont développé un cancer ou une leucémie, dont 95 sont prises en compte pour une étude statistique. Le nombre de cancers observés (141 en tout, 95 retenus dont 82 cancers solides) est plus élevé d'un facteur 10 comparé au chiffre de 7 cancers mortels publié par l'AEC. Les auteurs observent que tous cancers solides confondus, le risque est effectivement significativement abaissé parmi les habitants par rapport à une population normale, avec 82 cancers retenus contre 110 attendus. Cependant, ils observent que les habitants des immeubles contaminés ont un risque significativement élevé pour le cancer de la thyroïde et marginalement élevé pour les leucémies (hors Leucémie lymphoïde chronique)[165]. Les auteurs concluent que l'étude initiale n'a pris en compte que des statistiques incomplètes, n'a pas correctement ajusté ses chiffres à la constitution de la cohorte, et que le délai par rapport à l'exposition est encore trop court pour ce type d'étude[166].
En 2008, les résultats épidémiologiques sur les habitants des immeubles contaminés sont complétés par une estimation du risque radio-induit pour une exposition de 100 mSv, fondée sur l'étude de 117 cancers retenus parmi 165 cas observés. Que ce soit tous cancers confondus ou tous cancers solides confondus, on n'observe pas d'accroissement significatif du risque global de cancer. Par contre, le risque de leucémie est significativement relié à la dose, et une relation dose-réponse pourrait être présente pour le cancer du sein[167].
Les habitants ont aussi développé des effets non cancéreux[168] :
- anomalies cytogénétiques et du système immunitaire[169] ;
- le cristallin d'enfants ayant grandi dans ces immeubles continue à s'opacifier progressivement (évolution vers une cataracte radio-induite), plus d'une décennie après leur relogement[170] ;
- le développement physique des garçons ayant subi une exposition supérieure à 60 mSv a été ralenti, avec une relation dose-effet significative[171].
Enjeux sur la politique sanitaire
Doses collectives
L'utilisation la plus polémique de la loi linéaire sans seuil consiste à calculer le nombre de cancers provoqués par une très faible dose de radiation à laquelle est exposée une très grande population. En théorie, la relation linéaire sans seuil permet de calculer une dose collective, exprimée en personnes·sieverts, où une faible dose est multipliée par la population qui la subit. Dans l'hypothèse linéaire, en effet, on obtiendra le même résultat en exposant vingt millions de personnes à un microsievert, ou vingt mille personnes à un millisievert, ou vingt personne à un sievert : dans tous les cas, la dose collective de vingt personnes·sievert conduira à un cancer supplémentaire (à raison de 5 % de cancer par sievert)[172]. Typiquement, si la population française (de 60 millions d'habitants) est exposée à une radioactivité moyenne de 2,5 millisievert par an (l'exposition moyenne aux radiations naturelles), et qu'une exposition aux rayonnements provoque un excès de cancers de 5 % de cancers par sievert, cette exposition provoque globalement 60 × 106 × 2,5 × 10−3 × 5 % = 7 500 cancers par an, c'est-à-dire 2,3 % des cancers observés.
En 1973, le comité de l'Académie des Sciences américaines spécialisé dans l'étude des effets biologiques des radiations (BEIR) avait estimé que la radioactivité naturelle pouvait induire 6 000 morts par cancers par an aux États-Unis (soit environ le double, si on prend en compte les cancers non mortels à cette époque), mais ce type d'évaluation peut être réévalué si l'on tient compte de modèles plus récents[72].
Le rapport conjoint de l'académie des sciences et de l'académie de médecine d'avril 2005[25] a été publié en réaction à une étude (2004) de l’estimation de la part de cancers attribuables au radiodiagnostic[173] construite sur l'hypothèse de linéarité sans seuil de la relation entre le risque de cancer et la dose de radiations ionisantes. Cette étude concluait que 0,6 % à 3 % des cancers seraient attribuables au radiodiagnostic, mais si la relation linéaire sans seuil n’est pas fondée, ces estimations ne seraient que des constructions de l’esprit[55].
Le dilemme est manifeste si l'on prend par exemple le cas de la présence domestique du radon. D'après les études disponibles, et sur la base du modèle linéaire sans seuil, il est considéré comme la deuxième cause de cancer du poumon après le tabagisme, responsable de 5 à 12 % de ces cancers, et causant entre 1000 et 3000 morts par an en France[174] - [175] - [176] - [177] - [178], entre autres parce que les faibles doses d'irradiation correspondantes concernent une très grande population. Dans cette logique, il est logique de vouloir diminuer autant que possible le radon des immeubles et habitations[179] - [180] - [181] - [182]. Si l'effet inverse suggéré par les travaux du Pr. Cohen n'était pas seulement un artefact statistique, une telle politique serait en réalité néfaste à la population.
Évaluation bénéfice / risque en radiologie médicale

Environ 50 millions d’examens radiologiques sont effectués en France chaque année qui délivrent en moyenne 1 millisievert par an à chaque Français. Selon la fonction utilisée, on peut déduire, soit qu’ils pourraient induire quelques milliers de cancers, soit qu’ils ne présentent aucun danger significatif[25].
L’évaluation du rapport entre bénéfice et risque est imposée en radiologie par la directive européenne 97-43. Les risques éventuels dans la gamme de dose des examens radiologiques (0,1 à 5 mSv ; jusqu’à 20 mSv pour certains examens) doivent être estimés en tenant compte des données radiobiologiques et de l’expérimentation animale. Cependant, selon les opposants au modèle linéaire sans seuil, les mécanismes biologiques sont différents pour des doses inférieures à quelques dizaines de mSv et pour des doses supérieures. L’usage d’une relation empirique qui n’est validée que pour des doses supérieures à 200 mSv pourrait donc, en surévaluant les risques, faire renoncer à des examens susceptibles d’apporter au malade des informations utiles[25] - [55]. Elle pourrait aussi en radioprotection conduire à des conclusions erronées.
Le risque dépend de l'âge du patient puisqu'il est à distance : un scanner multicoupe à 80 ans n'a pratiquement aucun risque (le patient a toute chance de mourir d'autre chose dans les quarante ans à venir). Ce n'est pas le cas chez un adolescent.
Coûts de décontamination
Les décideurs confrontés au problème des déchets radioactifs ou au risque de contamination doivent réexaminer la méthodologie utilisée pour évaluer les risques des très faibles doses et des doses délivrées avec un très faible débit[25]. Si les effets des faibles doses d'irradiation sur la santé n'étaient pas seulement faibles (donc difficiles à identifier) mais nuls ou pratiquement nuls en dessous d’un niveau qui resterait à définir (hypothèse de seuil), de nombreux pans des politiques publiques dans ce domaine n’auraient pas de justification scientifique et seraient à revoir entièrement[55].
Faibles doses, électronique et nanotechnologies
L'effet des faibles doses à échelle nanométrique intéresse aussi le domaine de la microélectronique (dont pour les détecteurs électroniques qui ne doivent pas donner de mesures biaisées par la radioactivité elle-même).
La miniaturisation des composants les rend en effet plus sensibles à des modifications intervenant à l'échelle atomique et susceptibles de produire des erreurs dans le fonctionnement de certaines puces électroniques, systèmes de mémoires ou logiciels les utilisant.
Une expérience a été conduite avec du matériel Intel dans un milieu très pauvre en radiation au fond d'une cavité creusée dans une profonde couche de sel pour l'entreposage de déchets radioactifs[183] (à près de 500 mètres de profondeur sous le désert de Chihuahua aux États-Unis), de manière à être le moins exposé au rayonnement ambiant (alpha notamment), solaire et cosmique (neutrons surtout). Il s'agissait aussi de vérifier si les faibles radiations émises par les matériaux tels que ceux de la carte-mère ou le silicium des puces étaient responsables de ces petites erreurs, et en quelle proportion. Le fonctionnement d'une SRAM 45nm a ainsi été testé durant un an, faisant conclure à Intel que plus de 90 % des particules ionisantes causant ces petites erreurs dans le fonctionnement des puces viennent de l'environnement et non du silicium, ce qui repose la question du blindage électromagnétique des matériels sensibles[184].
Recherche
En Juin 2022, une étude (parrainée par le DOE) conclue par un rapport[185] des Académies nationales des sciences, d'ingénierie et de médecine concluent que « la recherche sur les effets sur la santé des rayonnements à faible dose aux États-Unis est limitée et fragmentée, manquant de leadership, de coordination centrale et d'un programme stratégique global[1] ».
Alors que cette recherche était gérée dans le passé par le Bureau des sciences du Département américain de l'énergie, l'attention du bureau a été réorientée[1]. Selon ce rapport : 100 millions de dollars par an seraient nécessaires dans les 15 ans, pour financer un Programme et une infrastructure de recherche coordonné d'étude sur les « impacts de l'exposition à de faibles doses de rayonnement sur la santé humaine ». Ce programme pourrait « tirer parti des récentes percées scientifiques - telles qu'une plus grande puissance de calcul, la recherche génétique et les systèmes de partage de données - que les recherches précédentes n'ont pas fait », pour améliorer les approches épidémiologiques et biologiques, réévaluer les risques de cancer, de maladies cardiovasculaires, de troubles neurologiques et d'autres maladies et la recherche d'éventuels liens de causalité entre faibles doses et certains problèmes de santé, en tenant compte des effets des doses de rayonnement, des débits de dose, des types de rayonnement et de la durée d'exposition[1]. « Les 5 millions de dollars alloués au programme de rayonnement à faible dose du DOE en 2021 et 2022 ne sont même pas suffisants pour lancer un programme de recherche fédéral coordonné », précise ce rapport[1].
Notes et références
- « U.S. Needs New $100 Million Research Program to Study Health Effects of Exposure to Low Doses of Radiation, Says New Report », sur www.nationalacademies.org (consulté le )
- Jacob P, Rühm W, Walsh L, Blettner M, Hammer G & Zeeb H (2009) Is cancer risk of radiation workers larger than expected?. Occupational and environmental medicine, 66(12), 789-796.
- 1 Sv = 1 Gy pondéré en fonction des rayonnements en cause et en fonction des tissus exposés
- Rapport UNSCEAR 2000, Comité scientifique des Nations Unies pour l'étude des effets des rayonnements ionisants, Rapport à l'Assemblée générale, avec annexes scientifiques, 2000 A/55/46, ISSN 0255-1381 (2000)
- (en) Richard Wakeford and E Janet Tawn, The meaning of low dose and low dose-rate (Editorial), Journal of Radiological Protection 30(1):1-3 (2010)
- (en) What is a low dose of radiation?, Frequently Asked Questions about Health Effects of Low Doses of Radiation, DOE Low Dose Radiation Research Program
- (en) G. J. Köteles, The Low Dose Dilemma, CEJOEM 4(2):103-113 (1998)
- (en) UNSCEAR 2000 REPORT Vol. II, Sources and effects of inoizing radiation, Annexe G: Biological Effects at Low Radiation Doses, Comité scientifique des Nations Unies pour l'étude des effets des rayonnements ionisants
- [PDF] Recommendations 2007 de la Commission Internationale de Protection Radiologique, Publication CIPR 103, 2009.
- (en) Radiation Risk in Perspective, Position Statement of the Health Physics Society, juillet 2010
- Mieux comprendre les faibles doses, Institut de radioprotection et de sûreté nucléaire
- Les faibles doses, Unité Protection sanitaire contre les rayonnements ionisants et toxiques nucléaires (Prositon), Commissariat à l'énergie atomique
- LNT = Linear No-Threshold (Loi linéaire sans seuil)
- http://sfp.in2p3.fr/Debat/debat_energie/Nucleaire/Radioactivite/tabac.html#_Toc423492386
- Article R1333-86, Code de la santé publique, Version en vigueur au 9 novembre 2007, consulté sur Légifrance
- O. RIGAUD, La radioadaptation : aspects cellulaires et moléculaires d’une réponse aux faibles doses de radiations ionisantes, Radioprotection 1998 Vol. 33, no 4, pages 389 à 404.
- Ethique et imagerie médicale. A. Bonnin, Claude Broussouloux, Jean-Paul Convard ; Elsevier Masson, 1998 (ISBN 2225830967 et 9782225830969) (sur Google)
- Brenner DJ., Doll R., Goodhead DT. et al : Cancer risk attributable to low doses of ionizing radiation : Assessing what we really know. Proc. Natl. Acad. Sci USA, 2003, 100, 13761-13766.
- [PDF] Avis de l'Académie Nationale de Médecine sur l'exposition aux faibles doses (22 juin 1999), rapport par Maurice Tubiana et André Aurengo.
- Document du CEA
- Rapport parlementaire sur les incidences environnementales et sanitaires des essais nucléaires effectués par la France, assemblée nationale, 2001.
- (en) Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, Health Risks from Exposure to Low Levels of Ionizing Radiation : BEIR VII Phase 2 : BEIR_VII.pdf, The national academies press, (ISBN 0-309-53040-7, DOI 10.17226/11340, lire en ligne [PDF]), p. 4
- Voir Risques et effets des rayonnements ionisants, rapport principal de la commission Ampère.
- Arrêté du 15 mai 2006 relatif aux conditions de délimitation et de signalisation des zones surveillées et contrôlées et des zones spécialement réglementées ou interdites compte tenu de l’exposition aux rayonnements ionisants, ainsi qu’aux règles d’hygiène, de sécurité et d’entretien qui y sont imposées, Thierry LAHAYE, Ministère de l’emploi, de la cohésion sociale et du logement, Direction générale du travail, présentation aux Cinquièmes rencontres des personnes compétentes en radioprotection, Rungis, le 15 & 16 mars 2007
- La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants, rapport commun de l'Académie des sciences et de l'Académie nationale de Médecine - Mars 2005. Éditions Nucléon, diffusion par EDP sciences.
- Tanooka H. Threshold dose-response in radiation carcinogenesis: an approach from chronic beta-irradiation experiments and a review of non-tumor doses. Int J Radiat Biol 2001;77:541-551. Cité par .
- Yoichi Oghiso, Satoshi Tanaka, Ignacia B. Tanaka III, Fumiaki Sato (2008) Experimental studies on the biological effects of low-dose-rate and low-dose radiation, International Journal of Low Radiation, Vol.5, no 1 (résumé)
- Takai D, Abe A & Komura J.I (2019) Chronic exposure to gamma irradiation at low-dose rates accelerates blood pressure decline associated with aging in female B6C3F1 mice. International journal of radiation biology, 95(3), 347-353 (résumé).
- Effets des radiations, Roland Masse
- Effect of continuous low intensity radiation on successive generations of the albino rat, Sidney O. Brown, Genetics 50: 1101-1113 November 1964.
- Chromosome aberration frequencies and chromosome instability in mice after long-term exposure to low-dose-rate γ-irradiation, Kimio Tanakaa, Atsushi Kohdaa, Takuo Toyokawab, Kazuaki Ichinohea, Yoichi Oghisoa, Mutation Research 657 (2008) 19–25.
- DOE-STD-1153-2002, a graded approach for evaluating radiation doses to aquatic and terrestrial biota.
- Voir également ICPR 108 - International Commission on Radiological Protection (2008): Environmental Protection: The Concept and Use of Reference Animals and Plants; ICRP Publication 108; Annals of the ICRP, 38 No. 4-6.
- Integrated Molecular Analysis Indicates Undetectable DNA Damage in Mice after Continuous Irradiation at ~400-fold Natural Background Radiation. Environ Health Perspect. 2012 Apr 26
- Situation radiologique dans l'environnement des anciens sites miniers du Lodevois (Hérault), Bruno Chareyron, CRIIRAD, septembre 2004
- D Laurier, JM Martin, et Ph Hubert, Etudes épidémiologiques dans des zones à haut niveau de radioactivité naturelle, IPDN, octobre 2000
- D'après
- D'après .
- High levels of natural radiation Report of an international conference in Ramsar
- [PDF] Irradiation médicale, déchets, désinformation : un avis de l’Académie de médecine. Guy de Thé et Maurice Tubiana. Communiqué du 4 décembre 2001
- Sohrabi M (1990) Recent radiological studies of high level natural radiation areas of Ramsar, ICHLNR 39, pp. 39–47.
- Influence of A Continuous Very Low Dose of Gamma-Rays on Cell Proliferation, Apoptosis and Oxidative Stress, Laetitia Lacoste-Collin, Suzanne Jozan, Veronica Pereda, Monique Courtade-Saïdi, Dose-Response, 13:1, 2015.
- New concerns for neurocognitive function during deep space exposures to chronic, low dose rate, neutron radiation, eNeuro 5 August 2019, ENEURO.0094-19.2019; DOI: https://doi.org/10.1523/ENEURO.0094-19.2019.
- Microarray Analysis of Differentially Expressed Genes in the Kidneysand Testes of Mice after Long-term Irradiationwith Low-dose-rate γ-rays Keiko TAKI et al, J. Radiat. Res., 50, 241–252 (2009).
- 10 CFR 20.1201, Occupational dose limits for adults, United Stated Nuclear Regulatory Commission, version en vigueur depuis le 21 mai 1991
- William D. Travers, Processes for revision of 10 CFR part 20 regarding adoption of ICRP recommendations on occupational dose limites and dosimetric models and parameters, lettre aux membres de la Commission de réglementation nucléaire, 2 aoüt 2001
- Code du travail, articles R4451-12 à R4451-17, version en vigueur depuis le 5 juillet 2010
- Ordonnance 814.501 sur la radioprotection du 22 juin 1994, Conseil fédéral suisse, version en vigueur au 1er janvier 2012
- Règlement sur la radioprotection (DORS/2000-203), Ministère de la justice canadien, version en vigueur depuis le 18 septembre 2007
- Radon Trickery, World Nuclear University.
- Jean-Michel Bader, Le secret du polonium 210 dans la fumée de cigarette, Le Figaro.fr, 28 août 2008.
- D'après le service de protection radiologique des armées (SPRA), 2000.
- Report DRPH/2010-010, IRSN 2011.
- Directive 96/29/Euratom du Conseil du 13 mai 1996, fixant les normes de base relatives à la protection sanitaire de la population et des travailleurs contre les dangers résultant des rayonnements ionisants.
- [PDF] Controverse : les faibles doses de radiations ionisantes sont-elles carcinogéniques ? in Bulletin Épidémiologique Hebdomadaire no 15-16/2006 (18 avril 2006) : Exposition aux radiations ionisantes d’origine médicale (les auteurs précisent que « Les sources les plus importantes » de leur enquête sont CnamTS et SAE-Drees et concernent des activités de soins externes des établissements qui font en France l’objet d’un remboursement par les Caisses d’assurance maladie, tout en contribuant à l’activité de l’établissement.
- Estimation du Comité scientifique des Nations Unies pour l'étude des effets des rayonnements ionisants (UNSCEAR, 2000)
- Analyse de l’impact de l’accident de Fukushima en France (métropole et DROM-COM) à partir des résultats de la surveillance renforcée de la radioactivité de l’environnement, IRSN, Rapport DEI/2011-01, janvier 2012
- D'après .
- L'exposition radiologique des personnes du public aux stériles miniers, fiche IRSN, février 2009.
- Examen critique du programme de recherche de l'ANDRA pour déterminer l'aptitude du site de Bure au confinement géologique des déchets à haute activité et à vie longue, IEER Technical Reports (décembre 2004)
- Guidelines for drinking-water quality, third edition, World Health Organization 2006.
- Résultats de la surveillance de l’environnement, Résultats 2nd semestre 2008.
- Fiche Andra Quels effets sur la santé?
- Little et al., Risks associated with low doses and low dose rates of ionizing radiations: Why Linearity May Be (Almost) the Best We Can Do, Radiology 251:6-12, 2009
- NTIS - 'Radium in Humans, A Review of U.S. Studies, R.E. Rowland, Argonne National Laboratory, 1994, NTIS document number DE95006146
- Pierce DA, Shimizu Y, Preston DL, Vaeth M, Mabuchi K (1996) Studies of the mortality of atomic bomb survivors. Report 12, Part I. Cancer: 1950-1990. Radiat Res 146: 1-27
- Recherche sur les effets des faibles doses, IRSN, 2013
- Daniels R.D, A meta-analysis of leukaemia risk from protracted exposure to low-dose gamma radiation, Occupational and Environmental Medicine 68:457-464.
- exemple dans Les avancées de la connaissance épidémiologique sur les faibles doses ; Dominique Laurier ; Société française de radioprotection (SFRP) ; Congrès national de radioprotection, Reims, 16-18 Juin 2015
- Molecular biology, epidemiology, and the demise of the linear no-threshold (LNT) hypothesis (Biologie moléculaire, épidémiologie et la fin de la relation linéaire sans seuil), Myron Pollycove & Ludwig E. Feinendegen, Comptes Rendus de l’Académie des Sciences - Series III - Sciences de la Vie ; Volume 322, Issues 2-3, February-March 1999, Pages 197-204 Accès par Elsevier
- W. Burkart et al., Damage pattern as a function of radiation quality and other factors (Caractéristiques des lésions provoquées dans les structures cellulaires, en fonction de la qualité du rayonnement et des autres facteurs), Comptes Rendus de l’Académie des Sciences - Series III - Sciences de la Vie Volume 322, Issues 2-3, February-March 1999, Pages 89-101 Paris, pp. 89–101
- (en) Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, National Research Council, Health Risks from Exposure to Low Levels of Ionizing Radiation : BEIR VII – Phase 2, Washington, DC, National Academy Press, (ISBN 0-309-53040-7, présentation en ligne, lire en ligne)
- Biophysique (p. 62 & suivantes), Pierre Galle, Raymond Paulin, Elsevier Masson, 2000 (ISBN 2-225-85636-2).
- Radiation and Health, Thormod Henriksen & Biophysics group at UiO, 2013.
- Cellulär och molekylär respons på låga doser av joniserande strålning
- Scherb H, Kusmierz R & Voigt K (2019) Secondary sex ratio and trends in the associated gender-specific births near nuclear facilities in France and Germany: Update of birth counts. Reproductive Toxicology, 89, 159-167.
- D'après La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants. Maurice Tubiana et André Aurengo, Rapport à l'Académie nationale de médecine, octobre 2004.
- Azzam E.I (2019) What does radiation biology tell us about potential health effects at low dose and low dose rates. Journal of Radiological Protection (résumé).
- voir l'article Transmission génétique ou épigénétique ? de la page 5, de la [www.irsn.fr/FR/IRSN/Publications/Magazine-Reperes/archives/Documents/IRSN_magazine-reperes42-201906.pdf revue repère de l'IRSN, no 42], juin 2019
- Thèse de Marie Trijau faite au Laboratoire d’écotoxicologie des radionucléides (Leco) : Trijau, M. (2018). Approche moléculaire et mécaniste de la réponse transgénérationnelle lors d'une irradiation gamma chronique chez le cladocère Daphnia magna (Doctoral dissertation, Aix-Marseille)
- D'après Effet bystander, Institut de Physiologie et Biologie Cellulaires- UMR 6187 U. Poitiers & C.N.R.S.
- Mothersill, Seymour, Radiation-induced bystander effects: Relevance for radiation protection of human and non-human biota, Radioprotection 2005 Vol. 40, no 3, pages 297 à 306.
- The radiation-induced bystander effect, Oleg V. Belyakov
- 2000: Chenal C; Legue F; Nourgalieva K; Brouazin-Jousseaume V; Durel S; Guitton N, Exposition of humans to low doses and low dose rate irradiation : an urgent need for new markers and new models in Radiatsionnaia biologiia, radioecologiia / Rossiiskaia akademiia nauk 2000;40(5):627-9.
- Commentary on Fukushima and Beneficial Effects of Low Radiation, Jerry M. Cuttler, Dose-Response (Prepress)
- Muller’s Nobel lecture on dose–response for ionizing radiation: ideology or science?, Edward J. Calabrese, Archives of Toxicology, DOI 10.1007/s00204-011-0728-8
- How a ‘Big Lie’ Launched The LNT Myth and The Great Fear of Radiation, Interview Dr Edward Calabrese, 21st Century Science & Technology, Fall 2011.
- « laradioactivite.com/fr/site/pa… »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?).
- Radiation in Medicine: A Need for Regulatory Reform, Appendix K, Committee for Review and Evaluation of the Medical Use Program of the Nuclear Regulatory Commission, Institute of Medicine, National Academy Press (1996)
- Evaluation of the Linear-Nonthreshold Dose-Response Model for Ionizing Radiation, National Council on Radiation Protection and Measurements, Report No 136 (2001)
- S F Mobbs et al., Risks from ionising radiation: an HPA viewpoint paper for Safegrounds, JOURNAL OF RADIOLOGICAL PROTECTION 31:289–307 (2011)
- « EPA accepts the recommendations in the BEIR VII and ICRP Reports to the effect that there is strong scientific support for LNT and that there is no plausible alternative at this point. However, research on low dose effects continues and the issue of low dose extrapolation remains unsettled. » Source : EPA Radiogenic Cancer Risk Models and Projections for the U.S. Population, U.S. Environmental Protection Agency, rapport EPA 402-R-11-001, avril 2011
- Faible niveau de rayonnement : Comment le modèle linéaire sans seuil assure la sécurité des Canadiens, Commission canadienne de sûreté nucléaire, 16 décembre 2009
- « The choice of the extrapolation model depends on the current understanding of the mechanisms of carcinogenesis, and no single mathematical procedure can be regarded as fully appropriate for low-dose extrapolation. » Source: Air Quality Guidelines for Europe, Second Edition, WHO Regional Publications, European Series, No. 91, World Health Organization, Regional Office for Europe, Copenhagen (2000)
- « In the absence of reliable data on the effects of low doses, it is often assumed that extrapolation to low doses should be linear and without a threshold. This assumption remains controversial, some people contending that a threshold does exist, others contending that the risks are higher than those estimated from a linear relationship and still others contending that low exposures may be beneficial. » Source: IARC MONOGRAPHS ON THE EVALUATION OF CARCINOGENIC RISKS TO HUMANS VOLUME 75, Ionizing Radiation, Part 1: X- and Gamma (γ)-Radiation, and Neutrons, Centre international de recherche sur le cancer, Organisation mondiale de la santé (2000)
- A. Rannou et P. Gourmelon, Eléments de réflexion sur le risque sanitaire posé par le tritium, Livre blanc sur le tritium, Autorité de sûreté nucléaire (2009)
- Guidelines for Determining the Probability of Causation and Methods for Radiation Dose Reconstruction Under the Employees Occupational Illness Compensation Program Act of 2000, 42 CFR Parts 81 and 82, Final Rules, Department of Health and Human Services, loi du 2 mai 2002
- Mark J. Parascandola, Spheres of influence - compensating for cold-war cancers, Environmental Health Perspectives 110(7):A404-A407 (2002)
- Steve Wing and David Richardson, Use of A-bomb survivor studies as a basis for nuclear worker compensation (Letter), Environmental Health Perspectives 110(12):A739 (2002)
- Marshall Islands Nuclear Claims Tribunal, Republic of the Marshall Islands
- Janet Burton Seegmiller, Nuclear Testing and the Downwinders, Utah History to Go
- Kenneth L. Mossman, The LNT Debate in Radiation Protection: Science vs. Policy, Dose-Response (Prepress), 2011
- RADIATION STANDARDS: Scientific Basis Inconclusive, and EPA and NRC Disagreement Continues, GAO/RCED-00-152, United States General Accounting Office, juin 2000
- Les faibles doses de rayonnement - Introduction, Société française d'énergie nucléaire
- Technical Brief for ANS Position Statement on the Health Effects of Low-Level Radiation, American Nuclear Society, avril 1999
- Carl J. Johnson, Funding of Radiation Protection Standards Research, Letters to the editor, American Journal of Public Health 69(2):181 (1979)
- Rudi H. Nussbaum, Manipulating Public Health Research: The Nuclear and Radiation Health Establishments (commentary), International Journal of Occupational and Environmental Health 13(3):328–330 (2007)
- « It is estimated that reducing the maximum allowable exposure by a factor of ten would cost the nuclear industry about $500 million per year and would not reduce total population exposures in man-rem, that is, it would merely distribute it among more people. But even if it would eliminate all exposures, it would be difficult to justify spending $500 million to save 10 lives when our society can save a life for every $25,000 spent on medical screening programs and for every $100,000 spent on highway or automobile safety devices. » Source: BL Cohen, On cancer and low level radiation : what is the misunderstanding all about? (commentary), Bulletin of the atomic scientists 35(2):53-56, février 1979
- Risk Assessment - Position Statement of the Health Physics Society, Health Physics Society, adoptée en juillet 1993, version révisée d'avril 1995
- Rudi H. Nussbaum, The linear no-threshold dose-effect relation: Is it relevant to radiation protection regulation?, Medical Physics 25(3):291-299 (1998)
- Donald Higson, The Australasian Radiation Protection Society's Position Statement on Risks from Low Levels of Ionizing Radiation, Dose-Response 5:299–307 (2007)
- Colin G. Orton et William R. Hendee, Controversies in Medical Physics: a Compendium of Point/Counterpoint Debates, American Association of Physicists in Medicine, College Park, février 2008
- Cardis E, Vrijheid M, Blettner M et al. Risk of cancer after low doses of ionising radiation: retrospective cohort study in 15 countries. BMJ 2005; 331:77.
- Jerome S. Puskin, Perspective on the Use of LNT for Radiation Protection and Risk Assessment By The U.S. Environmental Protection Agency, Dose-Response 7(4):284–291, 2009
- Maurice Tubiana et al., The Linear No-Threshold Relationship Is Inconsistent with Radiation Biologic and Experimental Data, Radiology 251:13-22, 2009
- Vaiserman, A., Koliada, A., & Socol, Y. (2019) Hormesis Through Low-Dose Radiation. In The Science of Hormesis in Health and Longevity (pp. 129-138). Academic Press (résumé).
- Edward J. Calabrese and Linda A. Baldwin, Hormesis as a biological hypothesis, Environmental Health Perspectives 106(Suppl. 1):357–362, 1998
- L E Feinendegen, Evidence for beneficial low level radiation effects and radiation hormesis, The British Journal of Radiology, 78:3–7, 2005
- The adaptive response in radiobiology: evolving insights and implications, S Wolff, Environ Health Perspect. 1998 February; 106(Suppl 1): 277–283.
- Evidence for beneficial low level radiation effects and radiation hormesis, L E Feinendegen, British Journal of Radiology (2005) 78, 3-7.
- Phénomène adaptatif : hormesis, G. Meyniel, Doyen honoraire de la Faculté de Médecine - Clermont-Ferrand, Revue de l'ACOMEN, 1998, vol.4, no 4
- High Levels of Natural Radiation in Ramsar, Iran Mortazavi1 & Karam
- High natural background radiation areas in Ramsar, Iran: can inhabitants feel safe? International Journal of Low Radiation 2006 - Vol. 3, No.2/3 pp. 171 - 177
- Cancer incidence in areas with elevated levels of natural radiation, S.M.J. Mortazavi, M. Ghiassi-Nejad, P.A. Karam, T. Ikushima, A. Niroomand-Rad, J.R. Cameron, International Journal of Low Radiation 2006 - Vol. 2, No.1/2 pp. 20 - 27.
- (en) M. Ghiassi-nejad, S. M. J. Mortazavi, J. R. Cameron, A. Niroomand-rad et P. A. Karam, « Very high background radiation areas of Ramsar, Iran: preliminary biological studies », Health Physics, vol. 82, no 1, , p. 87-93 (résumé, lire en ligne)
- (en) Alireza Mosavi-Jarrahi, Mohammadali Mohagheghi, Suminori Akiba, Bahareh Yazdizadeh, Nilofar Motamedi et Ali Shabestani Monfared, « Mortality and morbidity from cancer in the population exposed to high level of natural radiation area in Ramsar, Iran », International Congress Series, vol. 1276, , p. 106–109 (résumé)
- (en) Y. Tabarraie, S. Refahi, M.H. Dehghan et M. Mashoufi, « Impact of High Natural Background Radiation on Woman's Primary Infertility », Research Journal of Biological Sciences, vol. 3, no 5, , p. 534-536 (résumé, lire en ligne)
- Voir le numéro spécial de Journal of Radiation Research Vol. 41 (2000), SUPPL High Background Radiation Area in China
- Cancer mortality in the high background radiation areas of Yangjiang, China during the period between 1979 and 1995., Tao Z, Zha Y, Akiba S, Sun Q, Zou J, Li J, Liu Y, Kato H, Sugahara T, Wei L. J Radiat Res, 41: SUPPL., 31– 41 (2000)
- Health Physics Society, Answer to Question #1254 Submitted to "Ask the Experts"
- Jolyon H Hendry et al., Human exposure to high natural background radiation: what can it teach us about radiation risks?, Journal of Radiological Protection Volume 29(2A):A29–A42, 2009
- John D. Boice Jr. at al., Low-dose-rate epidemiology of high background radiation areas, Radiation Research 173(6):849–854, 2010
- Chernobyl’s Legacy: Health, Environmental and Socio-Economic Impacts. The Chernobyl Forum: 2003–2005 - Second revised version. IAEA Division of Public Information
- Ivanov V, Ilyin L, Gorski A, Tukov A, Naumenko R. (2004) Radiation and epidemiological analysis for solid cancer incidence among nuclear workers who participated in recovery operations following the accident at the Chernobyl NPP. J. Radiat. Res. (Tokyo) |45, 41-44
- UNSCEAR 2008 Report to the General Assembly with Scientific Annexes, VOLUME II, Annex D: Health effects due to radiation from the Chernobyl accident, UNSCEAR 2008
- Hatch M et al., The Chernobyl Disaster: Cancer following the Accident at the Chernobyl Nuclear Power Plant, Epidemiologic Reviews 27(1):56-66, 2005
- La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants. Maurice Tubiana et André Aurengo, Rapport à l'Académie nationale de médecine, octobre 2004. p. 26.
- Richard Wakeford, The silver anniversary of the Chernobyl accident. Where are we now? (editorial), Journal of Radiological Protection, 31(1):1–7, 2011
- Victor K Ivanov, Lessons from Chernobyl and prognosis for Fukushima: radiological consequences, Journal of Radiological Protection 32(1):N55–N58, 2012
- A.Ye. Romanenko et al., The Ukrainian-American study of leukemia and related disorders among Chornobyl cleanup workers from Ukraine: III. Radiation risks, Radiation Research 170(6):711-720, 2008
- Cardis E et Hatch M (2011), The Chernobyl Accident—An Epidemiological Perspective, Clinical Oncology 23(4):251-260
- Bertho J.M (2011), Tchernobyl, 25 ans après : Un bilan des effets sanitaires dans les territoires contaminés, IRSN, DRPH/SRBE, Laboratoire de radiotoxicologie expérimentale, Présentation au Huitième congrès national de radioprotection « SFRP 2011 », Tours, 21, 22 & 23 juin 2011
- Groupe d'experts de la Commission Européenne (2011) Recent scientific findings and publications on the health effects of Chernobyl, Radiation Protection No 170, Summary report, Working Party on Research Implications on Health and Safety Standards of the Article 31
- Cohen B.L Test of the linear no-threshold theory of radiation carcinogenesis in the low dose, low dose rate region. Health Phys 68:157-174 (1995).
- « Le radon », sur Futura (consulté le ).
- D'après Nonlinearity of Radiation Health Effects, Myron Pollycove, U.S. Nuclear Regulatory Commission, Washington, DC (February 1998).
- EPA Assessment of Risks from Radon in Homes, United States Environmental Protection Agency, EPA 402-R-03-003, juin 2003
- Health effects of exposure to radon: BEIR VI, National Research Council, National Academy Press, Washington, 1998
- (en) Ionizing Radiation, Part 2 : Some Internally Deposited Radionuclides, vol. 78, World Health Organization, International Agency for Research on Cancer, coll. « IARC Monographs on the Evaluation of Carcinogenic Risks to Humans », (lire en ligne)
- Voir par exemple l'argument présenté par J H Lubin, The potential for bias in Cohen's ecological analysis of lung cancer and residential radon Jay H Lubin 2002 J. Radiol. Prot. 22 141-148, et Reply to Cohen's letter on 'The potential for bias in Cohen's ecological analysis of lung cancer and residential radon' 2002 J. Radiol. Prot. 22 307-309
- Fundamental Flaws of Hormesis for Public Health Decisions, Kristina A. Thayer, Ronald Melnick, Kathy Burns, Devra Davis, and James Huff, Environmental Health Perspectives Volume 113, Number 10, October 2005
- Stidley et Samet, Assessment of Ecologic Regression in the Study of Lung Cancer and Indoor Radon, American Journal of Epidemiology 139(3):312-322, 1994
- Lubin et Boice Jr, Lung Cancer Risk From Residential Radon: Meta-analysis of Eight Epidemiologic Studies, Journal of the National Cancer Institute 89(1):49-57, 1997
- Lagarde et Pershagen, Parallel Analyses of Individual and Ecologic Data on Residential Radon, Cofactors, and Lung Cancer in Sweden, American Journal of Epidemiology 149(3):268-274, 1999
- Mustafa Al-Zoughool et Daniel Krewski, Health effects of radon: A review of the literature, International Journal of Radiation Biology 85(1):57-69, 2009
- Duncan C. Thomas, Statistical methods in environmental epidemiology, Oxford University Press, 2009
- Michelle C. Turner, Radon and Lung Cancer in the American Cancer Society Cohort, Cancer Epidemiology Biomarkers & Prevention 20:438-448, 2011
- Test of the Linear-No Threshold Theory: Rationale for Procedures
- Cohen B (1990) Ecological versus case-control studies for testing a linear-no threshold dose-response relationship. |International Journal of Epidemiology, 19: 680– 684. (résumé / accès payant pour l'article entier
- Cohen B.L (2001) Radon exposure and the risk of lung cancer, Letter to the Editor, J. Radiol. Prot. 21 64-65.
- « The weight of evidence is that the ecological analyses of Cohen can be rejected », source (en) Ionizing Radiation, Part 2 : Some Internally Deposited Radionuclides, vol. 78, World Health Organization, International Agency for Research on Cancer, coll. « IARC Monographs on the Evaluation of Carcinogenic Risks to Humans », (lire en ligne)
- Clement C.H, Tirmarche M, Harrison J.D, Laurier D, Paquet F, Blanchardon E & Marsh J.W (2010) Lung cancer risk from radon and progeny and statement on radon. Annals of the ICRP, 40(1), 1-64.
- Is Chronic Radiation an Effective Prophylaxis Against Cancer?, Chen WL, Luan YC, Shieh MC, et al., Journal of American Physicians and Surgeons Volume 9 Number 1 Spring 2004.
- Effects of Cobalt-60 Exposure on Health of Taiwan Residents Suggest New Approach Needed in Radiation Protection, Dose Response. 2007; 5(1): 63–75.
- (en) Hwang SL, Guo HR, Hsieh WA, Hwang JS, Lee SD, Tang JL, Chen CC, Chang TC, Wang JD, Chang WP, « Cancer risks in a population with prolonged low dose-rate γ-radiation exposure in radiocontaminated buildings, 1983 – 2002 », International Journal of Radiation Biology, vol. 82, no 12, , p. 849-858 (résumé)
- « Their analysis did not consider risk factors like attained age, sex, age at initial exposure et al. […] The average follow-up period since initial exposure was still too short to observe the development of the whole spectrum of cancers in this cohort. » Source: ibidem
- (en) Su-Lun Hwang, Jing-Shiang Hwang, Yi-Ta Yang, Wanhua A. Hsieh, Tien-Chun Chang, How-Ran Guo, Mong-Hsun Tsai, Jih-Luh Tang, I-Feng Lina, Wushou Peter Chang, « Estimates of Relative Risks for Cancers in a Population after Prolonged Low-Dose-Rate Radiation Exposure: A Follow-up Assessment from 1983 to 2005 », Radiation Research, vol. 170, , p. 143-148 (résumé)
- Synthèse des articles scientifiques, CEA, 2004
- Cytogenetic effect of chronic low-dose, low-dose-rate γ-radiation in residents of irradiated buildings, The Lancet, Volume 350, Issue 9074, Pages 330 - 333, 2 August 1997
- (en) Wanhua Annie Hsieh, I-Feng Lin, Wushou P. Chang, Wei-Li Chen, Yea H. Hsu, Muh-Shy Chen, « Lens Opacities in Young Individuals Long after Exposure to Protracted Low-Dose-Rate γ Radiation in 60Co-Contaminated Buildings in Taiwan », Radiation Research, vol. 173, no 2, , p. 197-204 (résumé)
- Physical heights of children with prolonged low dose-rate γ-radiation exposure in radiocontaminated buildings, International journal of radiation biology ISSN 0955-3002/
- Faibles doses de radioactivité : une révolution dans la radioprotection, Emmanuel Grenier, Fusion no 77, 1999.
- Berrington dG & Darby S (2004) Risk of cancer from diagnostic X-rays: estimates for the UK and 14 other countries. Lancet ;363:345-51.
- Le Radon, Ministère chargé de la santé,
- Impact sanitaire du radon domestique : de la connaissance à l’action. Institut de veille sanitaire, Bulletin Epidémiologique Hebdomadaire 15 mai 2007 / no 18-19.
- Radon et cancer, Organisation mondiale de la santé, Aide-mémoire no 291, mise à jour en octobre 2009
- Fiche repère : radon et cancer, État des connaissances au 10 octobre 2011, Institut national du cancer
- Sources et effets du radon, Unité Protection sanitaire contre les rayonnements ionisants et toxiques nucléaires (Prositon), Commissariat à l'énergie atomique
- Le radon, Autorité de sûreté nucléaire, mis à jour le 15 décembre 2011
- Que faut-il savoir du radon ?, Institut de radioprotection et de sûreté nucléaire
- Le radon, Agence française de sécurité sanitaire de l'environnement et du travail, 2008
- Avis sur les projets de décret et d’arrêtés relatifs à la protection des personnes contre le risque lié au radon dans les bâtiments, Haut Conseil de la santé publique, 17 mars 2010
- Waste Isolation Pilot Plant (WIPP)
- Tom Foremski, Intel Is Investigating Server Errors Caused By Background Radiation ; Silicon valley watcher ; 2011-08-15
- [https://www.nap.edu/resource/26434/Low-Dose_Radiation_Highlights.pdf Faits marquants du rapport des Académies nationales des sciences, de l'ingénierie et de la médecine
Annexes
Bibliographie
- (en) Ansari A, Kleinhans K & Boice J.D (2019) Potential health effects of low dose radiation and what it means to the practice of radiation protection. Journal of Radiological Protection, 39(4), E9.
- (fr) Les avancées de la connaissance épidémiologique sur le faibles doses ; Dominique Laurier ; Société française de radioprotection (SFRP) ; Congrès national de radioprotection, Reims, 16-18 Juin 2015
- (en) Publications du Comité scientifique des Nations Unies pour l'étude des effets des rayonnements ionisants
- (en) Committee to Assess Health Risks from Exposure to Low Levels of Ionizing Radiation, National Research Council, Health Risks from Exposure to Low Levels of Ionizing Radiation : BEIR VII – Phase 2, Washington, DC, National Academy Press, (ISBN 0-309-53040-7, présentation en ligne, lire en ligne)
- Recommendations 2007 de la Commission Internationale de Protection Radiologique, Publication CIPR 103, 2009 [PDF]
- La relation dose-effet et l’estimation des effets cancérogènes des faibles doses de rayonnements ionisants, rapport commun de l'Académie des sciences et de l'Académie nationale de Médecine - Mars 2005. Éditions Nucléon, diffusion par EDP sciences [PDF]
- (en) Radiation risk in perspective : Position statement of the Health Physics Society; January 1996, rev August 2004
- Le nucléaire expliqué par des physiciens, Paul Bonche et Jean-Marc Cavedon, (ISBN 2-86883-575-9), EDP 2002.
- Les recherches sur les effets des faibles doses d’irradiation, Dossier de presse, Commissariat à l'énergie atomique, février 2009 [PDF]
- Le DARI : Unité de mesure adaptée à l'évaluation de l'effet des Faibles doses d'irradiation, de Georges Charpak et al..
- Remy, E., Estades J., Déconfiner l’expertise sur les faibles doses de rayonnements ionisants, Hydroécol. Appl., Tome 15, 123-137, 2006.
- (en) Radiation and Risk: A Hard Look at the Data. Los Alamos Science Number 23 1995.
- (en) Draft report of High Level Expert Group on European Low Dose Risk Research, 8 September 2008 [PDF]
Articles connexes
Liens externes
- Mieux comprendre les faibles doses, Institut de radioprotection et de sûreté nucléaire
- Les faibles doses, Unité Protection sanitaire contre les rayonnements ionisants et toxiques nucléaires (Prositon), Commissariat à l'énergie atomique
- (en) Projet RISC-RAD (Radiosensitivity of Individuals and Susceptibility to Cancer induced by ionizing radiations.
- (en) Low Dose Radiation Research Program aux États-Unis.
- (en) High Level Expert Group on European Low Dose Risk Research, Europe
- (en) Multidisciplinary European Low Dose Initiative, Europe
- (en) BELLE - Biological Effects of Low Level Exposures (groupe de travail pro-hormésis)
- (en) Low dose ionizing radiation and cancer risk, proceedings of a seminar held in Luxembourg, 9 november 2000;
- (en) On the origins of the linear no-threshold (LNT) dogma by means of untruths, artful dodges and blind faith, Edward J. Calabrese, Environmental Research 142 (2015) 432–442.