Cycle du carbone océanique
Le cycle du carbone océanique (ou cycle du carbone marin) est l'ensemble des processus d'échange de carbone (C) entre divers bassins au sein de l'océan ainsi qu'entre l'atmosphère, les terres émergées et le fond marin. Le cycle du carbone est le résultat de nombreuses phénomènes en interaction sur plusieurs échelles de temps et d'espace faisant circuler le carbone autour de la planète, et assurant sa disponibilité à l'échelle mondiale. Le cycle océanique du carbone est un processus central du cycle mondial du carbone qui met en mouvement carbone inorganique (carbone non-associé au vivant, comme que le CO2) et organique (carbone ayant été métabolisé par le vivant). Une partie du cycle du carbone marin fait transiter dans les deux sens l'élément entre chimie minérale et biochimie. Trois processus principaux (ou pompes) du cycle du carbone marin amènent le dioxyde de carbone atmosphérique dans l'océan et le dispersent dans ce milieu :
- la pompe à solubilité,
- la pompe à carbonate,
- la pompe biologique.
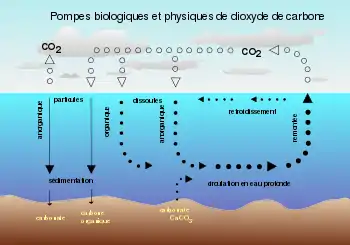

Le poids du carbone mobilisé à la surface de la Terre pour des durées inférieures à 10 000 ans est d'environ 40 000 gigatonnes de C (une gigatonne équivaut à un milliard de tonnes, soit le poids d'environ 6 millions de rorquals bleus), et d'environ 95 % (~ 38 000 Gt C) sont stockés dans l'océan, principalement sous forme de carbone inorganique dissous[1] - [2]. Le déplacement du carbone inorganique dissous dans le cycle du carbone marin est un contrôleur primaire de la chimie acido-basique des océans.
Les plantes et les algues de la Terre (producteurs primaires) sont responsables des plus grands flux annuels de carbone. Bien que la quantité de carbone stockée dans le biote marin (~ 3 Gt C) soit très faible par rapport à la végétation terrestre (~ 610 Gt C), la quantité de carbone échangée (le flux) par ces groupes est presque égale - environ 50 Gt C chacun[1]. Les organismes marins relient les cycles du carbone et de l'oxygène par des processus tels que la photosynthèse[1]. Le cycle du carbone marin est également biologiquement lié aux cycles de l'azote et du phosphore par un rapport stœchiométrique quasi constant C:N:P de 106:16:1, connu sous le nom de rapport de Redfield[3], stipulant que les organismes vivants ont tendance à absorber l'azote et le phosphore avec du carbone devenant ainsi organique. De son côté, la décomposition de la matière organique par les bactéries libère du phosphore et de l'azote.
D'après les publications de la NASA, de l'Association météorologique mondiale, du GIEC et du Conseil international pour l'exploration de la mer, ainsi que des scientifiques de la NOAA, de la Woods Hole Oceanographic Institution, de la Scripps Institution of Oceanography, du CSIRO et du Laboratoire national d'Oak Ridge, les impacts de l'humain sur le cycle du carbone marin sont importants[4] - [5] - [6] - [7]. Avant la Révolution industrielle, l'océan était une source nette de dioxyde de carbone dans l'atmosphère, alors qu'aujourd'hui la majorité du carbone qui pénètre dans l'océan provient du dioxyde de carbone atmosphérique[8]. La combustion de combustibles fossiles et la production de ciment ont modifié l'équilibre du dioxyde de carbone entre l'atmosphère et les océans[6], provoquant l'acidification des océans[9] - [8]. Le changement climatique, résultat d'un excès de CO2 dans l'atmosphère, a augmenté la température de l'océan et de l'atmosphère (réchauffement global)[6]. Le ralentissement du réchauffement climatique survenu entre 2000 et 2010[10] peut être attribué à l'augmentation observée de la taux d'énergie absorbée par les couches supérieures de l'océan[11] - [12].
Carbone marin

Les composés carbonés peuvent être distingués entre organiques ou inorganiques, et dissous ou particulaires, selon leur composition. Le carbone organique constitue l'épine dorsale des composés tels que les protéines, les lipides, les glucides et les acides nucléiques. Le carbone inorganique se trouve principalement dans des composés simples tels que le dioxyde de carbone, l'acide carbonique, le bicarbonate et le carbonate (CO2, H2CO3, HCO3−, CO32− respectivement).
Le carbone marin est ensuite distingué en phases particulaire et dissoute. Ces pools sont dissociés sur le plan opérationnel par une mesure physique — un filtre de 0,2 μm laisse passer le carbone dissous, et non le carbone particulaire —.
Carbone inorganique
Il existe deux principaux types de carbone inorganique dans les océans. Le carbone inorganique dissous, sous le sigle de CID ou (en) DIC, est composé de bicarbonate (HCO3−), de carbonate (CO32−) et de dioxyde de carbone (dont le CO2 dissous et l'acide carbonique H2CO3). Le CID peut être converti en carbone inorganique particulaire (en) (CIP ou (en) PIC) par précipitation de CaCO3, de façon biologique ou abiotique. Le CID peut également être converti en carbone organique particulaire (COP ou (en) POC) par la photosynthèse et la chimioautotrophie (c'est-à-dire la production primaire). Le DIC augmente avec la profondeur à mesure que les particules de carbone organique coulent et sont respirées. L'oxygène libre diminue à mesure que le DIC augmente car l'oxygène est consommé pendant la respiration aérobie.
Le carbone inorganique particulaire (CIP) est l'autre forme de carbone inorganique trouvé dans l'océan. La majeure partie du CIP est le CaCO3 qui compose les coquilles de divers organismes marins, mais peut également se former lors d'événements d'éclosion de plaques flottantes de boue de carbonate de calcium[13]. Les poissons marins excrètent également du carbonate de calcium lors de l'osmorégulation[14].
Certaines formes de carbone inorganique dans l'océan, comme le bicarbonate et le carbonate, sont des agents majeurs à l'alcalinité, un tampon océanique naturel qui empêche les changements drastiques d'acidité (ou de pH). Le cycle du carbone marin agit également sur les taux de réaction et de dissolution de certains composés chimiques, régule la quantité de dioxyde de carbone dans l'atmosphère et la température de la Terre[15].
Carbone organique
Comme pour le carbone inorganique, il existe deux formes principales de carbone organique dans l'océan : dissous et particulaire. Le carbone organique dissous (COD) est défini sur le plan opérationnel comme toute molécule organique pouvant traverser une filtration de 0,2 µm. Le COD peut être converti en carbone organique particulaire, par hétérotrophie, qui peut réciproquement être reconverti en carbone inorganique dissous (CID) par la respiration.
Ces molécules de carbone organique capturées sur un filtre sont définies comme du carbone organique particulaire (COP ou (en) POC). Le COP est composé d'organismes (morts ou vivants), de leurs matières fécales et de déchets carbonés. Le COP peut être transformé en COD par désagrégation de molécules et par exsudation opérée par le phytoplancton, par exemple. Le COP est généralement converti en CID par hétérotrophie et respiration.
Pompes à charbon marines
Pompe à solubilité
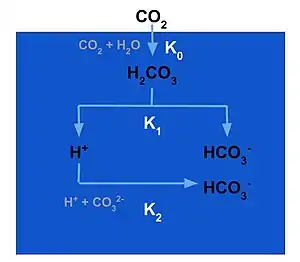
Les océans stockent le plus grand réservoir de carbone réactif (CI de la planète, qui pénètre de pa la dissolution du dioxyde de carbone atmosphérique dans l'eau de mer - la pompe à solubilité[15]. Les concentrations aqueuses de CO2, d'acide carbonique, d'ions bicarbonate et d'ions carbonate comprennent du carbone inorganique dissous (CID). Le CID circule dans tout l'océan par circulation thermohaline, ce qui facilite la formidable capacité de stockage de l'océan de celui-ci[2]. Les équations chimiques ci-dessous décrivent les réactions que subit le dioxyde de carbone après sa capture par l'océan et sa transformation en sa forme aqueuse.

-
(1)
L'acide carbonique se dissocie rapidement en ion hydrogène libre (de ce fait de l'hydronium) et en bicarbonate.
-
(2)
L'ion hydrogène libre rentre en contact avec le carbonate, déjà présent dans l'eau à partir de la dissolution de CaCO3, et réagit pour former plus d'ion bicarbonate.
-
(3)
Les éléments et les molécules dissouts dans les équations ci-dessus, principalement le bicarbonate, constituent le système d'alcalinité carbonatée, le principal contributeur à l'alcalinité de l'eau de mer[9].
Pompe à carbonate
La pompe à carbonate, parfois appelée contre-pompe à carbonate, démarre avec des organismes marins à la surface de l'océan produisant du carbone inorganique particulaire (CIP) sous forme de carbonate de calcium (calcite ou aragonite, CaCO3). Ce CaCO3 est ce qui forme les parties dures du corps comme les coquilles[15]. La formation de ces coquilles augmente le CO2 atmosphérique en raison de la production de CaCO3[9] dans la réaction suivante à stoechiométrie simplifiée[16] :
-
(4)
Les coccosphaerales (ou prymnesiophyceae), un groupe de phytoplancton presque omniprésent produisant des coquilles de carbonate de calcium, sont les principaux contributeurs à la pompe à carbonate[15]. Leur abondance dans les eaux de surface marque de façon significative la chimie des carbonates dans l'océan en dessous : ils fournissent un mécanisme important pour le transport descendant de CaCO3[18]. Le flux air-mer de CO2 induit par une communauté biologique marine peut être déterminé par le taux de pluie - la proportion de carbone du carbonate de calcium par rapport à celle du carbone organique dans les particules qui tombent au fond de l'océan (CIP/COP). La pompe à carbonate agit comme une rétroaction négative sur le dioxyde de carbone prélevé dans l'océan par la pompe à solubilité. Il se produit toutefois avec une ampleur moindre que la pompe de solubilité.
Pompe biologique
Le carbone organique particulaire, créé par la production biologique, peut venir de la couche supérieure de l'océan dans un flux communément appelé pompe biologique, ou flux respiré (équation 6) en carbone inorganique. Dans le premier cas, le CID est transformé biologiquement en matière organique par la photosynthèse (équation 5) et d'autres formes d'autotrophie[15] puis coule et se retrouve, en partie ou en totalité, digéré par les hétérotrophes[19]. Le carbone organique particulaire peut être classé, en fonction de la facilité avec laquelle les organismes peuvent le décomposer pour se nourrir, comme labile, semi-labile ou réfractaire. La photosynthèse par le phytoplancton est la principale source de molécules labiles et semi-labiles, et est la source indirecte de la plupart des molécules réfractaires[20] - [21]. Les molécules labiles sont présentes à de faibles concentrations à l'extérieur des cellules en quantité de l'ordre du picomolaire et ont des demi-vies de quelques minutes seulement lorsqu'elles sont libres dans l'océan[22]. Elles sont consommées par les microbes dans les heures ou les jours suivant leur production et résident à la surface des océans[20], où elles contribuent à la majorité du flux de carbone labile[23]. Les molécules semi-labiles, beaucoup plus difficiles à consommer, sont capables d'atteindre des profondeurs de plusieurs centaines de mètres sous la surface avant d'être métabolisées[24]. La matière organique dissoute (MOD ou (en) DOM) réfractaire est constituée en grande partie des molécules aromatiques hautement conjuguées comme les hydrocarbures aromatiques polycycliques ou la lignine[21]. Les MOD réfractaires peuvent atteindre des profondeurs supérieures à 1 000 m et circulent dans les océans pendant des milliers d'années[25] - [20] - [26]. Au cours d'une année, environ 20 gigatonnes de carbone labile et semi-labile fixé par photosynthèse sont absorbées par les hétérotrophes, alors que moins de 0,2 Gt de carbone réfractaire est consommée[20]. La matière organique dissoute marine peut stocker autant de carbone que l'offre actuelle de CO2 atmosphérique[26], mais les processus industriels modifient l'équilibre de ce cycle[27].
-
(5)
-
(6)
Contributions
Les apports au cycle du carbone marin sont nombreux, mais les principales contributions, sur une base nette, proviennent de l'atmosphère et des rivières[1]. Quant aux monts hydrothermaux, ils fournissent généralement du carbone en égale quantité à celle qu'ils consomment[15].
Atmosphère
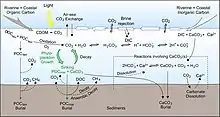
Avant la révolution industrielle, l'océan était une source de CO2 dans l'atmosphère[8] équilibrant l'impact de l'altération des roches et du carbone organique particulaire terrestre ; maintenant, il est devenu un puits pour le dioxyde de carbone atmosphérique en excès[29]. Le dioxyde de carbone de l'atmosphère passe la surface de l'océan à un taux d'échange qui varie localement[30] mais en moyenne, les océans ont une absorption nette de CO2 de 2,2 Pg C par an[30]. Étant donné que la solubilité du dioxyde de carbone augmente lorsque la température diminue, les zones froides peuvent contenir plus de dioxyde de carbone et rester en équilibre avec l'atmosphère. Inversement, l'augmentation des températures de surface de la mer diminue la capacité des océans à absorber le CO2[31] - [9]. Les océans Atlantique-nord et arctique ont la plus forte absorption de carbone par unité de surface au monde[32], et dans l'Atlantique-nord, la convection profonde transporte environ 197 Tg par an de carbone non réfractaire en profondeur[33].
Taux d'échange de dioxyde de carbone entre l'océan et l'atmosphère
Le taux d'échange océan-atmosphère en dioxyde de carbone dépend de sa concentration effective à la fois dans l'atmosphère et dans l'océan, de la température, de la salinité et de la vitesse du vent[34]. Il peut être approché par la loi de Henry et calculé par S = kP, où la solubilité (S) du gaz carbonique est proportionnelle à la quantité de gaz dans l'atmosphère, ou sa pression partielle[1].
Facteur de Revelle
Puisque l'apport océanique du dioxyde de carbone est limité, son afflux peut également être décrit par le facteur de Revelle[31] - [9]. C'est un rapport de la variation du CO2 à la variation du carbone inorganique dissous CID, qui sert d'indicateur de la dissolution du dioxyde de carbone dans la couche mixte compte tenu de la pompe de solubilité. Ce facteur est donc une expression de l'efficacité thermodynamique du pool de CID à transformer le dioxyde de carbone en bicarbonate. Plus il est faible, plus la capacité de l'eau de mer à absorber du CO2 est élevée car ce facteur mesure la résistance au dioxyde de carbone atmosphérique absorbé par la couche de surface de l'océan.
Alors que Roger Revelle trouvait un facteur d'environ 10 à son époque, dans une étude de 2004, les données ont montré un facteur de Revelle allant d'environ 9 dans les régions tropicales de basse latitude à 15 dans l'océan Austral près de l'Antarctique[35].
Rivières
Les rivières et les fleuves fournissent aussi du carbone organique aux océans par les intempéries ou l'érosion des aluminosilicates (équation 7) et des roches carbonatées (équation 8) sur terre,
-
(7)
-
(8)
ou par la décomposition du vivant (équation 5, par exemple la matière végétale et du sol)[1]. Les rivières en apportent des quantités à peu près égales à savoir à peu près 0,4 gigatonnes de carbone par an (Gt C), sous forme de CID et de COD aux océans[1]. On estime qu'environ 0,8 Gt C (CID + COD) est transporté annuellement des fleuves vers l'océan[1]. Les rivières Susquehanna, Potomac et James qui se jettent dans la baie de Chesapeake fournissent environ 0,004 Gt (6,5 × 1010 moles) de carbone inorganique dissous par an[36]. Le transport total du carbone des rivières représente environ 0,02 % du carbone total dans l'atmosphère[37]. Bien qu'il semble petit, sur de longues échelles de temps (1 000 à 10 000 ans), le carbone pénètrant dans les rivières (et donc ne pénètre pas dans l'atmosphère) sert de rétroaction stabilisatrice pour le réchauffement par effet de serre[38].
Sorties du système
Les principaux extrants du système de carbone marin sont la préservation de la matière organique particulaire (COP) et du carbonate de calcium (CIP) ainsi que l'altération inverse[1]. Bien qu'il existe des régions avec une perte locale de dioxyde de carbone dans l'atmosphère et des processus hydrothermaux, une perte nette dans le cycle ne se produit pas[15].
Conservation de la matière organique
La sédimentation est un puits à long terme pour le carbone dans l'océan, c'est ainsi la plus grande perte de carbone du système océanique[39]. Les sédiments marins profonds et les formations géologiques ont une grande importance car ils fournissent des archives complètes de la vie sur Terre et une source importante de combustible fossile[39]. Le carbone océanique peut sortir du système sous forme de déchets carbonés, notamment du phytodétritus, qui coulent et se retrouvent enfouis dans le fond marin sans être complètement décomposés ou dissous. Les sédiments de surface des fonds océaniques représentent 1,75 × 1015 kg de carbone dans le cycle global du carbone[40]. Au plus, 4 % du carbone organique particulaire de la zone euphotique de l'océan Pacifique, où se produit la production primaire depuis l'énergie lumineuse, est enfoui dans les sédiments marins[39]. Les scientifiques en déduisent que s'il y a un apport de matière organique plus volumineux dans l'océan que ce qui se dépose dans la strate d'enfouissement, une grande partie de celle-ci est utilisée ou consommée avant ce dernier stade.
Sort du carbone organique qui coule
Historiquement, les sédiments ayant les teneurs en carbone organique les plus élevées se trouvaient principalement dans les zones à forte productivité des eaux de surface ou dans le zones à faible concentration d'oxygène dans les eaux de fond[41]. Les dépôts des deltas, des plateaux continentaux et des pentes supérieures assurent 90 % de l'enfouissement du carbone organique[42], en raison du faible temps d'exposition si le fond marin est proche et de la composition de la matière organique déjà déposée dans ces environnements[43]. L'enfouissement du carbone organique est également sensible aux modèles climatiques : le taux d'accumulation de carbone organique était 50 % plus élevé pendant le maximum glaciaire par rapport aux périodes interglaciaires[44].
Dégradation
Le carbone organique particulaire est décomposé par une série de processus, tels que la méthanogenèse et la réduction des sulfates, induits par les microorganismes, avant l'enfouissement dans le fond marin[45] - [46]. La dégradation du COP entraîne la production microbienne de méthane qui est le principal hydrate de gaz sur les marges continentales[47]. La lignine et le pollen sont intrinsèquement résistants à la dégradation, et certaines études montrent que des matrices inorganiques peuvent également protéger la matière organique[48]. Le taux de conservation de la matière organique dépend d'autres facteurs interdépendants qui varient de manière non linéaire dans le temps et dans l'espace[49]. Bien que la dégradation de la matière organique se produise rapidement en présence d'oxygène, la vie microbienne utilisant une variété d'espèces chimiques (via des gradients redox) peut dégrader la matière organique dans les sédiments anoxiques[49]. La profondeur d'enfouissement à laquelle la dégradation s'arrête se fait en fonction de la vitesse de sédimentation, de l'abondance relative de matière organique dans les sédiments, du type de matière organique enfouie et d'innombrables autres variables[49]. Alors que la décomposition de la matière organique peut se produire dans les sédiments anoxiques avec des bactéries utilisant des oxydants autres que l'oxygène (nitrate, sulfate, Fe3+), la décomposition a tendance à se terminer avant la minéralisation complète[50]. Cela se produit en raison de la décomposition préférentielle des molécules labiles par rapport aux molécules réfringentes[50].
Enfouissement
L'enfouissement du carbone organique constitue un apport d'énergie pour les milieux biologiques souterrains et peut réguler l'oxygène de l'atmosphère à des échelles de temps longues (> 10 000 ans)[44]. L'ensevelissement n'opère que si le carbone organique atteint réellement le plancher océanique, faisant des plateaux continentaux et des marges côtières le principal type de paysage où se stocke le carbone organique issu de la production primaire terrestre et océanique. On a relevé également que les fjords, falaises créées par l'érosion glaciaire, constituent des zones d'enfouissement importantes de carbone, avec des taux cent fois supérieurs à la moyenne océanique[51]. Le COP enseveli dans les sédiments océaniques est le fait du lien entre un réservoir de carbone rapidement disponible dans l'océan et son stockage à des échelles de temps géologiques. Une fois que le carbone est séquestré dans le fond marin, il est considéré comme carbone bleu. Le taux d'enfouissement peut être calculé par la différence entre la vitesse à laquelle la matière organique se dépose et vitesse à laquelle elle se décompose.
Conservation du carbonate de calcium
La précipitation du carbonate de calcium est importante car elle entraîne une perte d'alcalinité ainsi qu'une libération de CO2 (équation 4), et donc un changement du taux de conservation du carbonate de calcium peut modifier la pression partielle de dioxyde de carbone dans l'atmosphère[15]. Le CaCO3 est en situation de sursaturation dans la grande majorité les eaux de surface océaniques et se retrouve en sous-saturation en profondeur[9], ce qui signifie que les coquilles sont plus susceptibles de se dissoudre lorsqu'elles s'enfoncent dans les profondeurs océaniques. Le CaCO3 peut également être transformé par dissolution métabolique (c'est-à-dire peut être utilisé comme nourriture et excrété) et ainsi les sédiments océaniques profonds contiennent très peu de carbonate de calcium[15]. La précipitation et l'ensevelissement du carbonate de calcium dans l'océan éliminent le carbone inorganique particulaire (CIP) de l'océan en le transformant en calcaire[15]. Sur des échelles de temps supérieures à 500 000 ans, le climat terrestre est modéré par le flux de carbone entrant et sortant de la lithosphère[52]. Les roches formées dans le fond marin sont remise dans le cycle par la tectonique des plaques vers la surface et altérées ou subductées dans le manteau, le carbone dégazé par les volcans[1].
Impacts humains
Les océans absorbent 15 à 40 % du CO2 anthropique[53] - [54] et jusqu'à présent, environ 40 % du carbone provenant des combustibles fossiles a été absorbé dans les océans[55]. Étant donné que le facteur de Revelle augmente avec l'augmentation du dioxyde de carbone, une plus petite fraction du flux anthropique sera absorbée par l'océan à l'avenir[56]. L'augmentation annuelle actuelle du CO2 atmosphérique est d'environ 4 gigatonnes de carbone[57]. Cela induit un changement climatique qui entraîne une concentration de carbone et des processus de rétroaction carbone-climat qui modifient la circulation océanique et les propriétés physiques et chimiques de l'eau de mer, ce qui modifie l'absorption de dioxyde de carbone[58] - [59]. La surpêche et la pollution plastique des océans contribuent à la dégradation du plus grand puits de carbone de la planète[60] - [61].
L'acidification des océans
Le pH des océans diminue en raison de l'absorption de CO2 atmosphérique[62]. L'augmentation du taux de dioxyde de carbone dissous réduit la disponibilité de l'ion carbonate, réduisant l'état de saturation du CaCO3, rendant ainsi plus difficile sur le plan thermodynamique la fabrication des coquilles en carbonate de calcium[63]. Les ions carbonate se lient préférentiellement aux ions hydrogène pour former du bicarbonate[9], ainsi une réduction de la disponibilité des ions carbonate augmente la quantité d'ions hydrogène non liés et diminue la quantité de bicarbonate formé (équations 1 à 3). Le pH étant une mesure de concentration en ions hydrogène, un pH bas signifie qu'il y a plus d'ions hydrogène non liés. Le pH est donc un indicateur de la spéciation chimique des carbonates — forme chimique du carbone en question — dans les océans et est pertinent pour évaluer la santé de l'océan[63].
La liste des organismes ayant à souffrir de l'acidification des océans comprend les coccolithophores et les foraminifères (la base de la chaîne alimentaire marine dans de nombreuses régions), les sources de nourriture humaine telles que les huîtres et les moules[64], et peut-être le plus visible, une structure construite par organismes – les récifs coralliens[63]. Pendant un certain défini, la plupart des eaux de surface resteront sursaturées en CaCO3 (sous la forme de calcite et d'aragonite) sur les trajectoires d'émissions actuelles[63], mais les organismes qui métabolisent le carbonate seront probablement remplacés dans de nombreuses régions[63]. Les récifs coralliens sont sous la pression de la surpêche, de la pollution par les nitrates et du réchauffement des eaux ; l'acidification des océans ajoutera un stress supplémentaire sur ces structures importantes[63].
Fertilisation par le fer
La fertilisation par le fer est une facette de la géoingénierie, qui manipule délibérément le système climatique de la Terre, généralement dans les aspects du cycle du carbone ou du forçage radiatif. La possibilité d'accélérer la pompe biologique pour la capture du carbone à la surface de l'océan présente un intérêt actuel pour la géoingénierie. Cette exportation accrue pourrait théoriquement éliminer l'excès de dioxyde de carbone de l'atmosphère pour le stocker dans les profondeurs océaniques. Des enquêtes en cours concernant la fécondation artificielle existent[65]. L'échelle de l'océan et les temps de réponse rapides des communautés hétérotrophes à l'augmentation de la production primaire rendent difficile de déterminer si la fertilisation en nutriments limitants entraîne une augmentation de la capture de carbone[65]. Le consensus scientifique ne se fait pas, car il y des raisons de douter qu'il s'agisse d'une approche raisonnable ou viable[66], les expérimentations in situ font l'objet d'un moratoire[67].
Barrages et réservoirs
Il y a plus de 16 millions de barrages dans le monde[68] qui modifient le transport du carbone des rivières vers les océans[69]. Selon les données de la base de données Global Reservoirs and Dams, qui répertorie environ 7 000 réservoirs contenant 77 % du volume total d'eau retenu par les barrages (8 000 km3), on estime que la l'acheminement du carbone à l'océan a diminué de 13 % depuis 1970 et devrait atteindre 19 % d'ici 2030[70]. L'excès de carbone contenu dans les réservoirs pourrait émettre environ 0,184 Gt de carbone supplémentaire dans l'atmosphère par an[71] et environ 0,2 Gt C supplémentaire serait enfoui dans les sédiments[70]. Avant l'an 2000, les bassins du Mississippi, du Niger et du Gange représentaient 25 à 31 % de l'enfouissement total du carbone des réservoirs[70]. Après l'an 2000, les bassins fluviaux du Paraná (hébergeant 70 barrages) et du Zambèze (ayant le plus grand réservoir) ont dépassé l'enfouissement par le Mississippi[70]. D'autres grands contributeurs à l'enfouissement du carbone causé par les barrages se produisent sur les fleuves Danube, Amazone, Yangtze, Mékong, Ienisseï et la rivière Rio Tocantins[70].
Mesures récentes
Une étude de 2020 dans Nature Communications, dirigée par l'Université d'Exeter, révèle un flux net de carbone significativement plus élevé dans les océans par rapport aux études précédentes. La nouvelle étude utilise des données satellitaires pour tenir compte des petites différences de température entre la surface de l'océan et la profondeur de quelques mètres où les mesures sont effectuées[72] - [73]. Cela peut être bénéfique en termes d'atténuation du changement climatique mais problématique en termes d'acidification des océans.
Voir également
Références
- (en) William H. Schlesinger et Emily S. Bernhardt, Biogeochemistry : an analysis of global change, Waltham, Mass., 3rd, (ISBN 9780123858740, OCLC 827935936)
- (en) P. Falkowski, R. J. Scholes, E. Boyle et J. Canadell, « The Global Carbon Cycle: A Test of Our Knowledge of Earth as a System », Science, vol. 290, no 5490, , p. 291–296 (ISSN 0036-8075, PMID 11030643, DOI 10.1126/science.290.5490.291, Bibcode 2000Sci...290..291F)
- (en) Alfred C. Redfield, « The Biological Control of Chemical Factors in the Environment », American Scientist, vol. 46, no 3, , p. 230A–221 (PMID 24545739, JSTOR 27827150)
- (en) Riebeek Holli, « The Carbon Cycle: Feature Articles », sur earthobservatory.nasa.gov, (consulté le )
- (en) « New report published on “Climate, Carbon and Coral Reefs », sur public.wmo.int, (consulté le )
- (en) « Fifth Assessment Report – Climate Change 2013 », sur www.ipcc.ch (consulté le )
- (en) « The Oceanic Sink for Anthropogenic CO2 », sur www.pmel.noaa.gov (consulté le )
- (en) Ocean acidification due to increasing atmospheric carbon dioxide, Londres, The Royal Society, (ISBN 0-85403-617-2, lire en ligne [PDF])
- (en) R Zeebe et D Wolf-Gladrow, CO2 in seawater: Equilibrium, Kinetics, Isotopes, Elsevier Science, , 360 p.
- (en) J Knight, « Global oceans: Do global temperature trends over the last decade falsify climate predictions? », Bulletin of the American Meteorological Society, vol. 90, , S56–S57
- (en) V Guemas, F Doblas-Reyes, I Andreu-Burillo et M Asif, « Retrospective prediction of the global warming slowdown in the past decade », Nature Climate Change, vol. 3, no 7, , p. 649–653 (DOI 10.1038/nclimate1863, Bibcode 2013NatCC...3..649G, lire en ligne)
- (en) « Global ocean heat and salt content », sur www.nodc.noaa.gov, US Department of Commerce, NOAA National Centers for Environmental Information (consulté le )
- Le terme anglais pour ces évènements est whiting event (en) qui ne semble pas avoir d'équivalent en français.
- (en) R. W. Wilson, F. J. Millero, J. R. Taylor et P. J. Walsh, « Contribution of Fish to the Marine Inorganic Carbon Cycle », Science, vol. 323, no 5912, , p. 359–362 (ISSN 0036-8075, PMID 19150840, DOI 10.1126/science.1157972, Bibcode 2009Sci...323..359W, S2CID 36321414, lire en ligne)
- (en) Steven Emerson, Chemical Oceanography and the Marine Carbon Cycle, United Kingdom, Cambridge University Press, (ISBN 978-0-521-83313-4)
- (en) « ASLO : Limnology & Oceanography: e-Books », sur aslo.org (consulté le )
- (en) S. V. Smith et G. S. Key, « Carbon dioxide and metabolism in marine environments1 », Limnology and Oceanography, vol. 20, no 3, , p. 493–495 (ISSN 1939-5590, DOI 10.4319/lo.1975.20.3.0493, Bibcode 1975LimOc..20..493S)
- (en) Björn Rost et Ulf Riebesell, Coccolithophores, Springer, Berlin, Heidelberg, , 99–125 p. (ISBN 9783642060168, DOI 10.1007/978-3-662-06278-4_5, CiteSeerx 10.1.1.455.2864)
- (en) S. Kim, R. Kramer et P. Hatcher, « Graphical method for analysis of ultrahigh-resolution broadband mass spectra of natural organic matter, the van Krevelen diagram », Analytical Chemistry, vol. 75, no 20, , p. 5336–5344 (PMID 14710810, DOI 10.1021/AC034415P)
- (en) M Moran, E Kujawinski, A Stubbins et R Fatland, « Deciphering ocean carbon in a changing world », Proceedings of the National Academy of Sciences of the United States of America, vol. 113, no 12, , p. 3143–3151 (PMID 26951682, PMCID 4812754, DOI 10.1073/pnas.1514645113, Bibcode 2016PNAS..113.3143M)
- (en) Jennifer Brophy E. et David Carlson J., « Production of biologically refractory dissolved organic carbon by natural seawater microbial populations », Deep Sea Research Part A. Oceanographic Research Papers, vol. 36, no 4, , p. 497–507 (DOI 10.1016/0198-0149(89)90002-2, Bibcode 1989DSRA...36..497B)
- (en) F Azam et F Malfatti, « Microbial structuring of marine ecosystems », Nature Reviews Microbiology, vol. 5, no 10, , p. 782–791 (PMID 17853906, DOI 10.1038/nrmicro1747, S2CID 10055219)
- (en) X Moran, H Ducklow et M Erickson, « Carbon fluxes through estuarine bacteria reflect coupling with phytoplankton », Marine Ecology Progress Series, vol. 489, , p. 75–85 (DOI 10.3354/meps10428, Bibcode 2013MEPS..489...75M)
- (en) D Hansell et C Carlson, « Net community production of dissolved organic carbon », Global Biogeochemical Cycles, vol. 12, no 3, , p. 443–453 (DOI 10.1029/98gb01928, Bibcode 1998GBioC..12..443H)
- (en) C Follett, D Repeta, D Rothman et L Xu, « Hidden cycle of dissolved organic carbon in the deep ocean », Proceedings of the National Academy of Sciences of the United States of America, vol. 111, no 47, , p. 16706–16711 (PMID 25385632, PMCID 4250131, DOI 10.1073/pnas.1407445111, Bibcode 2014PNAS..11116706F)
- (en) D Hansell, « Recalcitrant dissolved organic carbon fractions », Annual Review of Marine Science, vol. 5, no 1, , p. 421–445 (PMID 22881353, DOI 10.1146/annurev-marine-120710-100757)
- (en) Scott Doney, Mary Ruckelshaus, Emmett Duffy et James Barry, « Climate change impacts on marine ecosystems », Annual Review of Marine Science, vol. 4, no 1, , p. 11–37 (PMID 22457967, DOI 10.1146/annurev-marine-041911-111611, Bibcode 2012ARMS....4...11D, S2CID 35349779, lire en ligne)
- (en) David W. Capelle, Zou Zou A. Kuzyk, Tim Papakyriakou, Céline Guéguen, Lisa A. Miller et Robie W. MacDonald, « Effect of terrestrial organic matter on ocean acidification and CO2 flux in an Arctic shelf sea », Progress in Oceanography, vol. 185, , p. 102319 (DOI 10.1016/j.pocean.2020.102319, Bibcode 2020PrOce.18502319C).
- (en) J Raven .A. et P Falkowskli .G., « Oceanic sinks for atmospheric CO2 », Global Biogeochemical Cycles, vol. 23, no 1, , GB1005 (DOI 10.1029/2008gb003349, Bibcode 2009GBioC..23.1005G, hdl 1912/3415, S2CID 17471174, CiteSeerx 10.1.1.715.9875, lire en ligne [PDF])
- (en) T Takahashi, S Sutherland, C Sweeney et A Poisson, « Global sea–air CO2 flux based on climatological surface ocean pCO2, and seasonal biological and temperature effects », Deep Sea Research Part II: Topical Studies in Oceanography, vol. 49, nos 9–10, , p. 1601–1622 (DOI 10.1016/S0967-0645(02)00003-6, Bibcode 2002DSRII..49.1601T)
- (en) R Revelle et H Suess, « Carbon dioxide exchange between atmosphere and ocean and the question of an increase of atmospheric CO2 during the past decades », Tellus, vol. 9, no 1, , p. 18–27 (DOI 10.1111/j.2153-3490.1957.tb01849.x, Bibcode 1957Tell....9...18R)
- (en) T Takahashi, S Sutherland, R Wanninkhof et C Sweeney, « Climatological mean and decadal change in surface ocean pCO2, and net sea-air CO2 flux over the global oceans », Deep Sea Research Part II: Topical Studies in Oceanography, vol. 56, nos 8–10, , p. 554–577 (DOI 10.1016/j.dsr2.2008.12.009, Bibcode 2009DSRII..56..554T)
- (en) M Fontela, M Garcia-Ibanez, D Hansell et H Mercier, « Dissolved organic carbon in the North Atlantic meridional overturning circulation », Nature, vol. 6, , p. 26931 (PMID 27240625, PMCID 4886255, DOI 10.1038/srep26931, Bibcode 2016NatSR...626931F)
- (en) L.L. Robbins, M. E. Hansen, J.A. Kleypas et S.C. Meylan, CO2calc—A user-friendly seawater carbon calculator for Windows, Mac OS X, and iOS (iPhone), U.S. Geological Survey Open-File Report 2010-1280, , 16 p.
- (en) Christopher L. Sabine, R. A. Feely, Nicolas Gruber, Robert M. Key, Kitack Lee, John L. Bullister, Rik Wanninkhof, C. S. Wong, Douglas W. R. Wallace, Bronte Tilbrook, Frank J. Millero, Tsung-Hung Peng, Alexander Kozyr, Tsueno Ono et Aida F. Rios, « The oceanic sink for anthropogenic CO2 », Science, vol. 305, no 5682, , p. 367–371 (PMID 15256665, DOI 10.1126/science.1097403, Bibcode 2004Sci...305..367S, hdl 10261/52596, S2CID 5607281, lire en ligne [PDF])
- (en) G Waldbusser, E Powell et R Mann, « Ecosystem effects of shell aggregations and cycling in coastal waters: an example of Chesapeake Bay oyster reefs », Ecology, vol. 94, no 4, , p. 895–903 (DOI 10.1890/12-1179.1, lire en ligne)
- (en) Valier Galy, Bernhard Peucker-Ehrenbrink et Timothy Eglinton, « Global carbon export from the terrestrial biosphere controlled by erosion », Nature, vol. 521, no 7551, , p. 204–207 (PMID 25971513, DOI 10.1038/nature14400, Bibcode 2015Natur.521..204G, S2CID 205243485)
- (en) Michael Velbel Anthony, « Temperature dependence of silicate weathering in nature: How strong a negative feedback on long-term accumulation of atmospheric CO2 and global greenhouse warming? », Geology, vol. 21, no 12, , p. 1059–1062 (ISSN 0091-7613, DOI 10.1130/0091-7613(1993)021<1059:TDOSWI>2.3.CO;2, Bibcode 1993Geo....21.1059V, S2CID 747129, lire en ligne)
- (en) S Emerson et J Hedges, « Processes Controlling the Organic Carbon Content of Open Ocean Sediments », Paleoceanography, vol. 3, no 5, , p. 621–634 (DOI 10.1029/pa003i005p00621, Bibcode 1988PalOc...3..621E)
- (en) Philippe Ciais et Christopher Sabine, Climate Change 2013: the physical science basis. Contribution of Working Group I to the Fifth Assessment Report of the Intergovernmental Panel on Climate Change., Cambridge University Press, , 465–470 p. (lire en ligne)
- (en) R.H. Fleming et R. Revelle, Recent Marine Sediments, Tulsa, American Association of Petroleum Geologists, , 48–141 p., « Physical processes in the oceans »
- (en) Robert A. Berner, « Biogeochemical cycles of carbon and sulfur and their effect on atmospheric oxygen over phanerozoic time », Palaeogeography, Palaeoclimatology, Palaeoecology, vol. 75, no 1, , p. 97–122 (DOI 10.1016/0031-0182(89)90186-7, Bibcode 1989PPP....75...97B)
- (en) Susan Henrichs, « Early diagenesis of organic matter in marine sediments: progress and perplexity », Marine Chemistry, vol. 39, nos 1–3, , p. 119–149 (DOI 10.1016/0304-4203(92)90098-U)
- (en) Olivier Cartapanis, Daniele Bianchi, Samuel Jaccard et Eric Galbraith, « Global pulses of organic carbon burial in deep-sea sediments during glacial maxima », Nature Communications, vol. 7, , p. 10796 (PMID 26923945, PMCID 4773493, DOI 10.1038/ncomms10796, Bibcode 2016NatCo...710796C)
- (en) G. E. Claypool et I.R. Kaplan, Natural Gases in Marine Sediments, Plenum Press, , 99–139 p.
- (en) S D'Hondt, S Rutherford et A Spivack .J., « Metabolic activity of subsurface life in deep-sea sediments », Science, vol. 295, no 5562, , p. 2067–2070 (PMID 11896277, DOI 10.1126/science.1064878, Bibcode 2002Sci...295.2067D, S2CID 26979705)
- (en) K.A. Kvenvolden et T.D. Lorenson, Natural Gas Hydrates: Occurrence, Distribution, and Detection, vol. 124, American Geophysical Union, coll. « Geophysical Monograph Series », , 3–18 p. (ISBN 978-0-875-90982-0)
- (en) Carme Huguet, Gert J. de Lange, Örjan Gustafsson et J. Jack Middelburg, « Selective preservation of soil organic matter in oxidized marine sediments (Madeira Abyssal Plain) », Geochimica et Cosmochimica Acta, vol. 72, no 24, , p. 6061–6068 (DOI 10.1016/j.gca.2008.09.021, Bibcode 2008GeCoA..72.6061H)
- (en) John I. Hedges, Feng Hu Sheng, Allan H. Devol et Hilairy E. Hartnett, « Sedimentary organic matter preservation: A test for selective degradation under oxic conditions », American Journal of Science, vol. 299, nos 7–9, , p. 529 (ISSN 0002-9599, DOI 10.2475/ajs.299.7-9.529, Bibcode 1999AmJS..299..529H, lire en ligne)
- (en) Erik Kristensen, Saiyed I. Ahmed et Allan H. Devol, « Aerobic and anaerobic decomposition of organic matter in marine sediment: Which is fastest? », Limnology and Oceanography, vol. 40, no 8, , p. 1430–1437 (ISSN 1939-5590, DOI 10.4319/lo.1995.40.8.1430, Bibcode 1995LimOc..40.1430K)
- (en) Richard Smith, Thomas Bianchi, Mead Allison et Candida Savage, « High rates of organic carbon burial in fjord sediments globally », Nature Geoscience, vol. 8, no 6, , p. 450 (DOI 10.1038/ngeo2421, Bibcode 2015NatGe...8..450S)
- (en) J Kasting . F., O Toon . B. et J Pollack . B., « How climate evolved on the terrestrial planets », Scientific American, vol. 258, no 2, , p. 90–97 (ISSN 0036-8733, PMID 11538470, DOI 10.1038/scientificamerican0288-90, Bibcode 1988SciAm.258b..90K)
- (en) S Khatiwala, F Primeau et T Hall, « Reconstruction of the history of anthropogenic CO2 concentrations in the ocean », Nature, vol. 462, no 7271, , p. 346–349 (PMID 19924213, DOI 10.1038/nature08526, Bibcode 2009Natur.462..346K, S2CID 2301279, lire en ligne)
- (en) C Le Quere, R Andres, T Boden et T Conway, « The global carbon budget 1959–2011 », Earth System Science Data, vol. 5, no 1, , p. 165–185 (DOI 10.5194/essd-5-165-2013, Bibcode 2013ESSD....5..165L)
- (en) P Quay . D., B Tilbrook . et C Wong . S., « Oceanic Uptake of Fossil Fuel CO2: Carbon-13 Evidence », Science, vol. 256, no 5053, , p. 74–79 (ISSN 0036-8075, PMID 17802595, DOI 10.1126/science.256.5053.74, Bibcode 1992Sci...256...74Q, S2CID 9289370)
- (en) Roger Revelle et E. Hans Suess, « Carbon Dioxide Exchange Between Atmosphere and Ocean and the Question of an Increase of Atmospheric CO2 during the Past Decades », Tellus, vol. 9, no 1, , p. 18–27 (ISSN 2153-3490, DOI 10.1111/j.2153-3490.1957.tb01849.x, Bibcode 1957TellA...9...18R)
- (en) P Ciais et C Sabine, Carbon and other biogeochemical cycles in Climate Change 2013: The Physical Science Basis, Cambridge and New York, Cambridge University Press, , 465–570 p., « 6 »
- (en) G Boer et V Arora, « Feedbacks in emission-driven and concentration-driven global carbon budgets », Journal of Climate, vol. 26, no 10, , p. 3326–3341 (DOI 10.1175/JCLI-D-12-00365.1, Bibcode 2013JCli...26.3326B)
- (en) J Gregory, C Jones, P Cadule et P Friedlingstein, « Quantifying carbon cycle feedbacks », Journal of Climate, vol. 22, no 19, , p. 5232–5250 (DOI 10.1175/2009JCLI2949.1, Bibcode 2009JCli...22.5232G, S2CID 59385833, lire en ligne [PDF])
- (en) « Tackling degraded oceans could mitigate climate crisis - report », sur the Guardian, (consulté le )
- (en) « Oceans losing oxygen at unprecedented rate, experts warn », sur the Guardian, (consulté le )
- (en) Ken Caldeira et E. Michael Wickett, « Oceanography: Anthropogenic carbon and ocean pH », Nature, vol. 425, no 6956, , p. 365 (ISSN 1476-4687, PMID 14508477, DOI 10.1038/425365a, Bibcode 2003Natur.425..365C, S2CID 4417880, lire en ligne)
- (en) Jean-Pierre Gattuso et Lina Hansson, Ocean acidification, Oxford [Royaume-Uni], Oxford University Press, (ISBN 9780199591091, OCLC 823163766)
- (en) Alan Barton, « Impacts of Coastal Acidification on the Pacific Northwest Shellfish Industry and Adaptation Strategies Implemented in Response », Oceanography, vol. 25, no 2, , p. 146–159 (DOI 10.5670/oceanog.2015.38, lire en ligne [PDF])
- (en) O. Aumont et L. Bopp, « Globalizing results from ocean in situ iron fertilization studies », Global Biogeochemical Cycles, vol. 20, no 2, , GB2017 (ISSN 1944-9224, DOI 10.1029/2005gb002591, Bibcode 2006GBioC..20.2017A)
- (en) S Chisholm, P Falkowski et J Cullen, « Dis-crediting ocean fertilization », Science, vol. 294, no 5541, , p. 309–310 (PMID 11598285, DOI 10.1126/science.1065349, S2CID 130687109)
- (en) P. W. Boyd, T. Jickells, C. S. Law et S. Blain, « Mesoscale Iron Enrichment Experiments 1993-2005: Synthesis and Future Directions », Science, vol. 315, no 5812, , p. 612–617 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1131669, lire en ligne, consulté le )
- (en) B Lehner, C Liermann, C Revenga et C Vorosmarty, « High-resolution mapping of the world's reservoirs and dams for sustainable river-flow management », Frontiers in Ecology and the Environment, vol. 9, no 9, , p. 494–502 (DOI 10.1890/100125, lire en ligne)
- (en) Pierre Regnier, Pierre Friedlingstein, Philippe Ciais et T. Fred Mackenzie, « Anthropogenic perturbation of the carbon fluxes from land to ocean », Nature Geoscience, vol. 6, no 8, , p. 597–607 (DOI 10.1038/ngeo1830, Bibcode 2013NatGe...6..597R, hdl 10871/18939, S2CID 53418968, lire en ligne)
- (en) T Maavara, R Lauerwald, P Regnier et P Van Cappellen, « Global perturbation of organic carbon cycling by river damming », Nature, vol. 8, , p. 15347 (PMID 28513580, PMCID 5442313, DOI 10.1038/ncomms15347, Bibcode 2017NatCo...815347M)
- (en) N Barros, J Cole, L Tranvik et Y Prairie, « Carbon emission from hydroelectric reservoirs linked to reservoir age and latitude », Nature Geoscience, vol. 4, no 9, , p. 593–596 (DOI 10.1038/ngeo1211, Bibcode 2011NatGe...4..593B)
- (en) University of Exeter, « Ocean carbon uptake widely underestimated », sur phys.org (consulté le )
- (en) J. Andrew Watson, Ute Schuster, D. Jamie Shutler et Thomas Holding, « Revised estimates of ocean-atmosphere CO2 flux are consistent with ocean carbon inventory », Nature Communications, vol. 11, no 1, , p. 4422 (ISSN 2041-1723, PMID 32887875, PMCID 7474059, DOI 10.1038/s41467-020-18203-3, Bibcode 2020NatCo..11.4422W).
Liens externes
- (en) « earth :: a global map of wind, weather, and ocean conditions », sur earth.nullschool.net (consulté le ), Carte mondiale actuelle de la pression partielle de dioxyde de carbone à la surface de l'océan]
- https://earth.nullschool.net/#current/ocean/surface/currents/overlay=fgco2/winkel3 Carte mondiale actuelle de la densité de flux de dioxyde de carbone mer-air]




![{\displaystyle {\ce {{\underset {carbon~dioxide}{6CO2}}+{\underset {water}{6H2O}}->[light~energy]{\underset {carbohydrate}{C6H12O6}}+{\underset {oxygen}{6O2}}}}}](https://img.franco.wiki/i/cdcf64396a6289ac1a8f18afa8a4e15b47c13924.svg)


