Rapport de Redfield
Le rapport de Redfield ou stœchiométrie de Redfield est le rapport atomique constant qui existe entre le carbone, l'azote et le phosphore présent dans le phytoplancton marin et dans l'océan profond.
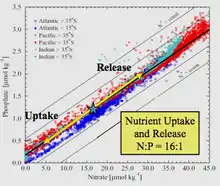
Le terme doit son nom à l'océanographe américain Alfred Redfield qui, en 1934, a décrit pour la première fois le rapport relativement constant des nutriments dans les échantillons de biomasse marine recueillis au cours de plusieurs campagnes à bord du navire de recherche Atlantis. Il a empiriquement trouvé que le rapport C:N:P était égal à 106:16:1[1]. Bien que des écarts aient été trouvés relativement au rapport canonique 106:16:1 chez certaines espèces de phytoplancton et dans certaines zones d'étude, le rapport de Redfield reste une référence importante en océanographie pour les chercheurs qui étudient la limitation des nutriments. Un article de 2014 résumant un large ensemble de données issues de mesures des nutriments dans toutes les grandes régions océaniques entre 1970 et 2010 a rapporté que le C:N:P médian mondial était de 163:22:1[2].
Découverte
Pour son article de 1934, Alfred Redfield a analysé les données sur les nitrates et les phosphates échantillonnées dans les océans Atlantique, Indien, Pacifique et la mer de Barents[1]. En tant que physiologiste formé à Harvard, Redfield a participé à plusieurs voyages à bord du navire de recherche Atlantis, analysant les données sur le contenu en C, N et P dans le plancton marin et référencé les données collectées par d'autres chercheurs remontant jusqu'à 1898.
L'analyse par Redfield de ces données empiriques l'a amené à découvrir que dans ces 4 réservoirs (les trois océans et la mer de Barents) ainsi que de l'un à l'autre, l'eau de mer avait un rapport atomique N:P proche de 20:1 (plus tard corrigé à 16:1), et était très similaire au rapport moyen N:P du phytoplancton.
Pour expliquer ce phénomène, Redfield a initialement proposé deux mécanismes non exclusifs :
I) Le N:P du plancton tend vers la composition N:P de l'eau de mer. Plus précisément, les espèces de phytoplancton ayant des besoins différents en N et en P sont en compétition au sein du même milieu et reflètent la composition nutritive de l'eau de mer[1].
II) Un équilibre entre l'eau de mer et les pools de nutriments planctoniques est maintenu grâce aux mécanismes de rétroaction biotique[1] - [3]. Redfield a proposé un scénario de type thermostat dans lequel les activités des fixateurs d'azote et des dénitrifiants maintiennent le rapport nitrate/phosphate dans l'eau de mer proche des besoins en nitrate/phosphate du protoplasme des organismes[4]. Étant donné qu'à l'époque on ne savait pas grand-chose de la composition du « protoplasme » ou de la composition globale du phytoplancton, Redfield n'a pas tenté d'expliquer pourquoi son rapport N:P devrait être d'environ 16:1.
En 1958, près d'un quart de siècle après avoir découvert ces rapports, Redfield se pencha vers ce mécanisme dans son manuscrit, Le contrôle biologique des facteurs chimiques dans l'environnement[3]. Redfield a proposé que le rapport N:P dans le plancton aurait pour résultat que l'océan global ait un rapport remarquablement similaire de nitrate dissous relativement au phosphate (16:1). Il a réfléchi à comment les cycles non seulement du N et du P, mais aussi du C et du O pourraient interagir pour aboutir à cette correspondance.
Explication
Redfield a découvert la remarquable congruence entre la chimie des océans profonds et la chimie des êtres vivants tels que le phytoplancton dans l'océan de surface. Les deux ont des rapports N:P d'environ 16:1 en termes d'atomes. Lorsque les nutriments ne sont pas limitants, le rapport élémentaire molaire C:N:P dans la plupart du phytoplancton est de 106:16:1. Redfield pensait que le fait que les vastes océans aient une chimie parfaitement adaptée aux exigences des organismes vivants n'était pas purement fortuit.
Des expériences en laboratoire dans des conditions chimiques contrôlées ont révélé que la biomasse du phytoplancton se conformerait au rapport de Redfield même lorsque les quantités de nutriments environnementaux la dépasseraient, ce qui suggère que l'adaptation écologique aux rapports de nutriments océaniques n'est pas le seul mécanisme directeur (contrairement à l'un des mécanismes initialement proposés par Redfield)[5]. Cependant, la modélisation des mécanismes de rétroaction effectuée par la suite, en particulier les flux de couplage nitrate-phosphore, penche en faveur du mécanisme proposé d'équilibre de rétroaction biotique, bien que ces résultats soient biaisés par les limites de nos connaissances actuelles sur les flux de nutriments[6].
Dans l'océan, une grande partie de la biomasse se trouve être du plancton riche en azote. Beaucoup de ce plancton est consommé par d'autres biomasses de plancton qui ont des compositions chimiques similaires. Il en résulte un rapport azote/phosphore similaire, en moyenne, pour tout le plancton dans l'océan mondial, dont le rapport moyen empirique est d'environ 16:1. Lorsque ces organismes sédimentent vers la profondeur de l'océan, leur biomasse est consommée par des bactéries qui, dans des conditions aérobies, oxydent la matière organique pour former des nutriments inorganiques dissous, principalement du dioxyde de carbone, du nitrate et du phosphate.
Le fait que le rapport nitrate/phosphate au sein de tous les grands bassins océaniques soit très similaire est probablement dû aux temps de résidence de ces éléments dans l'océan par rapport au temps de circulation des océans, soit environ 100 000 ans pour le phosphore et 2000 ans pour l'azote[7]. Le fait que les temps de séjour de ces éléments soient supérieurs aux temps de mélange des océans (~ 1000 ans)[8] pourrait expliquer que le rapport nitrate/phosphate au sein de l'océan reste assez uniforme.
Bien que de tels arguments puissent potentiellement expliquer pourquoi les rapports sont assez constants, ils ne répondent pas à la question de savoir pourquoi le ratio N:P est proche de 16 et pas d'un autre nombre.
Utilisations
La recherche qui ont abouti à l'établissement de ce rapport est devenue une caractéristique fondamentale de la compréhension des cycles biogéochimiques des océans et l'un des principes-clés de la biogéochimie. Le rapport de Redfield est déterminant pour estimer les flux de carbone et de nutriments dans les modèles de circulation mondiale. Ils aident également à déterminer quels nutriments sont limitants dans un système océanique donné, s'il existe de tels nutriments limitants. Le rapport peut également être utilisé pour comprendre la formation de proliférations de phytoplancton et l'hypoxie qui en découle en comparant des rapports entre différentes régions, comme par exemple une comparaison du rapport de Redfield du Mississippi au rapport de Redfield du nord du golfe du Mexique[9]. Le contrôle du rapport N:P pourrait être un moyen de gestion durable des réservoirs hydrographiques[10].
Écarts relatifs au rapport canonique de Redfield
Le rapport de Redfield a été initialement dérivé empiriquement des mesures de la composition élémentaire du plancton en plus de la teneur en nitrate et phosphate de l'eau de mer collectée dans quelques stations de l'océan Atlantique. Il a été par la suite confirmé par des centaines de mesures indépendantes. Cependant, l'examen de la composition d'espèces individuelles de phytoplancton cultivées sous limitation d'azote ou de phosphore montre que ce rapport azote/phosphore peut varier de 6:1 à 60:1. Tout en comprenant ce problème, Redfield n'a jamais tenté de l'expliquer à l'exception d'avoir noté que le rapport N:P des nutriments inorganiques à l'intérieur de l'océan constituait une moyenne avec une variabilité à petite échelle à laquelle s'attendre.
Bien que le rapport de Redfield soit remarquablement stable dans l'océan profond, le phytoplancton peut avoir de grandes variations dans la composition C:N:P, et leur stratégie de vie joue un rôle dans ce rapport, ce qui a fait spéculer certains chercheurs que le rapport de Redfield est peut-être une moyenne générale plutôt qu'une exigence spécifique précise nécessaire à la croissance du phytoplancton[11]. Cependant, le rapport de Redfield s'est récemment révélé être lié à un rapport homéostatique protéine/ARNr intrinsèquement présent à la fois chez les procaryotes et les eucaryotes[12]. De plus, il a été démontré que le rapport de Redfield varie selon l'échelle spatiale choisie et qu'il est en moyenne légèrement supérieur (166:20:1) à l'estimation originale de Redfield[13]. Dans certains écosystèmes, le rapport de Redfield s'est également révélé varier considérablement selon les taxons de phytoplancton dominants présents dans un écosystème, même dans des systèmes riches en nutriments. Par conséquent, le rapport de Redfield spécifique à un système pourrait servir de proxy pour reconstruire la structure de la communauté planctonique du système en question[14].
Bien que la composition élémentaire d'organismes tels que le phytoplancton marin dans une région océanique ne soit pas conforme au rapport canonique de Redfield, le concept fondamental de ce rapport reste valide et utile. En 2014, un article a été publié dans la revue Scientific Data, qui compilait des mesures des rapports de Redfield des campagnes d'observation à travers le monde de 1970 à 2010. Cet article fournit une grande base de données qui peut être utilisée pour étudier l'évolution de phosphore, de carbone et d'azote particuliers à travers les stations marines et le temps[2].
Rapport de Redfield élargi
Certains estiment qu'il existe d'autres éléments, tels que le potassium, le soufre, le zinc, le cuivre et le fer, qui sont également importants dans la chimie des océans[15].
En particulier, le fer (Fe) était considéré comme très important car les premiers océanographes biologiques ont émis l'hypothèse qu'il pouvait également être un facteur limitant de la production primaire dans l'océan[16]. En conséquence, un rapport de Redfield élargi a été développé pour l'inclure dans le cadre de cet équilibre. Ce nouveau rapport stœchiométrique indique que le rapport doit être C:N:P:Fe = 106:16:1:0,1-0,001. La grande variation de Fe provient d'un obstacle important rencontré par les navires et les équipements scientifiques qui fait que tout échantillon prélevé en mer est contaminé avec un excès de Fe[17]. C'est cette contamination qui a donné lieu à des preuves précoces suggérant que les concentrations de fer étaient élevées et donc ne constitueraient pas un facteur limitant dans la production primaire marine.
Les diatomées ont besoin, entre autres nutriments, d'acide silicique pour créer de la silice biogénique pour leurs frustules (parois cellulaires). En conséquence, le rapport nutritionnel de Redfield-Brzezinski a été proposé pour les diatomées et s'avère être C:Si:N:P = 106:15:16:1[18]. S'étendant au-delà de la production primaire elle-même, l'oxygène consommé par la respiration aérobie de la biomasse de phytoplancton s'est également révélé suivre un rapport prévisible par rapport aux autres éléments. Le rapport O2:N a été mesuré à 138:106[6].
Voir aussi
Notes
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Redfield ratio » (voir la liste des auteurs).
Références
- Redfield, « On the proportions of organic derivatives in sea water and their relation to the composition of plankton », James Johnstone Memorial Volume, , p. 176 (lire en ligne, consulté le )
- Martiny, Vrugt et Lomas, « Concentrations and ratios of particulate organic carbon, nitrogen, and phosphorus in the global ocean », Scientific Data, vol. 1, no 1, , p. 1–7 (PMID 25977799, DOI 10.1038/sdata.2014.48)
- REDFIELD, « The Biological Control of Chemical Factors in the Environment », American Scientist, vol. 46, no 3, , p. 205–221, 230A (ISSN 0003-0996, PMID 24545739, JSTOR 27827150)
- (en) Gruber et Sarmiento, « Global patterns of marine nitrogen fixation and denitrification », Global Biogeochemical Cycles, vol. 11, no 2, , p. 235–266 (ISSN 1944-9224, DOI 10.1029/97GB00077, Bibcode 1997GBioC..11..235G)
- (en) Goldman, « On phytoplankton growth rates and particulate C: N: P ratios at low light1 », Limnology and Oceanography, vol. 31, no 6, , p. 1358–1363 (ISSN 1939-5590, DOI 10.4319/lo.1986.31.6.1358, Bibcode 1986LimOc..31.1358G)
- (en) Lenton et Watson, « Redfield revisited: 1. Regulation of nitrate, phosphate, and oxygen in the ocean », Global Biogeochemical Cycles, vol. 14, no 1, , p. 225–248 (ISSN 1944-9224, DOI 10.1029/1999GB900065, Bibcode 2000GBioC..14..225L)
- http://lgmacweb.env.uea.ac.uk/green_ocean/positions/diazotroph.shtml
- « Chemical Sensor Group »,
- Dodds, « Nutrients and the "dead zone" : the link between nutrient ratios and dissolved oxygens in the Northern Gulf of Mexico », Frontiers in Ecology and the Environment, vol. 4, no 4, , p. 211–217 (DOI 10.1890/1540-9295(2006)004[0211:NATDZT]2.0.CO;2)
- (en) Levich, « The role of nitrogen-phosphorus ratio in selecting for dominance of phytoplankton by cyanobacteria or green algae and its application to reservoir management », Journal of Aquatic Ecosystem Health, vol. 5, no 1, , p. 55–61 (ISSN 1573-5141, DOI 10.1007/BF00691729)
- Arrigo, « Marine microorganisms and global nutrient cycles », Nature, vol. 437, no 7057, , p. 349–55 (PMID 16163345, DOI 10.1038/nature04159, Bibcode 2005Natur.437..349A)
- Loladze et Elser, « The origins of the Redfield nitrogen-to-phosphorus ratio are in a homoeostatic protein-to-rRNA ratio », Ecology Letters, vol. 14, no 3, , p. 244–250 (ISSN 1461-0248, PMID 21244593, DOI 10.1111/j.1461-0248.2010.01577.x)
- (en) Sterner, Andersen, Elser et Hessen, « Scale-dependent carbon:nitrogen:phosphorus seston stoichiometry in marine and freshwaters », Limnology and Oceanography, vol. 53, no 3, , p. 1169–1180 (ISSN 1939-5590, DOI 10.4319/lo.2008.53.3.1169, Bibcode 2008LimOc..53.1169S)
- (en) Arrigo, Dunbar, Lizotte et Robinson, « Taxon-specific differences in C/P and N/P drawdown for phytoplankton in the Ross Sea, Antarctica », Geophysical Research Letters, vol. 29, no 19, , p. 44–1–44-4 (ISSN 1944-8007, DOI 10.1029/2002GL015277, Bibcode 2002GeoRL..29.1938A)
- Benner, Pakulski, McCarthy et Hedges, « Bulk chemical characteristics of dissolved organic matter in the ocean », Science, vol. 255, no 5051, , p. 1561–4 (PMID 17820170, DOI 10.1126/science.255.5051.1561, Bibcode 1992Sci...255.1561B)
- Tortell, Maldonado, Granger et Price, « Marine bacteria and biogeochemical cycling of iron in the oceans », Microbiology Ecology, vol. 29, no 1, , p. 1 (DOI 10.1111/j.1574-6941.1999.tb00593.x)
- WS Broecker, T Peng et Z Beng, Tracers in the Sea, Lamont-Doherty Geological Observatory, (lire en ligne)
- (en) Brzezinski, « THE Si:C:N RATIO OF MARINE DIATOMS: INTERSPECIFIC VARIABILITY AND THE EFFECT OF SOME ENVIRONMENTAL VARIABLES1 », Journal of Phycology, vol. 21, no 3, , p. 347–357 (ISSN 1529-8817, DOI 10.1111/j.0022-3646.1985.00347.x)
Articles connexes
Liens externes
- (en) Zackary Johnson, "Biogeochemistry IV." École des sciences et technologies des océans et de la terre de l'Université d'Hawaï.http://www.soest.hawaii.edu/oceanography/zij/ocn621/OCN621-20060215-biogeochemistry.pdf
- (en) Jennifer Lentz, "Stœchiométrie des nutriments - Rapports de Redfield." École LSU de la côte et de l'environnement, 2010.http://www.sce.lsu.edu/cego/Documents/Reviews/Oceanography/Nutrient_Stoichiometry.pdf
- (en) PG Falkowski et CS Davis. "Biogéochimie marine : à propos des rapports de Redfield." ScienceWeek, Nature, 2004. http://scienceweek.com/2004/sa041119-5.htm