Résine échangeuse d'ions
Une résine échangeuse d'ions est une résine ou un polymère agissant comme milieu permettant l'échange d'ions. Il s'agit d'une structure de support, ou matrice, qui se présente le plus souvent sous la forme de microbilles insolubles de 0,25 à 0,5 mm de diamètre, de couleur blanche à jaune pâle, produites à partir de composés organiques polymérisés. Ces microbilles sont généralement poreuses, d'où une surface spécifique élevée, répartie à la fois à la surface et à l'intérieur de chaque microbille. Il existe plusieurs types de résines échangeuses d'ions, la plupart des résines commerciales étant constituées de poly(sulfonate de styrène)[1] (PSS).

Les résines échangeuses d'ions sont utilisées dans différents procédés de séparation, de purification et de décontamination. L'adoucissement de l'eau et la purification de l'eau sont les exemples les plus connus d'emplois de telles résines. Dans de nombreux cas, ces procédés font appel à ces résines comme alternatives plus flexibles que les zéolithes naturelles ou synthétiques.
Typologie des résines échangeuses d'ions
La plupart des résines échangeuses d'ions courantes reposent sur du polystyrène réticulé. Les sites d'échanges des ions se forment après polymérisation. De plus, dans le cas du polystyrène, la réticulation est réalisée par copolymérisation du styrène avec quelques pourcents de divinylbenzène. La réticulation a pour effet de réduire à la fois la capacité et la vitesse d'échange des ions mais accroît leur résistance mécanique. La taille des billes influence également les paramètres des résines : plus ces billes sont petites, plus leur surface extérieure est élevée ; des billes trop petites peuvent cependant augmenter significativement la perte de charge dans les procédés en colonne[2].
Outre les microbilles, les résines échangeuses d'ions peuvent également être produites sous forme de membranes. Ces membranes échangeuses d'ions peuvent être traversées par des ions mais pas par l'eau, ce qui est utile par exemple pour l'électrodialyse.
Il existe quatre types de résines échangeuses d'ions, distinguées par les groupes fonctionnels qu'elles portent :
- fortement acides, typiquement avec des groupes acide sulfonique −S(=O)2−, comme le poly(styrène sulfonate) de sodium et le polyAMPS ;
- fortement basique, typiquement avec des groupes ammonium quaternaire −NR3+, comme le polyAPTAC (en) ;
- faiblement acide, typiquement avec des groupes acide carboxylique −COOH ;
- faiblement basique, typiquement avec des amines primaires −NH2, secondaires −NHR ou tertiaires −NRR’, comme le polyéthylèneimine (ou polyaziridine).
Il existe également des résines échangeuses d'ions spécialisées, comme les résines chélatantes à base d'acide iminodiacétique ou de thiourée.
La plupart des résines échangeuses d'ions sont des résines anioniques ou des résines cationiques. Les premières se lient aux ions chargés négativement tandis que les secondes se lient aux ions chargés positivement.
Les résines anioniques peuvent être fortement ou faiblement basiques. Les résines anioniques fortement basiques conservent leur charge négative dans un grand intervalle de pH tandis que les résines anioniques faiblement basiques sont neutralisées à pH élevé (fortement basique) car elles y sont déprotonées. Elles présentent cependant une très bonne stabilité mécanique et chimique, ainsi qu'une vitesse d'échange ionique élevée, ce qui les rend bien adaptées aux sels organiques. La régénération des résines anioniques fait généralement intervenir une solution fortement basique, une solution d'hydroxyde de sodium par exemple. Le régénérant circule à travers la résine et évacue les anions qui lui sont liés, ce qui restaure sa capacité d'échange ionique.
Applications
Adoucissement de l'eau
L'adoucissement de l'eau utilise des résines échangeuses de cations qui remplacent les cations de magnésium Mg2+ et de calcium Ca2+ par des cations de sodium Na+. Ces derniers occupent initialement des sites actifs de la résine et sont déplacés par les cations Mg2+ et Ca2+ de la solution aqueuse, qui se fixent sur la résine en libérant les cations Na+. Il est possible de régénérer la résine en la nettoyant avec une solution riche en cations Na+, qui déplacent alors les cations Mg2+ et Ca2+ qu'elle a fixés ; ce peut être une solution de chlorure de sodium concentré[3].
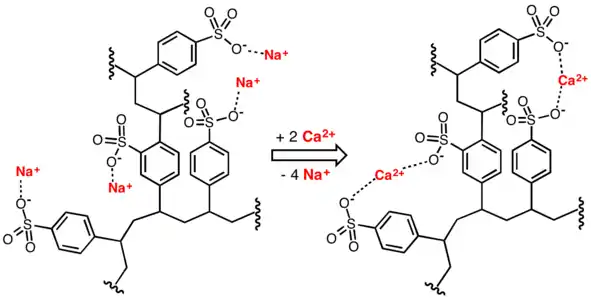 Représentation idéalisée de l'adoucissement de l'eau par remplacement de cations Ca2+ par des cations Na+ à l'aide d'une résine en poly(styrène sulfonate) de sodium réticulée.
Représentation idéalisée de l'adoucissement de l'eau par remplacement de cations Ca2+ par des cations Na+ à l'aide d'une résine en poly(styrène sulfonate) de sodium réticulée.
Purification de l'eau
La purification de l'eau consiste à élminer les cations toxiques ou dangereux tels ceux de cuivre Cu2+, de plomb Pb2+ ou de cadmium Cd2+ pour les remplacer par des cations présents naturellement dans l'eau tels ceux de sodium Na+ ou de potassium K+. Le chlore ou les contaminants organiques sont généralement éliminés à l'aide d'un filtre charbon actif mélangé à de la résine plutôt qu'avec une résine seule, cette dernière n'étant généralement pas assez efficace dans cet usage — les résines échangeuses d'ions magnétiques (MIEX) sont cependant capables d'éliminer la matière organique naturelle[4]. Les résines de purification de l'eau domestiques ne sont généralement pas régénérées : elles sont jetées après usage.
L'eau la plus pure est nécessaire à l'industrie des semi-conducteurs, à l'industrie nucléaire et à la recherche scientifique, notamment. On l'obtient à l'aide de procédés d'échange d'ions ou en combinant des traitements par membranes et par échange d'ions.
Séparation de métaux
Les procédés de séparation par échange d'ions permettent de séparer et de purifier des métaux[5], par exemple l'uranium du plutonium et d'autres actinides tels que le thorium, ou les différents lanthanides, tels que le lanthane, le néodyme, l'ytterbium, le samarium ou le lutécium, et les autres terres rares telles que le scandium et l'yttrium[6]. Lanthanides et actinides forment des familles d'éléments aux propriétés physiques et chimiques très semblables qui les rendent difficiles à séparer, les procédés à base d'échange d'ions ayant été pendant de nombreuses années les seuls en mesure d'y parvenir de manière industrielle[7] avant d'être supplantés par les procédés d'extraction liquide-liquide[8] - [9] ; le procédé PUREX a été développé précisément à partir d'une extraction liquide-liquide pour le traitement du combustible nucléaire usé afin de séparer le plutonium, l'uranium et certains actinides mineurs des produits de fission.

Les microbilles échangeuses d'ions sont également un élément essentiel de l'extraction de l'uranium par lixiviation in situ. La récupération in situ implique l'extraction par des forages d'eau uranifère dont la teneur en octaoxyde de triuranium U3O8 peut ne pas dépasser 300 ppm (0,03 %)[10]. La solution d'uranium extraite est ensuite filtrée à travers les microbilles de résine qui, grâce au processus d'échange d'ions, retiennent l'uranium de la solution[11]. Ces microbilles chargées d'uranium sont ensuite transportées vers une usine de traitement, où l'U3O8 est séparé pour produire le yellowcake, avant d'être réutilisées après régénération pour reprendre l'extraction de l'uranium. D'autres éléments peuvent être extraits des solutions uranifères, notamment des terres rares[12].
Les procédés par échanges d'ions permettent également de séparer d'autres éléments chimiques aux propriétés semblables, comme le zirconium et l'hafnium[13], qui se trouvent également être utiles pour l'industrie nucléaire. Le zirconium présente une section efficace d'absorption des neutrons, aussi bien thermiques que rapides, particulièrement faible, ce qui rend différentes formulations de zircaloy intéressantes pour le conditionnement du combustible nucléaire[14], tandis que la section efficace de l'hafnium est au contraire plutôt élevée, ce qui, associé à de bonnes propriétés en environnement radioactif, le rend intéressant pour les barres de contrôle[15].
Catalyse
Les résines échangeuses d'ions sont utilisées en synthèse organique par exemple pour catalyser des réactions d'estérification et d'hydrolyse. Leur nature insoluble et leur surface spécifique élevée les rendent intéressantes pour les réactions en phase liquide et phase gazeuse. Il peut s'agir de la neutralisation de sels d'ammonium[16] et de la conversion d'halogénures d'ammonium quaternaire en hydroxydes[17] avec des résines échangeuses d'ions basiques. Des résines acides peuvent être employées comme calalyseurs acides solides pour le clivage de groupes protecteurs éthers[18] et pour des réactions de réarrangement[19].
Pharmacie
Des résines échangeuses d'ions sont utilisées dans l'industrie pharmaceutique pour catalyser certaines réactions ainsi que pour isoler et purifier des substances actives de médicaments. Certains sont des ingrédients actifs, comme le poly(styrène sulfonate) de sodium, le colestipol (en) et la cholestyramine. Le poly(styrène sulfonate) de sodium est une résine fortement acide utilisée contre l'hyperkaliémie[20], tandis que le colestipol est une résine faiblement basique utilisée contre l'hypercholestérolémie[21], de même que la cholestyramine[22], qui est une résine fortement basique ; ces deux résines sont des chélateurs d'acides biliaires[23].
Des résines échangeuses d'ions peuvent également être utilisées comme excipients dans certaines formulations pour comprimés, gélules, pâtes et suspensions, où elles peuvent améliorer le goût, prolonger la libération du médicament, accroître la biodisponibilité ou encore stabiliser les substances actives.
Des résines chélatantes ont fait l'objet d'études en soutien de traitements contre certaines pathologies caractérisées par l'accumulation chronique d'ions métalliques, comme la maladie de Wilson (accumulation du cuivre)[24] et l'hémochromatose de type 1 (hémosidérose héréditaire)[25] - [26] - [27] - [28]. Ces polymères agissent en formant des complexes stables avec les ions ferreux Fe2+ et ferriques Fe3+ dans l'appareil digestif, ce qui limite l'absorption de ces ions, et donc leur accumulation dans l'organisme. Bien que cette méthode ait une efficacité plus limitée que celle des traitements chélateurs comme le déférasirox, la défériprone et la déféroxamine, cette approche ne présente que des effets secondaire mineurs du point de vue de sa toxicité chronique[25]. Il est intéressant de noter que la chélation simultanée du fer ferreux Fe2+ et ferrique Fe3+ accroît l'efficacité du traitement[25].
Notes et références
- (en) François de Dardel et Thomas V. Arden, « Ion Exchangers », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a14_393.pub2, lire en ligne)
- (en) K. Horie, Máximo Barón, R. B. Fox, J. He, M. Hess, J. Kahovec, T. Kitayama, P. Kubisa, E. Maréchal, W. Mormann, R. F. T. Stepto, D. Tabak, J. Vohlídal, E. S. Wilks et W. J. Work, « Definitions of terms relating to reactions of polymers and to functional polymeric materials (IUPAC Recommendations 2003) », Pure and Applied Chemistry, vol. 76, no 4, , p. 889-906 (DOI 10.1351/pac200476040889, lire en ligne)
- (en) Sarah E. H. Comstock et Treavor H. Boyer, « Combined magnetic ion exchange and cation exchange for removal of DOC and hardness », Chemical Engineering Journal, vol. 241, , p. 366-375 (DOI 10.1016/j.cej.2013.10.073, lire en ligne)
- (en) Max R. D. Mergen, Bruce Jefferson, Simon A. Parsons et Peter Jarvis, « Magnetic ion-exchange resin treatment: impact of water type and resin use », Water Research, vol. 42, nos 8-9, , p. 1977-1988 (PMID 18155745, DOI 10.1016/j.watres.2007.11.032, lire en ligne)
- (en) Jae-chun Lee, Hye-Jin Hong, Kyeong Woo Chung et Sookyung Kim, « Separation of platinum, palladium and rhodium from aqueous solutions using ion exchange resin: a review. », Separation and Purification Technology, vol. 246, , article no 116896 (DOI 10.1016/j.seppur.2020.116896, lire en ligne)
- (en) M. Ochsenkühn-Petropulu, T. Lyberopulu et G. Parissakis, « Selective separation and determination of scandium from yttrium and lanthanides in red mud by a combined ion exchange/solvent extraction method », Analytica Chimica Acta, vol. 315, nos 1-2, , p. 231-237 (DOI 10.1016/0003-2670(95)00309-N, lire en ligne)
- (en) David O. Campbell et Samuel R. Buxton, « Rapid Ion Exchange Separations. Chromategraphic Lanthanide Separations Using a High-Pressure Ion Exchange Method », Industrial & Engineering Chemistry Process Design and Development, vol. 9, no 1, , p. 89-94 (DOI 10.1021/i260033a016, lire en ligne)
- (en) Mohamed Krea et Hussein Khalaf, « Liquid–liquid extraction of uranium and lanthanides from phosphoric acid using a synergistic DOPPA–TOPO mixture », Hydrometallurgy, vol. 58, , p. 215-225 (DOI 10.1016/S0304-386X(00)00129-8, lire en ligne)
- (en) A. Takahashi, Y. Ueki, S. Igarashi, « Homogeneous liquid-liquid extraction of uranium(VI) from acetate aqueous solution », Analytica Chimica Acta, vol. 387, no 1, , p. 71-75 (DOI 10.1016/S0003-2670(99)00038-0, lire en ligne)
- (en) K. M. V. Jayaram, K. K. Dwivedy, A. S. Deshpande et T. M. Ramachar, « Studies on the recovery of uranium from low-grade ores in India » [PDF], Uranium ore processing, sur https://inis.iaea.org/, AIEA, 24-26 novembre 1975 (ISBN 92-0-041176-2, consulté le ), p. 155-169.
- (en) Graham Taylor, Vic Farrington, Peter Woods, Robert Ring et Robert Molloy, « Review of Environmental Impacts of the Acid In-situ Leach Uranium Mining Process », sur http://large.stanford.edu/, CSIRO (consulté le ).
- (en) Vladimir N. Rychkov, Evgeny V. Kirillov, Sergey V. Kirillov, Grigory M. Bunkov, Maxim A. Mashkovtsev, Maxim S. Botalov, Vladimir S. Semenishchev et Vladimir A. Volkovich, « Selective ion exchange recovery of rare earth elements from uranium mining solutions », AIP Conference Proceedings, vol. 1767, no 1, , article no 020017 (DOI 10.1063/1.4962601, lire en ligne)
- (en) M. Smolik, A. Jakóbik-Kolon et M. Porański, « Separation of zirconium and hafnium using Diphonix® chelating ion-exchange resin », Hydrometallurgy, vol. 95, nos 3-4, , p. 350-353 (DOI 10.1016/j.hydromet.2008.05.010, lire en ligne)
- (en) L. Hallstadius, S. Johnson, E. Lahoda, « Cladding for high performance fuel », Progress in Nuclear Energy, vol. 57, , p. 71-76 (DOI 10.1016/j.pnucene.2011.10.008, lire en ligne)
- (en) Herbert W. Keller, John M. Shallenberger, David A. Hollein et A. Carl Hott, « Development of Hafnium and Comparison with Other Pressurized Water Reactor Control Rod Materials », Nuclear Technology, vol. 59, no 3, , p. 476-482 (DOI 10.13182/NT82-A33005, lire en ligne)
- (en) Cal Y. Meyers et Leonard E. Miller, « ε-Aminocaproic Acid », Organic Syntheses, vol. 32, , p. 13 (DOI 10.15227/orgsyn.032.0013, orgsyn.org/Content/pdfs/procedures/CV4P0039.pdf)
- (en) Carl Kaiser et Joseph Weinstock, « Alkenes via Hofmann Elimination: Use of Ion-Exchange Resin for Preparation of Quaternary Ammonium Hydroxides: Diphenylmethyl Vinyl Ether », Organic Syntheses, vol. 55, , p. 3 (DOI 10.15227/orgsyn.055.0003, lire en ligne)
- (en) R. A. Earl et L. B. Townsend, « Methyl 4-Hydroxy-2-Butynoate », Organic Syntheses, vol. 60, , p. 81 (DOI 10.15227/orgsyn.060.0081, lire en ligne)
- (en) David G. Hilmey et Leo A. Paquette, « 1,3-Dichloroacetone as a Cyclopropanone Equivalent: 5-Oxaspiro[3.4]octan-1-one », Organic Syntheses, vol. 84, , p. 156 (DOI 10.15227/orgsyn.084.0156, lire en ligne)
- (en) Chad Kessler, Jaclyn Ng, Kathya Valdez, Hui Xie, Brett Geiger, « The use of sodium polystyrene sulfonate in the inpatient management of hyperkalemia », Journal of Hospital Medicine, vol. 6, no 3, , p. 136-140 (PMID 21387549, DOI 10.1002/jhm.834, lire en ligne)
- (en) Gloria Lena Vega et Scott M. Grundy, « Treatment of Primary Moderate Hypercholesterolemia With Lovastatin (Mevinolin) and Colestipol », Journal of the American Medical Association, vol. 257, no 1, , p. 33-38 (PMID 3537351, DOI 10.1001/jama.1987.03390010037024, lire en ligne)
- (en) S. Tonstad, J. Knudtzon, M. Sivertsen, H. Refsum et L. Ose, « Efficacy and safety of cholestyramine therapy in peripubertal and prepubertal children with familial hypercholesterolemia », The Journal of Pediatrics, vol. 129, no 1, , p. 42-49 (PMID 8757561, DOI 10.1016/s0022-3476(96)70188-9, lire en ligne)
- (en) K. Einarsson, S. Ericsson, S. Ewerth, E. Reihnér, M. Rudling, D. Ståhlberg et B. Angelin, « Bile acid sequestrants: mechanisms of action on bile acid and cholesterol metabolism », European Journal of Clinical Pharmacology, vol. 40, no 1, , S53-S58 (PMID 2044645, lire en ligne)
- (en) Jana Mattová, Pavla Poučková, Jan Kučka, Michaela Škodová, Miroslav Vetrík, Petr Štěpánek, Petr Urbánek, Miloš Petřík, Zbyněk Nový et Martin Hrubý, « Chelating polymeric beads as potential therapeutics for Wilson’s disease », European Journal of Pharmaceutical Sciences, vol. 62, , p. 1-7 (DOI 10.1016/j.ejps.2014.05.002, lire en ligne)
- (en) Ondřej Groborz, Lenka Poláková, Kristýna Kolouchová, Pavel Švec, Lenka Loukotová, Vijay Madhav Miriyala, Pavla Francová, Jan Kučka, Jan Krijt, Petr Páral, Martin Báječný, Tomáš Heizer, Radek Pohl, David Dunlop, Jiří Czernek, Luděk Šefc, Jiří Beneš, Petr Štěpánek, Pavel Hobza et Martin Hrubý, « Chelating Polymers for Hereditary Hemochromatosis Treatment », Macromolecular Bioscience, vol. 20, no 12, , article no 2000254 (PMID 32954629, DOI 10.1002/mabi.202000254, lire en ligne)
- (en) Jasmine L. Hamilton et Jayachandran N. Kizhakkedathu, « Polymeric nanocarriers for the treatment of systemic iron overload », Molecular and Cellular Therapies, vol. 3, , article no 3 (PMID 26056604, PMCID 4451967, DOI 10.1186/s40591-015-0039-1, lire en ligne)
- (en) Steven C. Polomoscanik, C. Pat Cannon, Thomas X. Neenan, S. Randall Holmes-Farley, W. Harry Mandeville et Pradeep K. Dhal, « Hydroxamic Acid-Containing Hydrogels for Nonabsorbed Iron Chelation Therapy: Synthesis, Characterization, and Biological Evaluation », Biomacromolecules, vol. 6, no 6, , p. 2946-2953 (PMID 16283713, DOI 10.1021/bm050036p, lire en ligne)
- (en) Jian Qian, Bradley P. Sullivan, Samuel J. Peterson et Cory Berkland, « Nonabsorbable Iron Binding Polymers Prevent Dietary Iron Absorption for the Treatment of Iron Overload », ACS Macro Letters, vol. 6, no 4, , p. 350-353 (DOI 10.1021/acsmacrolett.6b00945, lire en ligne)