Octaoxyde de triuranium
L'octaoxyde de triuranium, également appelé octooxyde de triuranium ou octoxyde de triuranium, est le composé chimique de formule brute U3O8, dans lequel l'uranium est formellement à l'état d'oxydation 2x +5 et +6 — ce qu'on pourrait représenter idéalement par UO2·2UO3. C'est un solide inodore de couleur vert olive à noir, constituant l'essentiel du yellowcake (d'où la couleur de ce dernier, autrefois jaune en raison des anciennes méthodes de production et à présent brun à noir à cause de l'octaoxyde de triuranium). U3O8 existe à l'état naturel dans la pechblende.
| Octaoxyde de triuranium | ||

| ||
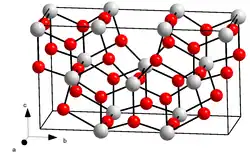 | ||
| __ U5+/6+ __ O2− Structure de l'octaoxyde de triuranium |
||
| Identification | ||
|---|---|---|
| Nom UICPA | trioxouranium | |
| Synonymes |
Oxyde d'uranium(V,VI) |
|
| No CAS | ||
| No ECHA | 100.014.275 | |
| No CE | 215-702-4 | |
| PubChem | ||
| Apparence | solide vert olive à noir | |
| Propriétés chimiques | ||
| Formule | U3O8 | |
| Masse molaire[1] | 842,081 9 ± 0,002 5 g/mol O 15,2 %, U 84,8 %, |
|
| Propriétés physiques | ||
| T° fusion | 1 150 °C | |
| T° ébullition | décomposition en UO2 à 1 300 °C | |
| Masse volumique | 8 380 kg·m-3 | |
| Précautions | ||
 Composé radioactif |
||
| SGH[2] | ||
   Danger |
||
| Unités du SI et CNTP, sauf indication contraire. | ||
Le dioxyde d'uranium UO2 s'oxyde naturellement en U3O8 en présence d'oxygène O2 à 700 °C, tandis que le trioxyde d'uranium UO3 est réduit en U3O8 au-dessus de 500 °C :
L'octaoxyde de triuranium peut être obtenu de plusieurs autres façons, faisant intervenir les intermédiaires tétrafluorure d'uranium UF4 ou fluorure d'uranyle UO2F2.
D'après le CEA, l'état d'oxydation des atomes d'uranium dans le réseau U3O8 serait en fait reparti entre deux atomes à +5 et un autre à +6.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.