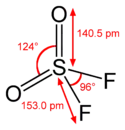
Oxohalogénure
Un oxohalogénure ou oxyhalogénure est un composé chimique dans lequel au moins un atome d'oxygène et au moins un atome d'halogène sont liés à un autre élément A dans une molécule unique. La formule générale des oxohalogénures est donc AOmXn, où X = F, Cl, Br, ou I. L'élément A peut faire partie du groupe principal, être un élément de transition ou un actinide. Les oxohalogénures peuvent être vus comme des intermédiaires entre les oxydes et les halogénures.
Le terme oxohalogénure peut aussi faire référence aux minéraux et autres composés cristallins de même formule chimique générale mais ayant une structure ionique.
Nomenclature
Si la nomenclature IUPAC du composé AOmXn est n-halogénure m-oxyde de A(nombre d'oxydation), les oxohalogénures sont en général simplement nommés sous la forme « oxyhalogénure de A » ou encore « halogénure de A-yle ».
Par exemple, la dénomination IUPAC du composé CrO2Cl2 est « dichlorure dioxyde de chrome », mais il est communément appelé chlorure de chromyle ou encore oxychlorure de chrome.
Synthèse

Il existe en général trois méthodes de synthèse des oxyhalogénures :
- Oxydation partielle de l'halogénure :
- 2PCl3 + O2 → 2POCl3.
Dans cet exemple, l'état d'oxydation du phosphore augmente de deux, mais la charge électrique reste inchangée.
- Halogénation partielle de l'oxyde :
- 2V2O5 + 6Cl2 + 3C → 4VOCl3 + 3CO2
- Remplacement d'oxyde :
- [CrO4]2− + 2Cl− + 4H+ → CrO2Cl2 + 4H2O
De plus, de nombreux oxohalogénures peuvent être produits par réaction d'échange d'halogène, ce type de réaction pouvant également produire des oxohalogénures mixtes, tels que POFCl2 ou CrO2FCl.
Propriétés
Pour un état d'oxydation donné d'un élément A, si deux atomes d'halogène remplacent un atome d'oxygène (ou vice versa), la charge totale de la molécule reste inchangée, mais la coordinence augmente (ou diminue) de un. Par exemple, aussi bien l'oxychlorure de phosphore (POCl3) que le pentachlorure de phosphore (PCl5) sont des composés covalents neutres où le phosphore est à l'état d'oxydation +5, mais dans le premier cas sa coordinence est de 4, alors qu'elle est de 5 dans le second. Si un atome d'oxygène est simplement remplacé par un atome d'halogène, la charge de la molécule augmente d'une unité, mais la coordinence reste la même.
Les oxohalogénures d'éléments dans un haut état d'oxydation sont des oxydants forts, avec un pouvoir oxydant similaire à l'oxyde ou l'halogénure correspondant. La plupart des oxohalogénures s'hydrolysent facilement. Par exemple, le chlorure de chromyle est hydrolysé en chromate par la réaction inverse de sa synthèse. La force motrice de cette réaction est la formation d'une liaison A-O bien plus forte qu'une liaison A-Cl. Ceci résulte en une contribution enthalpique favorable à l'enthalpie libre de la réaction[1].
Beaucoup d'oxohalogénures peuvent agir comme des acides de Lewis. C'est particulièrement le cas avec des oxohalogénures de coordinence 3 ou 4 qui, en acceptant une ou plusieurs paires d'électron d'une base de Lewis, deviennent des composés de coordinence 5 ou 6. Les anions oxohalogénures tels que [VOCl4]2− peuvent être vus comme des complexes acide-base de l'oxohalogénure (VOCl2) avec plus d'ions halogénure agissant comme des bases de Lewis. Un autre exemple est VOCl2 qui forme un complexe bipyramidal trigonal VOCl2(N(CH3)3)2 avec la base triméthylamine[2].
Le spectre vibrationnel de nombreux oxohalogénures a été étudié en détail. Il donne des informations utiles concernant la force relative de liaison. Par exemple, dans CrO2F2, la vibration d'élongation de Cr–O est à 1 006 cm-1 et 1 016 cm-1 alors que celle de Cr–F est à 727 cm-1 et 789 cm-1. Une telle différence est bien trop grande pour être seulement due à une différence de masse entre les atomes d'oxygène et de fluor ; elle montre plutôt que la liaison Cr–O est bien plus forte que la liaison Cr–F. Les liaisons A–O sont en général considérées comme étant des liaisons doubles, ce qui est confirmé par la mesure des longueurs de liaison A–O. Ceci implique que les éléments A et O sont liés par des liaisons σ et π[3].
Les oxohalogénures d'éléments dans des hauts états d'oxydation ont une couleur intense du fait des transitions de transfert de charge entre le ligand et le métal[4].
Éléments du groupe principal
- Éléments du groupe 14 : le carbone forme des oxohalogénures COX2, X=F, Br, et le très toxique phosgène, qui est produit industriellement par la réaction catalysée par le carbone entre le monoxyde de carbone et le dichlore. C'est un réactif utile en chimie organique pour la formation de composés carbonylés[5], par exemple :
- COCl2 + 2 ROH → CO(OR)2 + 2HCl
- Pnictogènes : l'azote forme deux séries d'oxohalogénures, une avec l'azote à l'état d'oxydation +3, NOX, X=F, Cl, Br, et une avec l'azote à l'état d'oxydation +5, NO2X, X=F, Cl. Ils sont produits par halogénation des oxydes d'azote. NO2F et l'ion nitrate NO3− sont par ailleurs isoélectroniques. Seuls des oxohalogénures du phosphore (V) sont connus[6].
- Chalcogènes : le soufre forme des oxohalogénures[7] à l'état d'oxydation +4, tels que le chlorure de thionyle, SOCl2 ou à l'état d'oxydation +6, tels que le fluorure de sulfuryle, SO2F2 et le tétrafluorure de thionyle, SOF4. Tous ces composés s'hydrolysent facilement. Le chlorure de thionyle est d'ailleurs utilisé comme déshydratant, les molécules d'eau étant converties en produits gazeux, laissant derrière elles un solide anhydre[8].
- MgCl2·6H2O + 6SOCl2 → MgCl2 + 6SO2 + 12 HCl
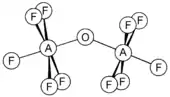
- Le sélénium et le tellure forment des composés similaires, mais aussi des espèces oxo-pontées du type F5AOAF5 (A = S, Se, Te). Ces composés sont non-linéaires avec un angle de liaison A-O-A de 142,5, 142,4 et 145,5° respectivement pour S, Se et Te[9]. L'anion de tellure [TeOF5]−, connu sous le nom de téflate, est un gros anion, plutôt stable, utile pour former des sels stables de gros cations[8].
- Halogènes : les halogènes forment de nombreux oxofluorures, XO2F, XO3F et XOF3 avec X = Cl, Br et I. On connaît également les composés IO2F3 et IOF5[10].
- Gaz nobles : oxytétrafluorure de xénon, XeOF4
Métaux de transition et actinides
4.png.webp)
Ci-dessous est présentée une sélection d'oxohalogénures connus de métaux de transition[12]. X représente les différents halogènes halides, le plus souvent F et Cl.
- État d'oxydation +3 : VOCl, VOBr[13], FeOCl
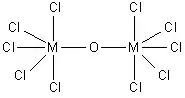
- État d'oxydation +4 : [TiOCl4]2−, Cl3TiOTiCl3, VOCl2, [VOCl4]2−
- État d'oxydation +5 : VOX3,VO2X, [CrOF4]−, [CrOF5]2−, MnOCl3, TcOCl3. Exemples : oxytrichlorure de vanadium, VO2Cl, oxychlorure de niobium
- État d'oxydation +6 : MnO2Cl2, CrO2X2, [CrO3Cl]−, ReOX4, ReO2F2, OsOF4. Exemples : fluorure de chromyle, chlorure de chromyle, dichlorure dioxyde de tungstène, oxytétrachlorure de tungstène
- État d'oxydation +7 : MnO3Cl, ReOF5, ReO2F3, ReO3Cl, OsOF5
- État d'oxydation +8 : OsO2F4, OsO3F2
Le fait que les métaux soit à un haut état d'oxydation vient du fait que l'oxygène est un oxydant fort, tout comme le fluor. Le brome et l'iode sont des oxydants relativement faibles, on connaît donc beaucoup moins d'oxobromures et d'oxoiodures. Les structures de ces composés sont facilement prédites par la théorie VSEPR. Ainsi, CrO2Cl2 est tétraédrique, OsO3F2 est bipyramidal trigonal, XeOF4 est pyramidal à base carrée et OsOF5 est octaédrique[14]. Un cas intéressant est ReOCl4 qui a une structure pyramidale à base carrée, mais avec un seul électron au lieu d'un doublet non-liant en position 6.
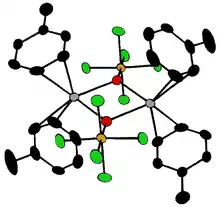
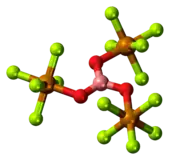
Les composés [Ta2OX10]2− et [M2OCl10]4− (M = W, Ru, Os) ont deux groupes MX5 joints par un pont oxygène[16], chaque métal étant dans un environnement octaédrique. La structure M—O—M inhabituellement linéaire peut être expliquée en termes d'orbitales moléculaires, indiquant la présence ode liaisons dπ — pπ entre les atomes de métal et d'oxygène[17]. Les ponts oxygène ont aussi des configurations plus complexes telles que M(cp)2(OTeF5)2 (M = Ti, Zr, Hf, Mo or W; cp = η5−C5H5)[18] ou [AgOTeF5−(C6H5CH3)2]2[15].
Dans la série des actinides, les composés d'uranyle tels que UO2Cl2 et [UO2Cl4]2− sont bien connus et contiennent une moitié UO2 linéaire. Des composés similaires existent pour le neptunium et le plutonium.
Minéraux et composés ioniques
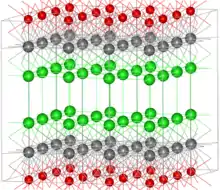
L'oxychlorure de bismuth (BiOCl, ou bismoclite) est un rare exemple d'oxohalogénure minéral. Sa structure cristalline possède une symétrie tétragonale et peut être décrite comme une série de couches d'ions Cl−, Bi3+ et O2− dans l'ordre Cl-Bi-O-Bi-Cl-Cl-Bi-O-Bi-Cl. Cette structure multi-feuillet, similaire à celle du graphite, résulte en une faible dureté relative de la bismoclite (2–2,5 dans l'échelle de Mohs), ainsi que de la plupart des autres oxohalogénures minéraux[19]. On peut citer parmi eux la terlinguaïte Hg2OCl[20], ou la mendipite, Pb3O2Cl2.
Les éléments fer, antimoine, bismuth et lanthane forment des oxochlorures de formule générale MOCl. On connaît aussi les composés MOBr et MOI pour Sb et Bi, et la plupart de leurs structures cristallines ont été déterminées[21].
Notes et références
- Greenwood & Earnshaw, p. 1023
- Greenwood & Earnshaw, p. 996.
- K. Nakamoto, Infrared and Raman spectra of inorganic and coordination compounds, 5e éd., Partie A, Wiley, 1997 (ISBN 0-471-19406-9), Tables II-4c, II-6g, II-6h, II-7b, II-8c
- Shriver & Atkins, Figure 13.8, p. 447
- Shriver & Atkins, p. 358
- Housecroft & Sharpe, p. 329–330
- Housecroft & Sharpe, p. 365–367
- Shriver & Atkins, p. 397
- Heinz Oberhammer et Konrad Seppelt, « Molecular Structure of F5SOSF5, F5SeOSeF5, and F5TeOTeF5: d-Orbital Participation in Bonds between Main Group Elements », Angewandte Chemie International Edition, vol. 17, no 1, , p. 69–70 (DOI 10.1002/anie.197800691)
- Housecroft & Sharpe, p. 395
- Mohieddine Fourati, Moncef Chaabouni, Claude Henri Belin, Monique Charbonnel, Jean Louis Pascal et Jacqueline Potier, « A strongly chelating bidentate CLO4. New synthesis route and crystal structure determination of Ti(CLO4)4 », Inorg. Chem., vol. 25, no 9, , p. 1386–1390 (DOI 10.1021/ic00229a019)
- Greenwood & Earnshaw, chapitres 22–25, section Halides and oxohalides
- Greenwood & Earnshaw p. 993.
- Housectroft & Sharpe, Chapters 21 and 22 illustrate many structures, including M-O and M-Cl bond lengths.
- Steven H. Strauss, Mark D. Noirot et Oren P. Anderson, « Preparation and characterization of silver(I) teflate complexes: bridging OTeF5 groups in the solid state and in solution », Inorg. Chem., vol. 24, no 25, , p. 4307–4311 (DOI 10.1021/ic00219a022)
- John. C. Dewan et Edwards, Anthony J.; Calves, Jean Y.; Guerchais, Jacques E., « Fluoride crystal structures. Part 28. Bis(tetraethylammonium)µ-oxo-bis[pentafluorotantalate(V)] », J. Chem. Soc., Dalton Trans., no 10, , p. 978–980 (DOI 10.1039/DT9770000978). La structure est illustrée dans Housectroft & Sharpe, Figure 22.5.
- Housectroft & Sharpe, Figure 22.15.
- Martin C. Crossman, Eric G. Hope et Graham C. Saunders, « Cyclopentadienyl metal teflate (OTeF5) complexes », J. Chem. Soc., Dalton Trans., no 4, , p. 509–511 (DOI 10.1039/DT9960000509)
- (en) Handbook of Mineralogy, vol. III (Halides, Hydroxides, Oxides), Chantilly, VA, Mineralogical Society of America, PDF (ISBN 0-9622097-2-4, lire en ligne), « Bismoclite »
- W. F. Hillebrand et W. T. Schaller, « Art. XXVI. The Mercury Minerals from Terlingua, Texas: Kleinite, Terlinguaite, Eglestonite, Montroydite, Calomel, Mercury », The American Journal of Science, no 139, , p. 259–274 (lire en ligne, consulté le )
- Wells, p. 390–392
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Oxohalide » (voir la liste des auteurs).
Bibliographie
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 0080379419)
- Housecroft, C. E. et Sharpe, A. G., Inorganic Chemistry, 2e éd., Pearson Prentice-Hall 2005 (ISBN 0-582-31080-6)
- Shrivr, D. F. et Atkins, P. W., Inorganic Chemistry, 3e éd., Oxford University Press, 1999 (ISBN 0-19-850330-X)
- A. F. Wells, Structural Inorganic Chemistry, Oxford, Clarendon Press, , 3e éd., 384–392 p. (ISBN 0-19-855125-8).