Fluorure de carbonyle
Le fluorure de carbonyle ou fluorophosgène est un composé chimique apolaire de formule COF2. Il s'agit d'un gaz incolore hygroscopique plus dense que l'air et extrêmement toxique qui s'hydrolyse au contact de l'eau en libérant notamment du fluorure d'hydrogène HF[3] dissous, c'est-à-dire de l'acide fluorhydrique HF(aq) :
| Fluorure de carbonyle | |
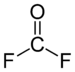  Structure du fluorure de carbonyle |
|
| Identification | |
|---|---|
| Nom UICPA | difluorure de carbonyle |
| Synonymes |
oxyfluorure de carbone, |
| No CAS | |
| No ECHA | 100.005.941 |
| No CE | 206-534-2 |
| PubChem | 9623 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore d'odeur piquante |
| Propriétés chimiques | |
| Formule | CF2O [Isomères] |
| Masse molaire[1] | 66,006 9 ± 0,001 1 g/mol C 18,2 %, F 57,56 %, O 24,24 %, |
| Propriétés physiques | |
| T° fusion | −114 °C[2] |
| T° ébullition | −84,6 °C[2] |
| Solubilité | hydrolyse |
| Point critique | 14,8 °C[2] |
| Point triple | −111,3 °C et 12,52 kPa[2] |
| Précautions | |
| SGH[2] | |
   Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Production
Le fluorure de carbonyle peut être produit en faisant réagir du phosgène COCl2 avec du fluorure d'hydrogène HF ainsi que par oxydation du monoxyde de carbone CO, cette dernière voie ayant cependant l'inconvénient de conduire souvent au tétrafluorure de carbone CF4 par oxydation excessive ; le difluorure d'argent AgF2 produit cependant une oxydation ménagée qui convient bien à cette réaction :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Carbonyl difluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 1 décembre 2012 (JavaScript nécessaire)
- (en) M. W. Farlow, E. H. Man, C. W. Tullock et Ronald D. Richardson, « Carbonyl Fluoride », Inorganic Syntheses, vol. 6, (lire en ligne) DOI 10.1002/9780470132371.ch48

