Transport de l'eau dans les plantes
Le transport de l'eau dans les plantes est un processus au cours duquel les plantes absorbent l'eau et les minéraux par leurs racines, les transmettent à travers les vaisseaux conducteurs du xylème et libèrent l'eau sous forme de vapeur par transpiration au travers des stomates sous les feuilles.
Histoire de la recherche
Aucun sujet en physiologie végétale n'a une histoire plus longue ou une littérature plus volumineuse que la montée antigravitationnelle de l'eau dans les plantes supérieures. La théorie la plus récente postule que l'eau est tirée à travers le xylème par des gradients de tension produits par la perte d'eau par transpiration. Cette hypothèse est appelée « théorie de la cohésion » et a été introduite par Henry Horatio Dixon et John Joly (1894, 1895) et Eugen Askenasy (de) (1895). La théorie de la cohésion est aujourd'hui remise en question par certains physiologistes : la pierre d’achoppement concerne les pressions négatives importantes dans le xylème et les phénomènes de cavitation de l'eau induits, que la théorie de la cohésion implique[1].
A priori historique
L'arbre fut d'abord envisagé sous le rapport de l'économie. L'idée ancienne voulait que la sève redescende dans les racines le temps de l'hiver. La sève « naturellement riche en matières putrescibles » avait la réputation de corrompre le bois après coupe: le bois coupé « en sève », donc en période estivale, n'était donc pas réputé aussi bon pour être mis en œuvre. Aussi, la coupe « hors sève » était-elle recommandée ; le bois devait être aussitôt séché ; la coupe « hors sève » avait aussi la réputation de faciliter la formation des rejets de souche, pour la formation des taillis[2]. Cette idée ancienne se retrouve dans le Recueil des édits et ordonnances concernant les eaux et forêts[3] de 1610 de Saint-Yon, maître des requêtes, qui établit que le rejet « profitait bien mieux lorsqu'on coupait dans le premier quartier de la lune et hors le temps de sève, parce que les racines concentraient en elles-mêmes, par l'effet de l'humidité de l'hiver, toute la substance qui se distribuait auparavant dans tout le corps de l'arbre, ce qui faisait que ces racines poussaient bien plus vite et avec bien plus de force au printemps » [2]. L’abattage hors sève, qu'il soit ou non efficace pour contrer la pourriture ou obtenir des bois de construction durs, est ancré dans les usages, et même transposé dans la loi (Un règlement de la Table de marbre du défend aux adjudicataires des ventes « et autres personnes quelconques de couper aucun bois dans les forêts en temps de sève, savoir depuis la mi-mai jusqu'à la mi-septembre sous peine de confiscation»). Ainsi depuis le ou depuis le 1er mai, jusqu'au « dernier septembre » les forêts était fermées, même aux propriétaires[4].
L'idée que l'on se fait de la sève demeure fort vague. Encore en 1763, pour Duhamel du Monceau la sève: « est l’humeur qui se trouve dans le corps des plantes »[5]: les pleurs de la vigne, la sève qui sort de l'érable pour produire le sirop d'érable, l'eau de bouleau, celle du noyer ou du charme sont qualifiés de « lymphe », la résine que l'on tire d'autres arbres est qualifiée de « suc propre »). Au XVIIIe siècle, tous les physiciens d'autre-part sont divisés sur la question de l'origine de la rosée[6] que l'on confond alors avec la guttation. Pieter van Musschenbroek distingue trois espèces de rosée, la première qui tombe du ciel, la seconde qui émane de la terre et la troisième qui est suée par les végétaux. « La rosée des plantes est proprement comme leur sueur et par conséquent comme une humeur qui leur appartient et qui sort de leurs vaisseaux excrétoires. De là vient que les gouttes de cette rosée différent entre elles en grandeur et en quantité et occupent différentes places suivant la structure le diamètre la quantité et la situation de ces vaisseaux excréteurs. ». Musschenbroek dans ses Essais de physique ajoute que la rosée[7]:
« quelques fois est faine pour les Animaux & les Plantes, mais elle est aussi quelquefois nuisible aux uns & aux autres, selon qu'elle est composée de parties rondes ou tranchantes, & aigues, de parties douces ou âpres, salines ou acides, spiritueuses ou oléagineuses, corrosives ou terrestres. C'est pour cela que les Médecins attribuent à la Rosée diverses maladies, comme des Fievres chaudes, le Flux de sang , etc. On a même observé que ceux qui se promènent souvent sous les Arbres où il y a beaucoup de Rosée devenoient galeux. »
— Pieter van Musschenbroek, Essais de physique, 1739
L'hypothèse dominante à partir du XVIIe siècle, est calquée sur les travaux de William Harvey (1578-1657), qui a établi et fait la démonstration de la circulation sanguine générale (de Motu Cordis, 1628). Les botanistes déduisent des travaux de Harvey qu’il existe chez les plantes une circulation de la sève analogue à la circulation du sang chez les animaux: la sève irait ascendante à l'intérieur du tronc ou de la tige, et descendante à la périphérie du tronc[8]. Dans les années 1660 Johann Daniel Major (en) (1634-1693) suggère l'analogie, Timothy Clarke (en) (- 1672) écrit sur la circulation du liquide dans les plantes sensibles et recherche au microscope les équivalents structuraux des valves cardiaques, et Nicaise Le Febvre (1610-1662) compare les fonctions de la sève et du sang. Dans les années 1670 et 1680, Nehemiah Grew (1641-1712) et Marcello Malpighi (1628-1694) ont impressionné le monde botanique avec leurs études systématiques de l'anatomie et de la physiologie des plantes. Mais ce sont Edme Mariotte (1620-1684) et Claude Perrault (1613-1688) qui poussent l'analogie entre le sang et la sève à ses limites, débat parrainé par l'Académie des sciences, et qui marque le premier effort systématique d'application de la théorie circulatoire aux plantes[9]. L'incapacité à trouver des organes équivalents a évidemment sérieusement affaibli l'analogie, un circuit de sève est toutefois établi. Perrault, Mariotte, et Duclos qui s'est joint au débat, publient leurs points de vue sur la théorie, Mariotte dans son Premier essai : De la végétation des plantes en 1679[10]. En l'absence d'une alternative convaincante, les botanistes trouvent une analogie partielle meilleure que si elle n'avait pas existé. Ceci jusqu'à la Statique des végétaux de Stephen Hales. L'hypothèse de la circulation de la sève a tout du moins le mérite d'attirer l'attention sur un problème central de la botanique, à savoir le transport de la sève[9].
Les connaissances les plus récentes démontrent que les tubes du xylème qui transportent l'eau (trachéide essentiellement), contiennent une colonne d'eau continue, réfutant l'idée de valves intermédiaires. De plus les cellules du xylèmes sont des cellules mortes.
Après que le physicien italien Evangelista Torricelli (1608-1647) ait démontré vers 1644 que l'air a un poids (que la nature n'a pas horreur du vide, et, par là, démontré la hauteur de pompage limite à 10,33 mètres de n'importe quelle pompe aspirante), certains ont suggéré que l'eau était entraînée à travers les plantes par la pression atmosphérique sur les racines. Mais il a été tout de suite évident que de nombreuses atmosphères de pression auraient été nécessaires pour conduire l'eau des profondeurs de la terre au sommet des grands arbres[11].
Pour le botaniste allemand Georg Andreas Agricola (de) dans son Neu- und nie erhörter doch in der Natur und Vernunfft wohlgegründeter Versuch der Universal-Vermehrung aller Bäume, Stauden, und Blumen de 1716-1717, la circulation de la sève est une variante du modèle circulatoire emprunté à ses prédécesseurs où l'éther — thème ancien que vient de rafraichir Newton pour expliquer la gravitation — et la pression atmosphérique ont un rôle à jouer, dans un mouvement perpétuel[12]:
« Enfin, l'on peut conclure de tout ce qui a été dit que l'Æther se trouve dans toutes les liqueurs & choses aqueuses par où l'air peut pénétrer dans les parties spongieuses & poreuses, & s'y comprimer fort facilement, & qu'il a aussi la vertu de se dilater. Supposé qu'il y eut un arbre beaucoup plus grand que la Tour de la Maison de ville de Ratisbonne, & qu'il fût pourvû de ses petits tuïaux & conduits, vésicules & valvules, comme cette Tour l'est de son escalier, & comme on l'a prouvé par ce qui a été dit ci dessus, il attireroit à soi par une espéce de détroit, vû la quantité de ses racines spongieuses, le suc nutritif de la terre, comme aussi l'Æther qui est pareillement sous terre: A laquelle operation la pression de l'Athmosphère doit beaucoup contribuer, car c'est un chose connue que les filets de racine vont en grossissant plus on remonte vers le tronc, comme ceux de la tige vont en retrecissant. Par là l'air comprimé entre dans un plus grand espace: C'est pourquoi il s'efforce de se dilater; mais les corps résistent à l'air, qui à son tour leur fait résistance, & de cette action & réaction résulte le mouvement intérieur: Et comme la tige n'est aussi autre chose qu'un canal & des tuïaux, les sucs sont rechassés par ces mouvemens du large vers la hauteur, & mis à l'étroit par la pression extérieure de l'Athmosphère. Or afin que le suc poussé en haut ne puisse retomber vers le bas, il y a pour cet effet dans les tuïaux qui remontent, plusieurs valvules qui l'empéchent de s'en retourner. Lorsqu'il a atteint sa hauteur par ses canaux ou tuïaux, il retourne de l'étroit dans le large, & rebrousse chemin par ces tuïaux. Et véritablement un mouvement perpétuel qui surpasse tous les autres. Si j avois envie de chercher à present le mouvement perpétuel, je tirerois de là mon principe, parce qu'il est fondé sur la nature mais ce n'est pas là mon étude. Cependant on aura par là prouvé en quelque façon comment les humeurs aqueuses peuvent monter & descendre dans les arbres. Or comme leur vie consiste dans le mouvement, & que c'est la fixation des humeurs qui cause leurs maladies & leur mort, je traiterai dans le Chapitre suivant de la maladie & de la mort des arbres »
— Georg Andreas Agricola, L'Agriculture parfaite. 1720
L'exploitation hivernale des arbres désormais se fonderait d'autre-part sur l'axiome corrigé: « Pendant l'hiver, alors que la végétation est engourdie les arbres contiennent moins de sève qu'à toute autre saison. »[13].
Stephen Hales

Stephen Hales (1677-1761), un disciple d'Isaac Newton[8], étudie expérimentalement le mouvement de l'eau dans la plante (Vegetable Staticks, 1727, la Statique des végétaux traduit en français par Buffon en 1753, en allemand : Statick der Gewächse, 1748). Il se rend compte que ce n'est pas principalement - comme on le supposait précédemment - la pression racinaire qui entraîne la sève, mais la transpiration des feuilles[14] .
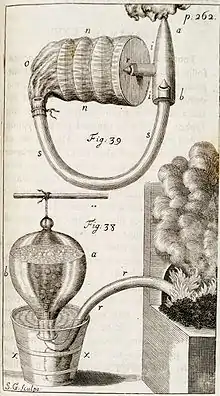
Hales estima la surface des feuilles de la plante ainsi que la longueur et la surface des racines. Cela lui permit de comparer l'afflux d'eau calculé dans la plante avec la quantité d'eau quittant la plante par transpiration à travers les feuilles. Il mesura également — the force of the sap — la force de la sève ou la poussée radiculaire[15]. Hales fit remarquer — « plants very probably draw through their leaves some part of their nourishment from the air » —que les plantes tirent très probablement à travers leurs feuilles une partie de leur nourriture depuis l'air. Dans Vegetable Staticks, Hales préfigurait la théorie de la cohésion du mouvement de l'eau dans les plantes, bien que ses idées n'aient pas été comprises à l'époque ; il n'a donc pas influencé le débat sur le transport de l'eau dans les plantes au XIXe siècle[16]. Il émit également l'hypothèse que les plantes pourraient utiliser la lumière comme source d'énergie pour la croissance (la photosynthèse), sur la base de la suggestion d'Isaac Newton selon laquelle — « gross bodies and light » — les corps grossiers et la lumière pourraient être interconvertibles[17] - [18].
Dans Vegetable Staticks, Hales également décrivit des expériences qui montrèrent que — « … air freely enters plants, not only with the principal fund of nourishment by the roots, but also thro' the surface of their trunks and leaves » — l'air pénètre librement dans les plantes, non seulement avec le principal fond de nourriture par les racines, mais aussi à travers la surface de leurs troncs et les feuilles. Les travaux de Hales sur la chimie de l'air semblent primitifs selon les normes modernes, leur importance cependant fut reconnue par Antoine Lavoisier, le découvreur de l'oxygène[15]. L'invention de Hales de la cuve pneumatique pour collecter les gaz sur l'eau est également considérée comme une avancée technique majeure. Des formes modifiées de la cuve pneumatique ont ensuite été utilisées dans leurs recherches par William Brownrigg, Henry Cavendish et Joseph Priestley.
Dans la théorie de la cohésion-tension proposée au XXe siècle par Henry Horatio Dixon une tension d'aspiration est créée par la transpiration. Quand l'eau s'évapore hors des pores de la paroi cellulaire des feuilles, une énorme pression de −15 atmosphères se crée pour un arbre moyen (Dans les liquides il est possible de créer des pressions négatives qu'il n'est pas possible de créer dans les gaz. Pour un solide, cela équivaudrait à créer une tension mécanique dans le matériau par traction.). À l'interface du pore, une pression de 1 atmosphère est assurée par l'atmosphère terrestre et 15 atmosphères négatives de l'autre côté. Le ménisque du pore, la forme incurvée à l'intérieur d'un tube capillaire qui se forme à l'interface entre l'eau et l'air ne se brise pas sauvé par la petitesse du diamètre des trachéides, de l'ordre de deux à cinq nanomètres de diamètre. Un gradient de pression s'établit vers le bas; à hauteur des racine la pression est de une atmosphère. Se pose éventuellement la question de la mise en cavitation de la sève qui est empêché par la continuité liquide de la colonne d'eau[19].
Duhamel du Monceau (1700-1782) dans La Physique des arbres de 1763, se place en vulgarisateur de Hales[8]. Il mène aussi différentes expériences sur la qualité des bois relativement à leur période d'abattage et écorne au passage les traditions en vigueur. Il trouve qu'il y a du moins autant de sève dans les arbres en hiver qu'en été[20]. Rumford lui-même arrive par ses propres expériences à la conclusion que la sève est en quantité moins importante en été (et il la trouve si étrange, cette observation heurte tellement les opinions reçues, qu'il n'en tient pas compte et préfère l'« attribuer à quelque circonstance fortuite et exceptionnelle »[13]). Pour justifier l'exploitation des arbres en hiver nous dit en 1863, Antoine-Auguste Mathieu, inspecteur des forêt,« il ne convient donc pas d'invoquer une moindre teneur en sève, puisque c'est l'inverse qui a lieu, il faut s'appuyer sur la qualité différente de cette substance »[13].
Ce qui se passe réellement dans la plante, jusqu'à la fin du XIXe siècle, n'est qu'en grande partie l'objet de spéculations, qui se manifestent encore dans l’opposition entre vitalistes et physiciens. Jamin (1860) et Godlewsky (1884) expliquent le phénomène de la monté de la sève, en supposant que les cellules des plantes ont des propriétés particulières[8].
Recherche moderne
La façon dont les racines absorbent l'eau et les nutriments minéraux n'est devenue disponible à l'étude que dans la seconde moitié du XIXe siècle lorsque Julius Sachs (1832-1897) introduit l'hydroculture. Il détermine quels éléments chimiques sont nécessaires à la croissance des plantes et sont absorbés par les racines. Il découvre que les poils racinaire (rhizodermes) fins des racines absorbent l'eau et les nutriments[21].
En 1891, Eduard Strasburger montre que la montée de la sève dans le xylème s'explique purement physiquement et ne nécessite aucune cellule vivante. Dans les années suivantes, beaucoup de scientifiques allemands s’attellent à la question[8]; l'ancien assistant de Strasburger, Henry Horatio Dixon[22] et d'autres, développent la théorie de la cohésion-tension pour expliquer la montée de la sève, selon laquelle une tension d'aspiration, causée par la transpiration, entraîne la sève. Cependant, cette théorie demeure longtemps controversée car de nombreux botanistes rejettent une explication purement physique, et ils peuvent se réfugier dans des phénomènes tels que la guttation, qui ne peuvent être expliqués de cette manière.
La théorie de la cohésion-tension proposé en 1894 par John Joly et Henry Horatio Dixon [23] - [24], est une théorie de l'attraction intermoléculaire qui explique le processus d'écoulement de l'eau vers le haut (contre la force de gravité) à travers le xylème des plantes[25].
L'eau est une molécule polaire. Lorsque deux molécules d'eau se rapprochent, l'atome d'oxygène légèrement chargé négativement de l'une forme une liaison hydrogène avec un atome d'hydrogène légèrement chargé positivement dans l'autre. Cette force d'attraction, avec d'autres forces intermoléculaires, est l'un des principaux facteurs responsables de l'apparition de tension superficielle dans l'eau liquide. Il permet également aux plantes de puiser de l'eau de la racine à travers le xylème jusqu'à la feuille.
L'eau est constamment perdue par la transpiration de la feuille. Lorsqu'une molécule d'eau est perdue, une autre est entraînée par les processus de cohésion et de tension. La traction de transpiration, utilisant l'action capillaire et la tension superficielle inhérente de l'eau, est le principal mécanisme du mouvement de l'eau dans les plantes[26]. Cependant, ce n'est pas le seul mécanisme impliqué. Toute utilisation d'eau dans les feuilles oblige l'eau à y pénétrer.
La transpiration dans les feuilles crée une tension (pression différentielle) dans les parois cellulaires des cellules mésophylles. En raison de cette tension, l'eau est tirée des racines vers les feuilles, aidée par la cohésion (la traction entre les molécules d'eau individuelles, due aux liaisons hydrogène) et l'adhérence (le caractère collant entre les molécules d'eau et les parois cellulaires hydrophiles des plantes). Ce mécanisme d'écoulement de l'eau fonctionne en raison du potentiel de l'eau (l'eau s'écoule d'un potentiel élevé vers un potentiel faible) et des règles de diffusion simple[27].
La théorie de la cohésion-tension proposée, basée sur la recherche classique de Dixon-Joly (1894), Eugen Askenasy (1845-1903) (1895)[28] - [29], et Dixon (1914, 1924), est malgré de nombreuses objections[30] - [31], la théorie la plus largement acceptée pour le transport de l'eau à travers le système vasculaire d'une plante. La théorie de Dixon est cependant oubliée pendant un demi-siècle avant de faire à nouveau l’objet des travaux de J. A. Milburn, M. H. Zimmermann et Melvin T. Tyree à partir des années 1970-1980[8].
Avec la découverte du transport actif des ions à travers les membranes cellulaires vers 1930, un autre mécanisme sera ajouté, qui peut provoquer un léger flux de sève, sans transpiration[32].
Au cours du XXe siècle, de nombreuses recherches furent menées sur le mécanisme du transport de la sève du xylème; aujourd'hui, la plupart des phytotechniciens continuent à s'accorder sur le fait que la théorie de la cohésion-tension explique le mieux ce processus. Mais des théories multiforce qui émettent l'hypothèse de plusieurs mécanismes alternatifs ont été suggérées, notamment des gradients de pression osmotique longitudinaux cellulaires et du xylème, des gradients de potentiel axial dans les vaisseaux et des gradients interfaciaux supportés par des bulles de gaz [33] - [34] - [35].
Transport d'eau dans les plantes
L'assimilation du CO2 dans les plantes par les chloroplastes via les stomates, est accompagnée inévitablement d'une perte d'eau par transpiration[36]. Entre le sol et la surface d'évaporation située dans les feuilles, l'eau doit traverser un premier massif cellulaire dans les racines, un système conducteur qui transporte l'eau de la racine vers les feuilles (le xylème, constitué de cellules vides de 100 à 500 micromètres de diamètre, et de quelques centaines de μm à quelques millimètres de longueur), et enfin un massif cellulaire dans les feuilles[37].
L'eau traverse les cellules au travers de barrières membranaires, ou elle contourne la cellule en circulant dans la paroi cellulosique[37]. À travers la racine, la circulation radiale de l'eau peut se faire par voie apoplastique (parois pectocellulosiques et espaces vides entre cellules), par voie symplastique (par l’intermédiaire des plasmodesmes) ou par voie vacuolaire (l'eau est obligée de passer deux fois à travers le cytoplasme et ses membranes)[38]. Ces barrières cellulaires (membrane hémiperméable) sont essentielles pour entretenir le phénomène d'osmose.
La circulation de l'eau dans la plante est corrélée à l’existence d'un gradient de potentiel hydrique : l'eau circule dans le sens des potentiels hydriques décroissants[38]. Un certain nombre de phénomènes physico-chimiques : interaction osmotique, capillaire, action de pression ou de tension externes au système, modifient le potentiel hydrique, en forment les composantes. Les potentiels hydriques en série décroissante induisent une force motrice responsable du déplacement de l'eau dans la plante[37].
Absorption d'eau dans la racine
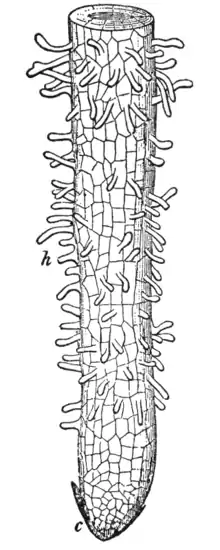
Des trois organes de base — feuille, tige et racine — la racine est spécialisée dans l'absorption de l'eau et des ions du sol, et est donc normalement souterraine. Cette tâche est effectuée en particulier dans la zone du rhizoderme par les poils racinaires, qui offrent une grande surface d'échange de substances dans cette zone. En plus de l'absorption d'eau, l'absorption des ions est également une fonction centrale. Ceux-ci sont très dilués (10 -4 mol/l) et, de plus, ne sont pas dans le rapport exigé par la plante. La concentration des ions (sels nutritifs dissous) est un processus énergivore[39].
Il existe différentes formes d'eau dans le sol. L'eau souterraine est inaccessible à de nombreuses plantes, car leurs racines ne s'enfoncent pas assez profondément. Dans les couches supérieures du sol, l'eau est présente sous forme d'eau de rétention (adsorbée par les particules du sol, également connue sous le nom d'eau de gonflement (de), voir aussi le retrait-gonflement des argiles), sous forme d'eau capillaire[40] (liée par forces capillaires) et d'humidité (vapeur d'eau issue de l'air). Le potentiel capillaire de l'eau de rétention est généralement si négatif qu'il est inaccessible à la plante. Les plantes utilisent l'eau capillaire pour répondre à leurs besoins[41].
Le sol et ses pores sont en équilibre d'humidité avec l'environnement. Au niveau des eaux souterraines, l'humidité est de 100%; dans l'espace aérien au-dessus de la surface de la terre elle est fonction de l'humidité de l'air (par exemple 40%). Entre les deux existe un gradient d'humidité, en raison duquel une diffusion capillaire[42] - [note 1] ou une aspiration capillaire peut avoir lieu (C'est l'une des raisons du processus de chromatographie sur couche mince en chimie). La compensation (Ausgleich) est basée sur la dépendance en température de la pression de vapeur de saturation en vapeur d'eau[43]. Les principaux mécanismes de transport de l'humidité sont la gravitation, la diffusion de vapeur d'eau et le transport de liquide par les forces capillaires, et, dans une moindre mesure, les effets des champs électriques et des gradients de concentration ionique.
L'absorption d'eau par la racine est possible si le potentiel hydrique Ψ de la racine est plus faible (c'est-à-dire plus négatif) que celui du sol environnant, car l'eau se déplace des endroits à fort potentiel hydrique vers des endroits à faible potentiel hydrique.
Le potentiel hydrique du sol n'est pas déterminé à partir du potentiel osmotique, car les ions sont généralement trop dilués, mais principalement à partir du potentiel capillaire (potentiel capillaire = Travail requis pour extraire une unité de masse d'eau fixée par les forces capillaires — constante de tension superficielle ou force de succion — d'une unité de masse du sol, s'exprimant en hauteur d'eau négative[44]). Plus le sol est sec, plus le potentiel hydrique baisse, c'est-à-dire que l'absorption d'eau par la racine devient plus difficile. Le potentiel hydrique du sol est typiquement compris entre Ψ = −0.01 MPa et Ψ = −1,5 MPa. Ψ = −1,5 MPa est appelé point de flétrissement permanent car la plupart des plantes ne peuvent plus extraire l'eau du sol à cette valeur [45] . Dans les sols salins, il peut être inférieur à −0,2 MPa, dans les sols secs à -2 MPa, et dans les déserts et les steppes salines il peut être beaucoup plus faible. En revanche, il peut également se situer autour de 0 après les précipitations ou à proximité des nappes phréatiques[46] - [41]:239. Le potentiel hydrique des racine peut varier considérablement selon les espèces en raison de substances osmotiquement actives[46]. Cela permet aux plantes de s'adapter à leur environnement afin de continuer à absorber l'eau. (si l'eau du sol est plus salée que la sève, le sol absorbe l'eau de plante qui se désèche). Le potentiel osmotique est basé d'une part sur les ions absorbés par le sol, en particulier les ions potassium, et d'autre part sur les composés organiques en solution dans la cellule. Le potentiel hydrique d'une racine normale est entre Ψ = −0,2 MPa et Ψ = −0,5 MPa, pour les halophytes inférieurs à -2 MPa et même en dessous de −10 MPa pour les plantes du désert[41]. Le potentiel hydrique de la sève brute est généralement compris entre −0,5 et −1,5 MPa, dans les feuilles entre −0,5 et −2,5 MPa. L'eau passe des feuilles dans l'air, car il s'y trouve un potentiel hydrique de -94 MPa à une humidité de 50%, par exemple[39]:313.
L'eau peut pénétrer dans la racine de trois façons: par l'apoplasme, par le symplasme et de manière transcellulaire (c'est-à-dire à la fois par l'apoplasme et par le symplasme)[39]. Tout d'abord, l'eau de l'apoplasme est transférée vers le symplasme. Cela entraîne une baisse du potentiel hydrique de l'apoplasme, et l'eau peut s'écouler du sol directement adjacent. Cela réduit également son potentiel hydrique; et l'eau peut s'écouler également des environs. Cependant, en raison de la conductivité limitée de l'eau du sol, ce processus est limité au maximum à quelques cm. Dès que l'approvisionnement en eau à un moment donné est épuisé, la racine suit l'eau en retrait, par la croissance, vers d'autres régions qu'elle exploite - il en va de même pour les ions. À basses températures (cela inclut des températures juste au-dessus du point de congélation dans de nombreuses espèces), la résistance au transport de l'eau dans le sol augmente, la perméabilité à l'eau de la membrane plasmique diminue et la croissance des racines diminue. À des températures inférieures à zéro, l'eau de rétention même gèle. Le manque d'eau qui en résulte, connu sous le nom de dessication par le gel (Frosttrocknis (de)), est souvent interprété à tort comme un gel[46].
Lorsque le potentiel hydrique diminue vers le cylindre central, l'eau diffuse dans cette direction. Cependant, la voie apoplasique est bloquée par la barrière de Caspary dans l'endoderme, et l'eau est forcée dans les symplastes[41]. S'il y a beaucoup d'eau et qu'aucune eau n'est éliminée par transpiration, une pression hydrostatique positive peut s'accumuler dans le cylindre central, la pression racinaire. Comme un sceau, la bande Caspary empêche la pression de s'égaliser par l'eau qui retourne dans le parenchyme de l'écorce. Alors l'eau monte. La façon exacte dont la pression racinaire est établie n'a pas encore été clarifiée ; il faut, en tout cas, de l'énergie pour la générer. Elle est probablement causée par l'incorporation active secondaire d'ions inorganiques dans les vaisseaux de guidage du xylème du parenchyme xylème. La poussée radiculaire est normalement de 0,1 MPa[41]:239, pour certaines espèces, comme la tomate, mais elles peut aussi atteindre plus de 0,6 MPa. En cas de défaut de l'approvisionnement en eau, ou de forte transpiration, il existe cependant une pression hydrostatique négative dans la zone racinaire, qui détermine principalement un potentiel hydrique négatif, et non plus osmotique[46]. Normalement, la poussée radiculaire prédomine la nuit, mais la transpiration aspire rapidement après le lever du soleil.
Les racines des plantes peuvent également absorber l'eau et les nutriments via des mycorhize des champignons symbiotiques .
Transport et livraison d'eau
Alors que la racine absorbe l'eau, le reste de la plante perd de l'eau dans son environnement par la transpiration. Cette transpiration est inévitable si la plante a un potentiel hydrique plus élevé que son environnement. La transpiration n'a pas lieu uniquement si la plante et le milieu extérieur sont en équilibre l'un avec l'autre, c'est-à-dire qu'ils ont un potentiel hydrique identique. Cela se produit à 20 °C uniquement à partir d'une humidité relative de 99 à 97,5%. Une telle humidité relative élevée est rarement atteinte, par exemple en raison d'un refroidissement nocturne, peu de temps avant d'atteindre le point de rosée. L'humidité relative est généralement de 40 à 60% pendant la journée. Si la plante n'est pas en équilibre avec son air ambiant, elle perdra définitivement de l'eau. Elle perd cela dans une faible mesure (jusqu'à 10%) via la cuticule et surtout les stomates. La perte d'eau à travers les stomates, est liée à l'absorption nécessaire de CO2 via celui-ci. Puisqu'il n'y a que quelques traces de dioxyde de carbone dans l'air (0,037%), la plante perd plusieurs centaines de molécules d'eau pour chaque molécule de CO2 qu'elle absorbe[41].
L'eau que l'épiderme perd dans l'environnement est aspiré des parties internes de la plante. Cette aspiration se poursuit à travers les conduits du xylème, jusqu'à la racine, et elle se réalise ainsi de la racine jusqu'aux extrémités des feuilles. Cet effet est appelé aspiration de la transpiration (Transpirationssog), selon la théorie de la cohésion[41]. L'aspiration de la transpiration n'est pas seule responsable du débit d'eau dans les plantes, mais elle serait suffisante en termes de force. Pour élever une colonne d'eau de dix mètres contre la gravité, une pression négative de 0,1 MPa doit être atteinte et 0,2 MPa supplémentaire sont nécessaires pour surmonter les forces de friction de l'eau dans le xylème.
La perte d'eau par transpiration conduit donc à une aspiration de la sève brute et, de là, à un écoulement d'eau de la racine à la cime, le flux de transpiration[47]. La transpiration profite à la plante de plusieurs manières: d'une part, les feuilles sont refroidies par le froid évaporatif, d'autre part, les ions (sels nutritifs dissous) sont transportés dans le xylème[41]. Cependant, les plantes n'ont montré aucun problème de croissance dans les expériences, même avec une transpiration réduite de 15 fois. Même sans transpiration, il existe un débit d'eau interne qui est tout à fait suffisant pour le transport des ions. Ceci causé par la pression racinaire, l'eau de croissance (Wachstumswasser) et le cycle interne de l'eau dans le phloème et le xylème, ainsi que la guttation dans certains cas particuliers. L'eau de croissance (Wachstumswasser) est de l'eau qui sert à augmenter le volume de la plante. Cela peut être le cas des plantes herbacées, surtout dans les phases de croissance, représentant une proportion importante (par exemple 10-20%) des eaux de transpiration. Le cycle interne de l'eau dans le phloème et le xylème est généré par l'eau dans le xylème s'écoulant vers le haut, et dans le phloème pour le transport de la sève élaborée dans la direction opposée, les deux systèmes étant inter-connectés. La transpiration n'est donc pas principalement utilisée pour le transport, mais est tout simplement inévitable, notamment en raison de l'absorption inévitable du dioxyde de carbone[46].
Cavitation de l'eau
Induits par la transpiration, la théorie de la cohésion considère que l'eau est tirée exclusivement par des gradients de pression négative de plusieurs mégapascals à travers des colonnes d'eau continues depuis les racines jusqu'au feuillage. L'eau sous de telles pressions négatives est extrêmement instable, en particulier compte tenu de l'hydrophobicité des parois internes du xylème et de la composition de la sève (lipides, protéines, mucopolysaccharides, etc.) qui empêche le développement de pressions négatives stables supérieures à environ -1 MPa[1].
Pour les plus grands arbres du monde, qui ont plus de 110 mètres (Sequoia sempervirens en Californie), 3 MPa doivent être appliqués en pression négative pour assurer l'écoulement de l'eau vers les cimes. Le problème crucial ici est la résistance à la traction de l'eau.
Si la pression négative est plus forte que le pouvoir cohésif de l'eau, l'eau se retrouve dans un état métastable et peut caviter, avec l'apparition brutale de bulles[48]. L'eau en ébullition ne s'oppose pas seulement aux forces de cohésion entre les molécules individuelles, mais également aux forces d'adhérence à la paroi du vaisseau conducteur[39].
Dans les expériences dans un tube de verre, l'eau sans gaz a résisté à des pressions allant jusqu'à −30 MPa avant de se déchirer. Dans le tissu dominant des plantes, les pressions tombent rarement en dessous de −4 MPa, mais une embolie se produit toujours en raison de la formation de bulles de gaz, parce que l'eau transportée est contaminée par des gaz et des ions dissous. Ces embolies sont un problème grave pour la plante car elles bloquent le transport de l'eau [41]:248.
La théorie de la cohésion érigée comme la vérité absolue et universelle est remise en question par certains physiologistes: la pierre d’achoppement concerne les pressions négatives importantes dans le xylème et les phénomènes de cavitation de l'eau induits, que la théorie de la cohésion implique. Il existe de nombreuses preuves que l'approvisionnement en eau du feuillage supérieur des grands arbres est réalisé par une interaction finement réglée de diverses forces agissant dans le xylème, dans les multiples phases du tissu et aux interfaces liquide/gaz. Différentes stratégies supplémentaire seraient prises par les grands arbres pour maintenir les différentes forces (y compris la tension) à des valeurs modérées (prouvées par le modèle)[1].
Voir aussi
- Bilan hydrique des plantes (de)
Liens externes
- Tötzke, Christian: Untersuchungen über den Zustand tensilen Wassers in Bäumen, Dissertation.- FU Berlin, 2008.- 177 S.
- La circulation de l'eau à travers la plante. Water movement through the plant. André Berger. Département de Physiologie Ecologique, CEPE,. CNRS. 1978
- Derek Muller. Veritasium How Trees Bend the Laws of Physics. youtube
Notes
- diffusion capillaire = mouvement d'eau à travers les interstices d'un milieu non saturé, sous l'effet exclusif ou prépondérant d'un gradient de potentiel capillaire; le potentiel capillaire = potentiel qui règle l'attraction du sol pour l'eau qu'il contient
Références
- (en) Ulrich Zimmermann, Heike Schneider, Lars H. Wegner et Axel Haase, « Water ascent in tall trees: does evolution of land plants rely on a highly metastable state? », New Phytologist, vol. 162, no 3, , p. 575–615 (ISSN 1469-8137, DOI 10.1111/j.1469-8137.2004.01083.x, lire en ligne, consulté le )
- Dictionnaire de la culture des arbres et de l'aménagement des forêts, Panckoucke, (lire en ligne)
- de Saint Yon, Recueil des édits et ordonnances concernant les eaux et forêts avec des observations, Paris, Abel Langelier,
- M. Michel Noël, Memorial alphabetique des matieres des eaux et forêts, pesches et chasses : avec les edits ordonnances, déclarations, arrests et reglemens rendus jusqu'à present sur ces matieres : ensemble les modeles des actes des grand-maistres & des autres officiers des eaux & forêts, & des instructions pour les gardes, &c, Chez T. Legras, (lire en ligne)
- Henri-Louis (1700-1782) Auteur du texte Duhamel Du Monceau, La physique des arbres, où il est traité de l'anatomie des plantes et de l'économie végétale : pour servir d'introduction au traité complet des bois et forests.... Partie 2 : par M. Duhamel Du Monceau,..., (lire en ligne)
- Revue des deux mondes, Au Bureau de la Revue des deux mondes, (lire en ligne)
- Essai de physique par mr. Pierre van Musschenbroek, professeur de philosophie & de mathématiques a Utrecht; avec une description de nouvelles sortes de machines pneumatiques, et un recueil d'experiences par mr. J.V.M. Traduit du hollandois par mr. Pierre Massuet, docteur en medicine. Tome 1. [-2.], (lire en ligne)
- Pierre Cruiziat, « Comprendre la montée de la sève dans les arbres : De Hales (1727) à Dixon (1914) », dans Histoire et agronomie : Entre ruptures et durée, IRD Éditions, coll. « Colloques et séminaires », (ISBN 978-2-7099-1764-3, lire en ligne), p. 203–214
- (en) Alice Stroup, A Company of Scientists. Botany, Patronage, and Community at the Seventeenth-Century Parisian Royal Academy of Sciences, University of California Press, (lire en ligne)
- Edme Mariotte, Essai de la végétation des plantes, (lire en ligne)
- (en) Colin Tudge, The Tree : A Natural History of What Trees Are, How They Live, and Why They Matter, Crown, , 480 p. (ISBN 978-0-307-35173-9, lire en ligne)
- Georg Andreas AGRICOLA, L'Agriculture parfaite: ou, Nouvelle découverte touchant la culture & la multiplication des arbres, des arbustes, et des fleurs. Ouvrage traduit de l'Allemand [by B. L. M.]., (lire en ligne)
- Aristide Frézard et Stanislas Frézard, Revue des eaux et forêts, Berger-Levrault, (lire en ligne)
- Karl Mägdefrau: Geschichte der Botanik. Gustav Fischer, Stuttgart 1973. S. 81–84.
- Brown S and Simcock DC, « Stephen Hales and the practice of science », Medical Physiology Online, (lire en ligne)
- Floto F. Stephen Hales and the cohesion theory. Trends Plant Sci. 1999;4(6):209.
- Dobbs, « Newton's Alchemy and His Theory of Matter », Isis, vol. 73, no 4, , p. 523 (DOI 10.1086/353114) quoting Opticks
- (en)"
 33". Page:Newton's Principia (1846).djvu. Wikisource.
33". Page:Newton's Principia (1846).djvu. Wikisource. - Derek Muller. Veritasium How Trees Bend the Laws of Physics. youtube
- Henri-Louis Duhamel du Monceau, De l'exploitation des bois, ou Moyens de tirer un parti avantageux des taillis, demi-futaies et hautes-futaies, et d'en faire une juste estimation : avec la description des arts qui se pratiquent dans les forêts : faisant partie du Traité complet des bois & des forêts, chez H. L. Guerin & L. F. Delatour, (lire en ligne)
- Karl Mägdefrau: Geschichte der Botanik. Gustav Fischer, Stuttgart 1973. S. 207f.
- (en) Henri Horatio Dixon, « Cohesion Theory of the Ascent of Sap », Proceedings of the Royal Dublin Society, Dublin, The Royal Dublin Society, vol. X,
- Dixon et Joly, « On the ascent of sap », Annals of Botany, vol. 8, , p. 468–470 (lire en ligne)
- Dixon et Joly, « On the ascent of sap », Philosophical Transactions of the Royal Society of London, Series B, vol. 186, , p. 563–576 (DOI 10.1098/rstb.1895.0012, lire en ligne
 )
) - H Dixon, Transpiration and the ascent of sap in plants, London, England, UK, Macmillan and Co., (lire en ligne)
- Catherine Lenne, « Quand les arbres se moquent de la physique », Espèces, no 41, , p. 14-21
- Neil Campbell, Biology, San Francisco, CA, Pearson Education, Inc., , 759 (ISBN 978-0-8053-6624-2, lire en ligne)
- (de) Askenasy, « Ueber das Saftsteigen », Botanisches Centralblatt, vol. 62, , p. 237–238 (lire en ligne)
- (de) Askenasy, « Ueber das Saftsteigen », Verhandlungen des Naturhistorisch-medizinischen Vereins zu Heidelberg (Proceedings of the Natural History-Medical Society at Heidelberg), 2nd series, vol. 5, , p. 325–345 (lire en ligne)
- Tyree, M.T., « The Cohesion-Tension theory of sap ascent: current controversies », Journal of Experimental Botany, vol. 48, no 10, , p. 1753–1765 (DOI 10.1093/jxb/48.10.1753, lire en ligne [archive du ]
 )
) - Wang, Z., Chang, C.-C., Hong, S.-J. et Sheng, Y.-J., « Capillary Rise in a Microchannel of Arbitrary Shape and Wettability: Hysteresis Loop », Langmuir, vol. 28, no 49, , p. 16917–16926 (PMID 23171321, DOI 10.1021/la3036242)
- Ilse Jahn (Hrsg.): Geschichte der Biologie. 3. Aufl., Sonderausgabe Nikol, Hamburg 2004, S. 511f.
- Zimmerman, « What are the driving forces for water lifting in the xylem conduit? », Physiologia Plantarum, vol. 114, no 3, , p. 327–335 (PMID 12060254, DOI 10.1034/j.1399-3054.2002.1140301.x)
- Tyree, « The cohesion-tension theory of sap ascent: current controversies », Journal of Experimental Botany, vol. 48, no 10, , p. 1753–1765 (DOI 10.1093/jxb/48.10.1753, lire en ligne
 )
) - H Dixon, The transpiration stream, London, University of London Press, Ltd, , 80 p.
- Ping Lu, Ecophysiology and responses to drought of three conifer species (Abies alba Miller, Picea abies (L.) Karsten and Pinus sylvestris L.) at seedling, sapling and adult stages : Ecophysiologie et réaction à la sécheresse de trois espèces de conifères (Abies alba Miller, Picea abies (L.) Karsten et Pinus sylvestruis L.); effet de l'âge = Ecophysiology and reactions to drought of three conifer species (Abies alba Miller, Picea abies (L.) Karsten and Pinus sylvestris L.); effects of age, Ping LU, (lire en ligne)
- André Berger, « La circulation de l'eau à travers la plante », La Houille Blanche, nos 3-4, , p. 227–233 (ISSN 0018-6368 et 1958-5551, DOI 10.1051/lhb/1978012, lire en ligne, consulté le )
- Jean Morizet, « Quelques aspects de l'absorption de l'eau par les racines », La Houille Blanche, nos 3-4, , p. 235–242 (ISSN 0018-6368 et 1958-5551, DOI 10.1051/lhb/1978013, lire en ligne, consulté le )
- (de) Peter Schopfer et Axel Brennicke (préf. Hans Mohr), Pflanzenphysiologie, München/Heidelberg, Elsevier, Spektrum, , 702 p. (ISBN 978-3-662-49880-4, lire en ligne)
- « eau capillaire », sur gdt.oqlf.gouv.qc.ca (consulté le )
- (de) Lutz Nover et Elmar W. Weiler, Allgemeine und molekulare Botanik, Georg Thieme Verlag, , 928 p. (ISBN 978-3-13-152791-2, lire en ligne)
- « diffusion capillaire », sur gdt.oqlf.gouv.qc.ca (consulté le )
- Martin Krus: Feuchtetransport- und speicherkoeffizienten poröser mineralischer Baustoffe. Theoretische Grundlagen und neue Meßtechniken. Dr.-Ing-Arbeit an der Fakultät Bauingenieur- und Vermessungswesen der Universität Stuttgart, Stuttgart 1995, pdf-Datei.
- « potentiel capillaire », sur gdt.oqlf.gouv.qc.ca (consulté le )
- Ulrich Kutschera: Kurzes Lehrbuch der Pflanzenphysiologie, Quelle & Meyer, UTB 1861, Wiesbaden 1995, S. 63
- (de) Andreas Bresinsky, Christian Körner, Joachim W. Kadereit et Gunther Neuhaus, Strasburger : Lehrbuch der Botanik, Spektrum Akademischer Verlag, , 1176 p. (ISBN 978-3-8274-1455-7, lire en ligne)
- « flux de transpiration », sur gdt.oqlf.gouv.qc.ca (consulté le )
- Laboratoire Interdisciplinaire de Physique, CNRS / Université Grenoble Alpes, « Physique de la cavitation dans les arbres. propositions de stage/thèse 2017 »
Bibliographie
- (en) Melvin T. Tyree et Martin H. Zimmermann, Xylem Structure and the Ascent of Sap, Springer Science & Business Media, , 284 p. (ISBN 978-3-662-04931-0, lire en ligne)

_mycelium_in_petri_dish_on_coffee_grounds.JPG.webp)
