Montage pour le recueil de gaz
Un montage pour le recueil de gaz, aussi souvent appelé montage par déplacement d'eau et parfois, plus simplement (et pour des raisons historiques), cuve à eau, est un dispositif de laboratoire destiné à piéger un gaz pour l'isoler et, éventuellement, mesurer facilement son volume.
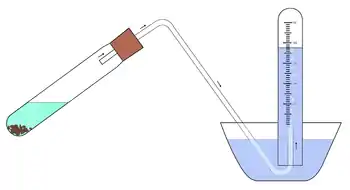
Dans le cas d'un gaz trop soluble dans l'eau, une alternative consiste à remplacer l'eau par un autre solvant ou par du mercure liquide avec les mesures de sécurité requises.
Problématique & principe
Du fait de sa nature expansive et microscopiquement désordonnée, déterminer le volume d'un gaz parmi d'autres gaz n'est pas chose aisée voire impossible si celui-ci est produit à l'air libre (système ouvert). En effet, tous les gaz se mélangent. À la rigueur, dans un système fermé, des considérations et des calculs prenant en compte la pression partielle de chacun des gaz présents pourraient apporter une réponse à cette problématique. Cependant, des mesures précises de pression sont nécessaires et n'étaient pas réalisables au début de l'étude historique de la chimie des gaz, anciennement appelée chimie pneumatique[Note 1].
C'est au XVIIIe siècle, période reconnue comme celle du développement de l'étude de la chimie des gaz[1] que les scientifiques ont résolu le problème en utilisant un montage pour le recueil de gaz.
La source de gaz est hermétiquement reliée par un tuyau flexible à un long récipient cylindrique vertical initialement rempli d'eau et retourné, en partie immergé, dans un réservoir lui aussi rempli d'eau. Le gaz produit, du fait de sa moindre densité par rapport à un liquide, est ainsi recueilli dans la partie supérieure du montage. Le volume du gaz est simplement égal à celui du volume d'eau déplacée car le gaz exerce une pression sur la colonne d'eau existante.
Historique
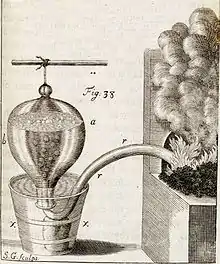
Le montage par déplacement d'eau a été mis au point en 1727 par le scientifique anglais Stephen Hales (1677-1761) pour identifier le gaz produit et déterminer son volume lors d'une réaction chimique[2] dans le cadre de ses expérimentations en physiologie végétale.
Pour proposer son montage, Stephen Hales s'est inspiré des premiers essais réalisés dans la deuxième moitié du XVIIe siècle par ses prédécesseurs en la matière : le physicien et chimiste irlandais Robert Boyle en 1659 et le scientifique anglais John Mayow en 1674 lors de leurs travaux de recherche sur les propriétés des gaz[3].
Évolution
Depuis sa conception au début du XVIIIe siècle, le montage pour le recueil de gaz a beaucoup évolué[3].
Ainsi, durant leurs travaux de recherche sur la chimie des gaz, des scientifiques comme William Brownrigg (en 1765) puis Henry Cavendish (en 1766) et enfin Joseph Priestley (en 1774) ont utilisé et perfectionné ce montage[3] - [4].
En particulier, c'est Henry Cavendish qui proposa l'utilisation du mercure liquide pour pallier la difficulté de recueillir des gaz trop solubles dans l'eau[3]. On peut ainsi donner l'exemple du chlorure d'hydrogène[Note 2].
Avec le développement de la chimie industrielle au XIXe siècle, le montage pour le recueil de gaz est devenu d'usage courant dans les laboratoires. Il est d'ailleurs, dès lors, souvent associé à d'autres équipements pour constituer les premières unités de production industrielle de gaz, souvent le dioxygène et le dihydrogène[5].
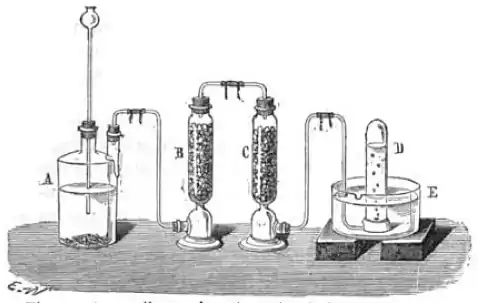
De nos jours, en laboratoire, on utilise de la verrerie dédiée afin de constituer un montage pour le recueil de gaz : flacon ou erlenmeyer, cristallisoir, tube à dégagement et éprouvette graduée ou eudiomètre.
Dans une perspective ludique et spectaculaire, le principe du montage pour le recueil de gaz est à rapprocher de celui d'une fusée à eau, aussi appelée plus techniquement fusée hydropneumatique.
Notes et références
Notes
- L'expression chimie pneumatique est cependant encore, de nos jours, très courante dans la littérature scientifique anglophone.
- À titre de comparaison, les solubilités dans l'eau (à 20 °C, sous 1 atm) du chlorure d’hydrogène, du dioxygène et du dihydrogène sont respectivement de 720 g.L−1, 9 mg.L−1 et 1,6 mg.L−1. Dans ces conditions, le chlorure d’hydrogène est donc environ 80 000 fois plus soluble que le dioxygène et environ 450 000 fois plus soluble que le dihydrogène !
Références
- (en) « Gases, God and the balance of nature : A commentary on Priestley (1772) "Observations on different kinds of air". » [« Les gaz, Dieu et l’équilibre de la nature : un commentaire des « Observations sur différents types d’air » de Priestley (1772). »] (Article d'histoire des sciences à portée philosophique.), Philosophical Transactions of the Royal Society A: Mathematical, Physical and Engineering Sciences (Phil. Trans. R. Soc. A), Londres, Royal Society, vol. 373, no 2039, (ISSN 1364-503X, e-ISSN 1471-2962, OCLC 34435526, PMID 25750146, PMCID PMC4360083, DOI 10.1098/rsta.2014.0229, lire en ligne, consulté le ).
- Didier Perret (Docteur ès Sciences, Section de chimie et biochimie, Université de Genève), « Pourquoi utilise-t-on la méthode du déplacement d'eau ? », Site RTS Découverte de questions-réponses scientifiques., sur RTS.ch, Genève & Lausanne, RTS (Radio Télévision Suisse), (consulté le ).
- (en) University of Cincinnati Libraries (Bibliothèques de l'Université de Cincinnati), « Evolution of the Pneumatic Trough : The Oesper Collections in the History of Chemistry » [« Evolution du montage pour le recueil de gaz (Collections Oesper d'Histoire de la Chimie) »], Site de promotion des collections historiques de la bibliothèque de Chimie-Biologie Oesper de l'Université de Cincinnati, sur digital.libraries.uc.edu, Cincinnati (Ohio, États-Unis), Université de Cincinnati, (consulté le ).
- (en) Joseph Stewart Fruton, Methods and Styles in the Development of Chemistry [« Méthodes and Variantes dans le Développement de la Chimie »], Philadelphie (États-Unis), American Philosophical Society, , XVIII-332 p., 23 × 15 cm, relié (ISBN 0-87169-245-7, ASIN 0871692457, Methods and Styles in the Development of Chemistry sur Google Livres), chap. 2 (« Chemical Composition and Phlogiston »), p. 20-29.
- Charles Louis Barreswil (co-auteur principal), Aimé Girard (co-auteur principal), M . de Luca, A.-J. Balard, H. Sainte-Claire Deville, L. A. Davanne et al., Dictionnaire de Chimie industrielle, vol. 1 : Introduction au Dictionnaire de Chimie industrielle (Traité de chimie industrielle du milieu du XIXe siècle), Paris, Dezobry, Magdeleine & Cie (Editeurs & Libraires), , VIII-512 p., In-8, relié (ISBN 1-272-94785-8, BNF 30509371, ASIN B0000DPK0E, Introduction au Dictionnaire de Chimie industrielle sur Google Livres), chap. VI (« Métalloïdes et leurs combinaisons »), p. 81-87.
Voir aussi
- (en) Joseph Priestley, « Observations on different kinds of air. » [« Observations sur différents types d’air »], Philosophical Transactions (Philos. Trans. R. Soc.), Londres, Royal Society, vol. 62, , article no 19 (ISSN 0261-0523, e-ISSN 2053-9223, OCLC 1697286, DOI 10.1098/rstl.1772.0021, résumé, lire en ligne [[PDF]], consulté le ).
- (en) John Parascandola et Aaron J. Ihde, « History of the Pneumatic Trough » [« Histoire du Montage pour le recueil de gaz »], Isis, Chicago (États-Unis), The University of Chicago Press, vol. 60, no 3, , p. 351-361 (ISSN 0021-1753, e-ISSN 1545-6994, OCLC 1638942, DOI 10.1086/350503, JSTOR 229488, résumé).