Stockage océanique du dioxyde de carbone
Le stockage océanique du dioxyde de carbone (CO2) est une méthode de séquestration du carbone. Le concept de stockage du dioxyde de carbone dans l'océan a été proposé pour la première fois par le physicien italien Cesare Marchetti dans son article de 1976, « On Geoengineering and the carbon dioxide problem » [Sur la géoingénierie et le problème du dioxyde de carbone][1]. Depuis lors, le concept de séquestration du dioxyde de carbone atmosphérique dans les océans du monde a été étudié par des scientifiques, des ingénieurs et des militants écologistes. Actuellement, 39 000 gigatonnes de carbone (GtC) résident dans les océans alors que seulement 750 GtC se trouvent dans l'atmosphère[2] - [3].
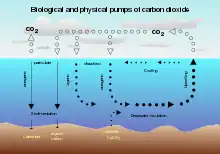
Sur les 1 300 Gt de dioxyde de carbone d'origine anthropique au cours des 200 dernières années, environ 38 % sont déjà dans les océans[3]. Actuellement, 10 GtC de CO2 sont émises par an et les océans en absorbent actuellement 2,4 Gt. Les océans se trouvent être un énorme puits de carbone ayant la capacité d'en contenir des milliers de gigatonnes supplémentaires. Selon certains scientifiques, la séquestration océanique a le potentiel de réduire les concentrations atmosphériques de dioxyde de carbone.
Chimie océanique
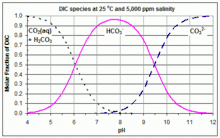
Quand le dioxyde de carbone atmosphérique se dissout dans l'océan, une partie du dioxyde de carbone réagit avec l'eau de mer pour former de l'acide carbonique (H2CO3)[4]. Celui-ci continue réagir avec les molécules d'eau, en résulte du carbonate qui augmente la concentration d'ions hydrogène dans l'océan et, par conséquent, réduit le pH de l'océan. Par conséquent, l'augmentation de la concentration en dioxyde de carbone dans l'atmosphère agit contre l'acidification de l'océan[5]. Par ailleurs, le carbonate de calcium produit un effet tampon lors de fortes baisses de pH. Lorsque le pH diminue, la dissolution du carbonate de calcium augmente[6]. Le GIEC prône une variation du pH de l'océan de 0,1 comme acceptable, comparable aux fluctuations naturelles du pH sans effets environnementaux notables. Avec un changement de pH de 0,1, le GIEC estime que 1 000 GtC atmosphériques pourraient être stockés dans l'océan et diminuer d'autant les effets environnementaux négatifs[5]. Si le dioxyde de carbone restait dans l'atmosphère, le changement résultant du pH de l'océan serait également similaire, car le mélange océanique finirait par en absorber l'excès[5].
Injection et stockage de dioxyde de carbone dilué
L'injection de CO2 dilué se fait à des profondeurs où ce composé peut être dispersé par les courants marins et le mélange océanique. Lors de l'injection, l'interaction des eaux et les mélanges en fonction de la densité, réduisent la concentration de dioxyde de carbone[5]. L'injection par bateau consiste en un déversement de faibles concentrations de CO2 dans les eaux libres tout en en augmentant la zone de dispersion. La dispersion par bateau peut également se faire au moyen d'un tuyau transportant un mélange dilué dans la colonne d'eau. Le composé est généralement injecté à 1 000 m de profondeur pour réduire l'échappement par des bulles. La dispersion augmente dans la colonne d'eau, tout au long de la remontée des bulles[7]. Les grandes tailles des aires de dispersion et les faibles concentrations du composé prémunissent de tout changement significatif du pH local et les effets qui en résultent sur les écosystèmes marins[7]. Wickett et al. ont utilisé des mesures des fluctuations naturelles du pH du dioxyde de carbone atmosphérique pour suggérer qu'une injection de dioxyde de carbone dilué à 0,37 GtC par an aurait un effet négligeable sur le pH de l'océan[5]. L'injection océanique diluée nécessite peu d'infrastructures par rapport aux autres formes d'injection océanique[5]. Le programme de R&D sur les gaz à effet de serre de l'Agence internationale de l'énergie estime le coût l'injection d'une tonne de dioxyde de carbone dilué à 70 $, en tenant compte des coûts de capture, de transport et de stockage du carbone avant sa dispersion par bateau[8].
Libération de dioxyde de carbone solide en profondeur
Les carboglaces, glaces sèches ou hydrates solides de CO2 peuvent être des vecteurs du stockage du dioxyde de carbone dans l'océan. Leur densité à l'état solide est environ 1,5 fois supérieure à celle de l'eau de mer ce qui leur permet de couler au fond de l'océan. Leur vitesse de dissolution à la surface est d'environ 0,2 cm/h, ce qui fait que seule une petite quantité de dioxyde de carbone peut être complètement dissoute avant d'atteindre le fond marin[5]. En plus de servir de matière carbonée à injecter en profondeur, l'hydrate de CO2 est déjà, en tant que tel, un moyen de stockage du carbone[9]. Sa formation a lieu lorsque la concentration dissoute de dioxyde de carbone liquide est d'environ 30 % et que la profondeur est de 400 mètres sous le niveau de la mer. Les hydrates se forment sous forme de couche externe autour des gouttelettes de dioxyde de carbone liquide ou sous forme de masse solide[10]. La composition moléculaire est composée de dioxyde de carbone et d'eau, formulé CO2•nH2O où n ≈ 5,75[5]. La densité résultante est plus dense que l'eau de mer d'environ 10 %. Par rapport au dioxyde de carbone liquide, la forme hydratée se dissout beaucoup plus lentement dans l'eau de mer, à environ 0,2 cm/h aussi[10]. De plus, l'hydrate stagne sur le fond marin, forme une calotte d'hydrate, et force le dioxyde de carbone liquide à ne se déplacer que latéralement[11]. La stabilité moléculaire globale a pour paramètre la température et de la pression de l'environnement, et les glaces sèches ne se dissocient que lorsqu'elles rentrent en contact direct avec de la chaleur et de l'eau supplémentaires à des concentrations inférieures à leur concentration d'équilibre[12]. Cependant, en raison de sa structure cristalline, l'hydrate pur ne circule pas dans les tuyaux. Partant du constat qu'une efficacité de 100 % est extrêmement difficile à atteindre, les expériences en laboratoire et sur le terrain suggèrent celle de la réaction de descente est d'environ 15 à 25 %[5]. N'importe quel type d'instabilité des hydrates est susceptible de provoquer une dissolution et une dispersion lors du processus de descente ou d'injection[11].
Minéralisation et sédiments marins profonds
La minéralisation peut également se produire sous la mer de façon semblable aux processus se déroulant dans les roches terrestres. Le taux de dissolution du CO2 atmosphèrique vers les régions océaniques dépend de la période de circulation de l'océan et de la capacité tampon de la subduction des eaux de surface[12]. Des recherches ont démontré que le stockage marin de dioxyde de carbone à plusieurs kilomètres de profondeur pourrait être viable pendant une période allant jusqu'à 500 ans selon les conditions et le site d'injection. Plusieurs études ont montré que bien que le dioxyde de carbone se stocke dans l'océan, il peut retourner dans l'atmosphère au fil du temps. Cependant, la longueur du processus est probablement de l'ordre de quelques siècles. La neutralisation du CaCO3 (carbonate de calcium), ou l'équilibrage de sa concentration sur le fond marin, sur terre et dans l'océan, peut être mesurée sur une échelle de temps de plusieurs milliers d'années. Plus précisément, le temps prévu est de 1700 ans pour l'océan et d'environ 5000 à 6000 ans pour la terre[13] - [14]. De plus, le temps de dissolution du CaCO3 peut être amélioré en injectant à proximité ou en aval du site de stockage[5].
Outre la minéralisation du carbone, l'injection profonde de sédiments en mer est une piste prometteuse pour le stockage océanique du dioxyde de carbone. Elle consiste à l'injecter à au moins 3 000 m de profondeur, directement dans les sédiments océaniques pour générer des hydrates de CO2. Deux couches océaniques sont choisies pour l'exploration du procédé : la zone de flottabilité négative, ZFN ((en) NBZ), où le dioxyde de carbone liquide est plus dense que l'eau environnante ou a une flottabilité neutre, et la zone de formation d'hydrates, ZFH ((en) HFZ), qui a généralement des températures basses et hautes pressions. Plusieurs modèles de recherche ont montré que la profondeur d'injection optimale pour un stockage optimal nécessite la prise en compte de la perméabilité intrinsèque et des modifications de la perméabilité au dioxyde de carbone liquide. La formation d'hydrates diminue la perméabilité au CO2 liquide et l'injection en dessous plutôt que dans la zone de formation d'hydrates, est préférée. Si la zone de flottabilité négative constitue une plus grande colonne d'eau que la ZFH, l'injection doit se faire directement dedans, sous la ZFH. Dans ce cas, le CO2 liquide coulera dans la ZFN et sera stocké sous le plafond de flottabilité et d'hydrate. Une fuite de dioxyde de carbone peut se produire en cas de dissolution dans le fluide interstitiel ou par diffusion moléculaire. Cependant, ce processus pourrait prendre des milliers d'années[5] - [15] - [16].
Panaches de dioxyde de carbone
Les chercheurs ont pu montrer en laboratoire et dans de petites expériences in situ que le dioxyde de carbone peut être injecté dans les océans sous forme de panaches ascendants ou descendants[5]. Le panache coulera s'il est plus dense que l'eau de mer. Cela doit se produire si le panache, un mélange de dioxyde de carbone et d'eau de mer, est injecté à des profondeurs de 3 km[5]. Au fur et à mesure que le panache se déplace sur l'axe verticale, il se dissout partiellement par transfert de masse convectif avec l'eau avoisinante. La dissolution est stimulée par les courants perpendiculaires à la colonne d'eau du panache en raison de l'accroissement du transfert de masse par convection. Un minimum de courants d'eau horizontaux est nécessaire pour que le panache puisse plonger au fond de l'océan, ce qui assure une séquestration à plus long terme. Les autres techniques de stockage océaniques mentionnées précédemment profitent de ces courants pour la dilution des panaches ascendants : ils accélèrent la dispersion pour rendre le changement de concentration de CO2 dans l'océan suffisamment bas pour ne pas affecter de manière significative la biosphère marine[17].
La méthode d'injection proposée emploie des gouttelettes de dioxyde de carbone supercritique mélangées à de l'eau de mer. Les panaches peuvent être conçus pour se dissoudre à différentes vitesses en fonction de la taille, de la concentration et de la vitesse d'injection du mélange. Pour les panaches ascendants dont le but est la dissolution pour séquestrer le CO2, une gouttelette plus petite, injectée à plus forte concentration, est préférable pour une dissolution plus rapide. Les panaches qui coulent finissent par former des lacs de dioxyde de carbone sur le fond océanique permettant une séquestration à plus long terme[5].
Lacs de dioxyde de carbone
Des lacs de dioxyde de carbone se formeront sur le plancher océanique dans les dépressions ou des tranchées du fond marin. Ces lacs séquestrent le dioxyde de carbone en l'isolant. L'océan profond a un taux de mélange très lent avec les couches de la surface. De plus, à la surface du lac de CO2, se formera une couche de cristaux d'hydrates de confinement qui ralentira les échanges avec la couche du dessus. La convection à la surface du lac due aux tempêtes du fond de l'océan ou à d'autres courants marins accélèrera la dissolution. Si aucun écoulement massif ne perturbe les lacs de séquestration, la durée de stockage du dioxyde de carbone prend environ 10 000 ans pour un lac de 50 m de profondeur. Ce chiffre peut être réduit à 400 ans en présence de courants dus aux tempêtes de fond océanique[5].
Les sites d'injection seront choisis en fonction de la profondeur du plancher océanique, de l'activité sismique et volcanique et de la présence de gisements de CaCO3 susceptibles d'augmenter le taux de minéralisation du carbone[18]. Certains sites à l'étude pour le stockage à des profondeurs supérieures à 6 km et comprennent la fosse indonésienne de Sunda, la fosse japonaise des Ryukyu et la fosse de Porto Rico[12].
Impacts environnementaux de la séquestration des océans en eaux profondes
Les chercheurs étudient l'impact sur les écosystèmes de l'injection de dioxyde de carbone liquide, par le biais « d'études de processus, d'enquêtes sur les traceurs biogéochimiques et d'études sur le fond des océans »[19]. Le défi provient de la portée spatiale de l'océan et de la grande échelle de temps des effets possibles[20], ce qui rend difficile la détection précise de ces conséquences. Il existe très peu de connaissances sur les organismes et les écosystèmes de cette zone inexplorée et sur l'interdépendance de ces écosystèmes[20]. La séquestration en haute mer par injection diluée, peut avoir recours à des méthodes alternatives (injection par pipeline remorqué, injection par pipeline fixe, utilisation d'hydrates). En raison de la taille de l'océan, les prédictions et les conclusions concernant le risque environnemental de ce processus de séquestration sont basées sur des expériences à petite échelle qui ont été extrapolées pour montrer des résultats possibles à une échelle aussi grande que l'océan[19].
Biote des grands fonds
La séquestration océanique dans les sédiments des profondeurs marines peut avoir un impact sur la vie marine profonde. La composition chimique et physique de la mer profonde ne subit pas de changements comme les eaux de surface[19]. En raison de son contact limité avec l'atmosphère, la plupart des organismes qu'elle héberge ont évolué avec très peu de perturbations physiques et chimiques et sont exposés à des niveaux minimes de dioxyde de carbone[19]. La plus grande part de leur énergie provient de la consommation des fragments de matière descendant de l'eau de surface et de ses écosystèmes[19]. Les écosystèmes des grands fonds marins n'ont pas de taux de reproduction rapides et ne donnent pas naissance à de nombreux descendants en raison de leur accès limité à l'oxygène et aux nutriments[19]. En particulier, les espèces qui habitent la gamme de profondeur de 2 000–3 000 m sont des populations peu nombreuses, et variées[19]. L'introduction de quantités mortelles de dioxyde de carbone dans l'environnement de telles espèces peut avoir des conséquences sérieuses sur la taille de ces populations qui prendront plus de temps pour se reconstituer que les espèces des eaux de surface[21].
Effets du pH et exposition au dioxyde de carbone
L'acidification des océans affaiblit les processus métaboliques dans les organismes ; les enzymes et le transport des ions nécessitent des niveaux de pH spécifiques pour continuer à fonctionner correctement[19]. Cependant, les organismes ne sont pas seulement affectés par l'acidification de l'eau due à des niveaux élevés de CO2, le composé lui-même interagit avec la fonction physiologique des organismes individuels[19]. Les effets de l'exposition au CO2 sont d'ailleurs plus dommageables que ceux provenant des changements de pH de l'environnement[22]. Lorsqu'il pénètre dans les organismes, par diffusion à travers les tissus, il s'accumule à l'intérieur, ce qui peut alors provoquer une anesthésie et, selon sa concentration, la mort[23]. L'accumulation interne provoquera également une acidification du sang des organismes. Cela affaiblit la capacité des ceux-ci à métaboliser l'oxygène et par conséquent affaiblit leurs performances[19]. Cet effet est plus préjudiciable aux espèces plus complexes et plus grandes qui mettent en action un plus grande énergie pour se déplacer et faire fonctionner leurs fonctions corporelles vitales[19].
Effets à long terme
Si la séquestration du dioxyde de carbone des eaux profondes océaniques devient une pratique courante, les effets à long terme continueront d'être étudiés pour en prédire l'impacts sur ces milieux[21]. Le procédé aurait non seulement un impact sur les écosystèmes des grands fonds marins, mais à long terme commencerait à affecter les espèces des eaux de surface[21]. On estime que les organismes non adaptés à des niveaux élevés de dioxyde de carbone commenceront à ressentir des effets permanents à des niveaux de 400 / 500 ppm de CO2 et/ou des changements de 0,1 à 0,3 unités de pH[19]. Ces niveaux devraient être atteints de toute façon à cause du dioxyde de carbone atmosphérique acidifiant les eaux de surface en moins d'un siècle, hors stockage des océans[19].
Bien que les effets à long terme soient les plus utiles à connaitre, ils sont également les plus difficiles à cerner avec précision en raison de la taille de l'océan et de la diversité de sensibilité des espèces aux niveaux élevés de dioxyde de carbone. Les organismes marins de surface ont été mieux étudiés que ceux des grands fonds quant aux conséquences d'une exposition prolongée au dioxyde de carbone et il a été prouvé qu'ils montrent une « calcification réduite » et des dommages à leur squelette[19]. Cela a une incidence effective sur la mortalité et le taux de croissance des animaux à coques[19]. Les poissons adultes ont montré une tolérance remarquable aux niveaux élevés de dioxyde de carbone, uniquement dans le cas où la dissolution du dioxyde de carbone se produit à un rythme lent[21]. Les poissons juvéniles ont montré moins de tolérance que les adultes[21]. L'acidification du sang chez ces espèces entraîne également des taux métaboliques plus bas qui retardent la formation de protéines et entravent ainsi leur croissance et leur reproduction[19]. Bien que les effets physiologiques soient isolément connus, des études sur le terrain devraient être menées afin de comprendre comment ces espèces individuelles sont interconnectées et dépendantes les unes des autres. Différentes quantités et concentrations de CO2 séquestré affecteront différemment chaque écosystème et chaque espèce, de sorte qu'il n'existe pas de limite générale et universelle de dioxyde de carbone à séquestrer[19].
Les firmes, comme ExxonMobil, soutenant la séquestration dans les océans[24], affirment que de telles prédictions instillent le doute dans les conclusions de la recherche. Les partisans du procédé soutiennent qu'en raison de la taille de l'océan, les injections de CO2 dilué ne suffiront pas à générer un impact réel sur les écosystèmes et que les espèces peuvent éventuellement évoluer vers ces niveaux accrus du composé[19]. Lestudes scientifiques montrent que les sites d'injection sont localement spécifiques et que les écosystèmes qui s'y trouvent peuvent subir des conséquences immédiates[22]. Les zones touchées connaîtraient une acidification, en raison de l'augmentation des niveaux de bicarbonate, puis à son tour une diminution des niveaux de carbonate de calcium[22]. Cela entraînera une dissolution plus rapide des sédiments et des coquilles d'organismes[19]. La capacité des organismes des profondeurs marines à s'acclimater à l'injection de dioxyde de carbone n'a pas été étudiée et l'hypothèse selon laquelle ils évolueront dans le temps n'est pas vérifiée[19].
Méthodes à impact minimal
L'utilisation de clathrates hydratés peut être mise en œuvre afin de ralentir la dissolution du dioxyde de carbone[25] - [20]. Les hydrates lui donnent une flottabilité négative, permettant à l'injection de se produire depuis la surface plutôt que par des pipelines[21]. Des expériences ont montré que l'utilisation d'hydrates de clathrate réduisait la propagation du CO2 injecté dans le fond de l'océan[21]. De ce fait, elle minimise l'impact sur les organismes des grands fonds[25]. L'intégrité des hydrates dépend fortement de l'amplitude du courant océanique au site d'injection[20]. Une partie du dioxyde de carbone se dissous dans les eaux de surface avant que l'hydrate ne puisse couler dans l'océan profond (10 % à 55 % du dioxyde de carbone est resté collé à l'hydrate à des profondeurs de 1 500 m dans l'océan)[25]. Dans les expériences de laboratoire, des flux continus d'hydrates n'ont pas encore été obtenus[21].
La recherche montre que la livraison de CO2 liquide par un pipeline remorqué (amarré à un bateau se déplaçant perpendiculairement au courant) peut limiter les « agrégats » très concentrés. L'injection par un tuyau fixe serait dirigée vers une zone océanique précise où elle détruirait rapidement les espèces sensibles. Théoriquement, si l'on suppose que les émissions anthropiques à venir de CO2 chutent drastiquement et que seulement 0,37 Gt sont injectées chaque année par un tuyau remorqué, seul 1 % de l'océan sera affecté. Il existe un consensus parmi les scientifiques sur le fait que la séquestration océanique du dioxyde de carbone n'est pas une solution à long terme sur laquelle on peut compter, mais si elle n'est mise en œuvre que temporairement, elle peut résoudre des problèmes atmosphériques immédiats. Les scientifiques pensent qu'il est possible de concevoir des moyens de rejeter le dioxyde de carbone à des taux qui ressemblent aux fluctuations naturelles du composé dans les océans[21].
Captage du carbone bleu dans l'océan
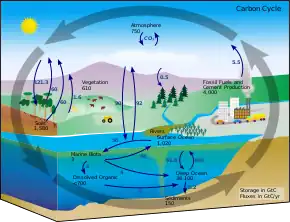
Le stockage océanique fait référence à l'utilisation de grandes masses d'eau et de formes de vie marines pour capturer le carbone en exploitant des mécanismes naturels et géologiques. Les océans couvrant un peu plus de 70 % de la surface totale de la Terre, jouent un rôle majeur dans la stabilisation du climat terrestre[26]. Il constitue un puits de carbone facilement utilisable pour stocker et capturer le dioxyde de carbone atmosphérique. En raison de sa solubilité dans l'eau, le CO2 se dissout naturellement dans les eaux océaniques pour former un équilibre chimique. Avec une augmentation de la concentration du composé dans l'atmosphère, la position d'équilibre pousse le processus à en dissoudre plus dans l'eau. Ce mécanisme a entrainé l'absorption naturelle par les océans de plus de 500 Gtonnes de dioxyde de carbone (pour un total de 140 Gt de carbone) émises au cours des deux derniers siècles[26]. Avec l'augmentation des concentrations atmosphériques en CO2 d'origine humaine par rapport aux niveaux d'avant l'industrialisation, les océans en absorbent actuellement 7 Gtonnes par an[5]. Pour améliorer ce mécanisme naturel, plusieurs méthodes ont été proposées par la communauté scientifique. Parmi celles-ci, on remarque la méthode de la fertilisation par le fer, de la fertilisation par l'urée, des couches de mélange, des algues[27] - [28] - [29], ainsi que l'injection directe de carbone sur le fond marin.
Fertilisation par le fer
Rôle du fer dans la séquestration du carbone
La fertilisation par le fer des océans est un exemple de technique de géo-ingénierie qui consiste à introduire intentionnellement des dépôts riches en fer dans les océans et vise à améliorer la productivité biologique des organismes dans les eaux océaniques afin d'augmenter l'absorption de dioxyde de carbone atmosphèrique, éventuellement ce qui atténue ses effets sur le réchauffement climatique[30] - [31] - [32] - [33]. Le fer est un oligo-élément dans l'océan et sa présence est vitale pour la photosynthèse des plantes, et en particulier du phytoplancton, car il a été démontré qu'une carence en fer peut limiter la productivité des océans et la croissance du phytoplancton[34]. Pour cette raison, « l'hypothèse du fer » qui a été mise en avant par l'océanographe John Martin à la fin des années 1980, suggère que des changements dans l'approvisionnement en fer dans une eau de mer pauvre en fer favorise la croissance du plancton et a un effet significatif sur la concentration de dioxyde de carbone atmosphérique en modifiant les taux de séquestration du carbone[35] - [34]. En fait, la fertilisation est un processus important qui se produit naturellement dans les eaux océaniques, telles les remontées d'eau des courants océaniques peuvant amener à la surface des sédiments riches en nutriments[36]. Un autre exemple est le transfert de minéraux riches en fer, de poussière et de cendres volcaniques sur de longues distances par les rivières, les glaciers ou le vent[37] - [38]. De plus, il a été suggéré que les baleines transfèrent de la poussière océanique riche en fer vers la surface, que les planctons peuvent métaboliser pour leur développement. La démonstration est établie que la réduction du nombre de cachalots dans l'océan Austral a entraîné une diminution de 200 000 tonnes/an d'absorption de carbone atmosphérique, probablement en raison d'une croissance limitée du phytoplancton[39].
Séquestration du carbone par le phytoplancton

Le phytoplancton, qui est photosynthétique, a besoin de lumière solaire et de nutriments pour se développer et absorber du CO2. Le plancton peut séquestrer le carbone atmosphérique en construisant des squelettes de calcium ou de carbonate de silicium. Lorsque ces organismes meurent et coulent au fond de l'océan, leurs squelettes carbonatés peuvent constituer une composante majeure des « précipitations » connues sous le nom de neige marine, à des milliers de mètres sous les efflorescences planctoniques[40] - [41] - [42]. Sur la base de la définition, le carbone n'est considéré comme « séquestré » que lorsqu'il est déposé au fond de l'océan où il peut être retenu pendant des millions d'années. Cependant, la majeure partie de la biomasse riche en carbone provenant du plancton est généralement consommée par d'autres organismes (petits poissons, zooplancton, etc.)[43] - [44] et une partie conséquente du reste des dépôts tombant sous les efflorescences planctoniques peut être re-dissous dans l'eau et transféré à la surface où il retourne finalement dans l'atmosphère, annulant ainsi tout effet de stockage du carbone[45] - [46] - [47] - [48] - [49]. Néanmoins, les partisans de l'idée de la fertilisation ferreuse pensent que la séquestration du carbone devrait être redéfinie sur des périodes beaucoup plus courtes et affirment que puisque le carbone est en suspension dans les profondeurs de l'océan, il est effectivement isolé de l'atmosphère pendant des centaines d'années, et donc peut être efficacement séquestré[50].
Efficacité et obstacles
En supposant des conditions idéales, les estimations supérieures des effets possibles de la fertilisation ferreuse sur le ralentissement du réchauffement climatique sont d'environ 0,3 W/m2 de baisse moyenne, ce qui peut compenser environ 15 à 20 % de l'apport anthropique actuel des émissions de CO2[51] - [52] - [53]. Cependant, bien que cette approche puisse être considérée comme une alternative aisée pour résoudre la crise des émissions de carbone et réduire la concentration de dioxyde de carbone dans l'atmosphère, la fertilisation en fer des océans ne fait pas consensus et reste très débattue en raison de possibles conséquences négatives sur l'écosystème marin[46] - [54] - [55] - [56]. La recherche dans ce domaine a suggéré que la fertilisation par le dépôt de grandes quantités de poussière riche en fer dans le fond de l'océan peut perturber considérablement l'équilibre nutritif de celui-ci et entraîner des complications majeures dans la cycle alimentaire d'autres organismes marins[30] - [57] - [58] - [59] - [60] - [61] - [62]. Depuis 1990, treize expériences majeures à grande échelle ont été menées pour évaluer l'efficacité et les conséquences possibles de la fertilisation par le fer dans les eaux océaniques. Une recherche récente menée sur ces expériences a déterminé que la méthode n'a pas fait ses preuves ; l'efficacité de séquestration est faible et parfois aucun effet n'a été observé et la quantité de gisements de fer nécessaire pour réduire légèrement les émissions de carbone se chiffre en millions de tonnes par an[63].
Fertilisation par l'urée

Dans les eaux avec suffisamment de micronutriments de fer, mais un déficit d'azote, la fertilisation à l'urée est un choix stratégique pour la croissance des algues[65]. L'urée est l'engrais le plus utilisé au monde, en raison de sa forte teneur en azote, de son faible coût et de sa grande réactivité vis-à-vis de l'eau[22]. Lorsqu'elle est exposée aux eaux océaniques, l'urée est métabolisée par le phytoplancton via des enzymes uréases pour produire de l'ammoniac[66].
NH2COOH + H2O ⟶ NH3+ H2CO3
Le produit intermédiaire, carbamate, réagit également avec l'eau pour produire un total de deux molécules d'ammoniac[23]. En 2007, la Ocean Nourishment Corporation of Sydney a lancé une expérience dans la mer de Sulu (sud-ouest des Philippines), où 1 000 tonnes d'urée ont été injectées dans l'océan[22]. L'objectif était de prouver que la fertilisation à l'urée favoriserait la croissance des algues dans l'océan et capterait ainsi le CO2 de l'atmosphère. Ce projet a été critiqué par de nombreuses institutions, comme la Commission européenne[67] ou le WWF[68], en raison de la méconnaissance des effets secondaires sur l'écosystème marin[64]. Les résultats de ce projet doivent encore être publiés. La quantité d'urée nécessaire pour capturer la même quantité de carbone que la fertilisation par le fer est une autre source de préoccupation. En effet, le rapport de quantité azote/fer dans une cellule d'algue typique est de 16/0,0001, signifiant que pour chaque atome de fer ajouté à l'océan, une quantité de carbone beaucoup plus importante est capturée, ce qui est loin d'être le cas avec l'ajout d'un atome d'azote[5]. Les scientifiques soulignent également que l'injection d'urée aux eaux océaniques pourrait réduire la teneur en oxygène et entraîner une augmentation des algues marines toxiques[5]. Cela pourrait potentiellement avoir des effets dévastateurs sur les populations de poissons, qui, selon certains scientifiques, bénéficieraient de la fertilisation à l'urée (l'argument étant que les populations de poissons se nourriraient de phytoplancton sain)[69].
Fertilisation par les algues
Pour lutter contre le réchauffement climatique, la mise en culture d'algues est à la fois possible et plausible. Cette méthode a été mise en œuvre dès les premières propositions pour atténuer le réchauffement climatique par les algues océaniques. Cela implique le développement de fermes commerciales de varech conçues pour occuper des dizaines de milliers de kilomètres carrés de l'océan ouvert[70]. Grâce à cette pratique, les lits d'algues deviendront comme des puits efficaces en diminuant le niveau de carbone inorganique dissous (CID) dans l'océan.
Les algues capturent le carbone par le processus de photosynthèse, en absorbant l'excès de dioxyde de carbone et en produisant du dioxygène (O2). Les faits et les études ont montré que 700 000 tonnes de carbone sont retirées de la mer chaque année par le commerce des algues[71]. Même si la biomasse des algues est faible par rapport à la région côtière, elles restent essentielles en raison de leurs composants biotiques, des services écosystémiques précieux qu'elles permettent et d'une productivité primaire élevée. Les algues diffèrent des mangroves et des herbiers, car ces derniers ne sont pas photosynthétiques et ne fleurissent pas. Même ainsi, ce sont des producteurs primaires qui se développent de la même manière que leurs homologues terrestres, assimilant tous deux le carbone par le processus de photosynthèse et générant une nouvelle biomasse en absorbant le phosphore, l'azote et d'autres minéraux.
L'attractivité de la culture d'algues à grande échelle a été démontrée au fil des années, grâce notamment à la mise en œuvre par des technologies à faible coût et les multiples utilisations possibles de ses produits. En 2018, la culture des algues représentait environ 25 % de la production aquacole mondiale et son potentiel maximal n'a pas été atteint[72].
Actuellement dans le monde, les algues contribuent à environ 16 à 18,7 % du puits total de végétation marine. En 2010, il y avait 19,2 × 10 × 106 tonnes de plantes aquatiques dans le monde, 6,8 × 10 × 106 tonnes pour les algues brunes ; 9,0 × 10 × 106 tonnes pour les algues rouges ; 0,2 × 10 × 106 tonnes d'algues vertes ; et 3,2 × 10 × 106 tonnes de plantes aquatiques diverses. Les algues sont en grande partie transportées des zones côtières vers l'océan ouvert et profond, agissant comme un stockage permanent de la biomasse de carbone dans les sédiments marins[29].
Mélange de couches
Les mélanges de couches consiste à transporter de l'eau océanique profonde plus dense et plus froide vers la couche de mélange de surface. À mesure que la température de l'eau dans l'océan diminue avec la profondeur, davantage de CO2 et d'autres composés peuvent se dissoudre dans les couches plus profondes[73]. Cela peut être induit volontairement en inversant le cycle du carbone océanique grâce à des grands tuyaux verticaux servant de pompes océaniques[74] ou d'un réseau de mélangeurs[75]. Si l'eau de l'océan profond riche en nutriments remonte vers la surface, une prolifération d'algues (appelée efflorescence algale) se produit, entraînant une diminution du dioxyde de carbone grâce à de l'apport de carbone du phytoplancton et d'autres organismes eucaryotes photosynthétiques. Le transfert de chaleur entre les couches fera également couler l'eau de mer de la couche mélangée et absorbera plus de CO2. La pratique du mélange de couches n'a cependant pas gagné beaucoup de terrain car la prolifération d'algues nuit aux écosystèmes marins en bloquant la lumière du soleil et en libérant des toxines nocives dans l'océan[76]. De plus, le bond soudain de la quantité du dioxyde de carbone (dissout) au niveau de la surface peut faire diminuer temporairement le pH de l'eau de mer, nuisant à la croissance des récifs coralliens. La production d'acide carbonique (H2CO3) par dissolution du dioxyde de carbone dans l'eau de mer entrave la calcification biogénique marine et provoque des perturbations majeures de la chaîne alimentaire océanique[77].
Voir également
- Stockage de carbone en mer du Nord
Références
- (en) Marchetti, « On geoengineering and the CO2 problem », Climatic Change, vol. 1, no 1, , p. 59–68 (ISSN 0165-0009, DOI 10.1007/bf00162777, Bibcode 1977ClCh....1...59M, S2CID 153503699, lire en ligne [PDF])
- (en) « The Earth's Carbon Reservoirs », earthguide.ucsd.edu (consulté le )
- (en) Stephen A. Rackley, « Ocean storage », dans Carbon Capture and Storage, Elsevier, (lire en ligne), p. 517–541
- (en) E. Eric Adams et Ken Caldeira, « Ocean Storage of CO2 », Elements, vol. 4, , p. 319–324 (DOI 10.2113/gselements.4.5.319).
- (en) Ken Caldeira, Makoto Akai, Peter Brewer, Baixin Chen, Peter Haugan, Toru Iwama, Paul Johnston, Haroon Kheshgi, Qingquan Li, Takashi Ohsumi, Hans Pörtner, Chris Sabine, Yoshihisa Shirayama et Jolyon Thomson, « Ocean Storage », dans IPCC Special Report on Carbon Dioxide Capture and Storage, International Panel on Climate Change, .
- (en) Pruess Paul, « Climate Change Scenarios Compel Studies of Ocean Carbon Storage », lbl.gov, Berkeley Lab
- (en) Howard Herzog, Ken Caldeira et Eric Adams, « Carbon Sequestration via Direct Injection », MIT
- (en) « Ocean Storage of CO2 », sur ieaghg.org, IEA Greenhouse Gas R&D Programme (consulté le )
- (en) Aliakbar Hassanpouryouzband, Edris Joonaki, Mehrdad Vasheghani Farahani et Satoshi Takeya, « Gas hydrates in sustainable chemistry », Chemical Society Reviews, vol. 49, no 15, , p. 5225–5309 (PMID 32567615, DOI 10.1039/C8CS00989A, S2CID 219971360)
- (en) C.A. Rochelle, A. P. CAMPS, D. LONG, A. MILODOWSKI, K. BATEMAN, D. GUNN, P. JACKSON, M. A. LOVELL et J. REES, « CO2 HYDRATE AND UNDERGROUND STORAGE », Published Thesis, (lire en ligne [PDF], consulté le )
- (en) Mark Capron, « Secure Seafloor Storage CO2 Storage », Published Thesis, (lire en ligne [PDF])
- (en) Steve Goldthorpe, « Potential for Very Deep Ocean Storage of CO2 Without Ocean Acidification: A Discussion Paper », Energy Procedia, vol. 114, , p. 5417–5429 (ISSN 1876-6102, DOI 10.1016/j.egypro.2017.03.1686).
- (en) Kurt House, « Permanent carbon dioxide storage in deep-sea sediments », Proceedings of the National Academy of Sciences, vol. 103, no 33, , p. 12291–12295 (PMID 16894174, PMCID 1567873, DOI 10.1073/pnas.0605318103, Bibcode 2006PNAS..10312291H, lire en ligne)
- (en) Andy Ridgwell, « Regulation of atmospheric CO2 by deep-sea sediments in an Earth System Model », Global Biogeochemical Cycles, vol. 21, no 2, , GB2008 (DOI 10.1029/2006GB002764, Bibcode 2007GBioC..21.2008R, lire en ligne)
- (en) Farhad Qanbari, Mehran Pooladi-Darvish, S. Hamed Tabatabaie et Shahab Gerami, « CO2 disposal as hydrate in ocean sediments », Journal of Natural Gas Science and Engineering, vol. 8, , p. 139–149 (ISSN 1875-5100, DOI 10.1016/j.jngse.2011.10.006)
- (en) Dongxiao Zhang et Yihua Teng, « Long-term viability of carbon sequestration in deep-sea sediments », Science Advances, vol. 4, no 7, , eaao6588 (ISSN 2375-2548, PMID 29978037, PMCID 6031374, DOI 10.1126/sciadv.aao6588, Bibcode 2018SciA....4O6588T)
- (en) Guttorm Alendal et Helge Drange, « Two-phase, near-field modeling of purposefully released CO2in the ocean », Journal of Geophysical Research: Oceans, vol. 106, no C1, , p. 1085–1096 (ISSN 0148-0227, DOI 10.1029/1999jc000290, Bibcode 2001JGR...106.1085A)
- (en) « Storing Carbon Dioxide under the Ocean », sur MIT Technology Review (consulté le )
- (en) B. Metz, O. Davidson, H. C. de Coninck, M. Loos et L. A. Meyer, Working Group III of the Intergovernmental Panel on Climate Change, IPCC Special Report on Carbon Dioxide Capture and Storage, Cambridge, Cambridge University Press, 442 p..
- (en) David Santillo et Paul Johnston, « Carbon Capture and Sequestration: Potential Environmental Impacts », Environmental Science, (CiteSeerx 10.1.1.577.6246)
- (en) Peter H. Israelsson, Aaron C. Chow et E. Eric Adams, « An updated assessment of the acute impacts of ocean carbon sequestration by direct injection », Energy Procedia, vol. 1, , p. 4929–4936 (DOI 10.1016/j.egypro.2009.02.324)
- (en) Babar Azeem, KuZilati KuShaari, Zakaria B. Man et Abdul Basit, « Review on materials & methods to produce controlled release coated urea fertilizer », Journal of Controlled Release, vol. 181, , p. 11–21 (ISSN 0168-3659, PMID 24593892, DOI 10.1016/j.jconrel.2014.02.020)
- (en) Kenji Kugino, Shizuka Tamaru, Yuko Hisatomi et Tadashi Sakaguchi, « Long-Duration Carbon Dioxide Anesthesia of Fish Using Ultra Fine (Nano-Scale) Bubbles », PLOS ONE, vol. 11, no 4, , e0153542 (ISSN 1932-6203, PMID 27100285, PMCID 4839645, DOI 10.1371/journal.pone.0153542, Bibcode 2016PLoSO..1153542K)
- (en) Geoffrey Supran et Naomi Oreskes, « Assessing ExxonMobil’s climate change communications (1977–2014) », Environmental Research Letters, vol. 12, no 8, (lire en ligne [PDF], consulté le )
- (en) Peter G. Brewer, National Academies of Sciences, Engineering, and Medicine, « Direct Injection of Carbon Dioxide into the Oceans », dans The Carbon Dioxide Dilemma: Promising Technologies and Policies, Washington, DC, The National Academies Press, (ISBN 978-0-309-08921-0, DOI 10.17226/10798, hhttps://nap.nationalacademies.org/read/10798/chapter/4#43)
- (en) « 6. Could CO2 be stored in the deep ocean? », sur www.greenfacts.org (consulté le ).
- (en) Ik Kyo Chung, Jung Hyun Oak, Jin Ae Lee et Jong Ahm Shin, « Installing kelp forests/seaweed beds for mitigation and adaptation against global warming: Korean Project Overview », ICES Journal of Marine Science, vol. 70, no 5, , p. 1038–1044 (ISSN 1054-3139, DOI 10.1093/icesjms/fss206, lire en ligne, consulté le )
- De Vooys, 1979; Raven and Falkowski, 1999; Falkowski et al., 2000; Pelejero et al., 2010
- (en) Alejandra Ortega, N.R. Geraldi, I. Alam et A.A. Kamau, « Important contribution of macroalgae to oceanic carbon sequestration », Nature Geoscience, vol. 12, no 9, , p. 748–754 (DOI 10.1038/s41561-019-0421-8, Bibcode 2019NatGe..12..748O, hdl 10754/656768, S2CID 199448971, lire en ligne)
- (en) Gerald Traufetter, « Cold Carbon Sink: Slowing Global Warming with Antarctic Iron », Der Spiegel, (ISSN 2195-1349, lire en ligne, consulté le )
- (en) X. Jin, N. Gruber, H. Frenzel et S. C. Doney, « The impact on atmospheric CO2 of iron fertilization induced changes in the ocean's biological pump », Biogeosciences, vol. 5, no 2, , p. 385–406 (ISSN 1726-4170, DOI 10.5194/bg-5-385-2008, Bibcode 2008BGeo....5..385J)
- (en) Richard Monastersky, « Iron versus the Greenhouse: Oceanographers cautiously explore a global warming therapy », Science News, vol. 148, , p. 220 (DOI 10.2307/4018225, JSTOR 4018225, lire en ligne)
- (en) Benoît Pasquier et Mark Holzer, « Iron fertilization efficiency and the number of past and future regenerations of iron in the ocean », Biogeosciences Discussions, vol. 15, no 23, , p. 7177–7203 (ISSN 1726-4170, DOI 10.5194/bg-2018-379, Bibcode 2018AGUFMGC23G1277P, S2CID 133851021)
- (en) Philip W. Boyd, Andrew J. Watson, Cliff S. Law et Edward R. Abraham, « A mesoscale phytoplankton bloom in the polar Southern Ocean stimulated by iron fertilization », Nature, vol. 407, no 6805, , p. 695–702 (ISSN 0028-0836, PMID 11048709, DOI 10.1038/35037500, Bibcode 2000Natur.407..695B, S2CID 4368261)
- (en) « John Martin », sur earthobservatory.nasa.gov, (consulté le )
- (en) Ian Salter, Ralf Schiebel, Patrizia Ziveri et Aurore Movellan, « Carbonate counter pump stimulated by natural iron fertilization in the Southern Ocean », Aquatic Sciences Meeting, 22 Feb 2015 - 27 Feb 2015, Grenade, Espagne, (lire en ligne, consulté le )
- (en) VICTOR SMETACEK, PHILIPP ASSMY et JOACHIM HENJES, « The role of grazing in structuring Southern Ocean pelagic ecosystems and biogeochemical cycles », Antarctic Science, vol. 16, no 4, , p. 541–558 (ISSN 0954-1020 et 1365-2079, DOI 10.1017/s0954102004002317, lire en ligne, consulté le )
- (en) Andy Hodson, Aga Nowak, Marie Sabacka et Anne Jungblut, « Climatically sensitive transfer of iron to maritime Antarctic ecosystems by surface runoff », Nature Communications, vol. 8, , p. 14499 (ISSN 2041-1723, PMID 28198359, PMCID 5316877, DOI 10.1038/ncomms14499, Bibcode 2017NatCo...814499H)
- (en) Trish J. Lavery, Ben Roudnew, Peter Gill et Justin Seymour, « Iron defecation by sperm whales stimulates carbon export in the Southern Ocean », Proceedings of the Royal Society of London B: Biological Sciences, vol. 277, no 1699, , p. 3527–3531 (ISSN 0962-8452, PMID 20554546, PMCID 2982231, DOI 10.1098/rspb.2010.0863)
- (en) Brooks J., Shamberger K., Roark, E. B. et Miller K., « Seawater Carbonate Chemistry of Deep-sea Coral Beds off the Northwestern Hawaiian Islands », American Geophysical Union, Ocean Sciences Meeting, vol. 2016, , AH23A–03 (Bibcode 2016AGUOSAH23A..03B)
- (en) Emmanuel C. Laurenceau-Cornec, Thomas W. Trull, Diana M. Davies et Christina L. De La Rocha, « Phytoplankton morphology controls on marine snow sinking velocity », Marine Ecology Progress Series, vol. 520, , p. 35–56 (ISSN 0171-8630, DOI 10.3354/meps11116, Bibcode 2015MEPS..520...35L)
- (en) Jennifer C. Prairie, Kai Ziervogel, Roberto Camassa et Richard M. McLaughlin, « Delayed settling of marine snow: Effects of density gradient and particle properties and implications for carbon cycling », Marine Chemistry, vol. 175, , p. 28–38 (ISSN 0304-4203, DOI 10.1016/j.marchem.2015.04.006)
- (en) Deborah K. Steinberg et Michael R. Landry, « Zooplankton and the Ocean Carbon Cycle », Annual Review of Marine Science, vol. 9, no 1, , p. 413–444 (ISSN 1941-1405, PMID 27814033, DOI 10.1146/annurev-marine-010814-015924, Bibcode 2017ARMS....9..413S)
- (en) Emma L. Cavan, Stephanie A. Henson, Anna Belcher et Richard Sanders, « Role of zooplankton in determining the efficiency of the biological carbon pump », Biogeosciences, vol. 14, no 1, , p. 177–186 (ISSN 1726-4189, DOI 10.5194/bg-14-177-2017, Bibcode 2017BGeo...14..177C, lire en ligne)
- (en) J. Robinson, E. E. Popova, A. Yool et M. Srokosz, « How deep is deep enough? Ocean iron fertilization and carbon sequestration in the Southern Ocean », Geophysical Research Letters, vol. 41, no 7, , p. 2489–2495 (ISSN 0094-8276, DOI 10.1002/2013gl058799, Bibcode 2014GeoRL..41.2489R, lire en ligne)
- (en) Judith Hauck, Peter Köhler, Dieter Wolf-Gladrow et Christoph Völker, « Iron fertilisation and century-scale effects of open ocean dissolution of olivine in a simulated CO 2 removal experiment », Environmental Research Letters, vol. 11, no 2, , p. 024007 (ISSN 1748-9326, DOI 10.1088/1748-9326/11/2/024007, Bibcode 2016ERL....11b4007H)
- (en) Luc Tremblay, Jocelyne Caparros, Karine Leblanc et Ingrid Obernosterer, « Origin and fate of particulate and dissolved organic matter in a naturally iron-fertilized region of the Southern Ocean », Biogeosciences, vol. 12, no 2, , p. 607 (DOI 10.5194/bg-12-607-2015, Bibcode 2015BGeo...12..607T, lire en ligne)
- (en) Gustaf Arrhenius, Stephen Mojzsis, A. Atkinson et S. Fielding, « Zooplankton Gut Passage Mobilizes Lithogenic Iron for Ocean Productivity », Current Biology, vol. 26, no 19, , p. 2667–2673 (ISSN 0960-9822, PMID 27641768, DOI 10.1016/j.cub.2016.07.058, S2CID 3970146, lire en ligne)
- (en) Adam Vinay Subhas, Chemical Controls on the Dissolution Kinetics of Calcite in Seawater (mémoire de doctorat), California Institute of Technology, (DOI 10.7907/z93x84p3, lire en ligne)
- (en) R. B. Jackson, J. G. Canadell, S. Fuss et J. Milne, « Focus on negative emissions », Environmental Research Letters, vol. 12, no 11, , p. 110201 (ISSN 1748-9326, DOI 10.1088/1748-9326/aa94ff, Bibcode 2017ERL....12k0201J)
- (en) T. M. Lenton et N. E. Vaughan, « The radiative forcing potential of different climate geoengineering options », Atmospheric Chemistry and Physics Discussions, vol. 9, no 1, , p. 2559–2608 (ISSN 1680-7375, DOI 10.5194/acpd-9-2559-2009, lire en ligne)
- US 20180217119, "Process and method for the enhancement of sequestering atmospheric carbon through ocean iron fertilization, and method for calculating net carbon capture from said process and method", issued 2016-07-28
- (en) J.-P. Gattuso, A. Magnan, R. Billé et W. W. L. Cheung, « Contrasting futures for ocean and society from different anthropogenic CO2 emissions scenarios », Science, vol. 349, no 6243, , aac4722 (ISSN 0036-8075, PMID 26138982, DOI 10.1126/science.aac4722, S2CID 206639157, lire en ligne)
- (en) Hamdi El-Jendoubi, Saúl Vázquez, Ángeles Calatayud et Primož Vavpetič, « The effects of foliar fertilization with iron sulfate in chlorotic leaves are limited to the treated area. A study with peach trees (Prunus persica L. Batsch) grown in the field and sugar beet (Beta vulgaris L.) grown in hydroponics », Frontiers in Plant Science, vol. 5, , p. 2 (ISSN 1664-462X, PMID 24478782, PMCID 3895801, DOI 10.3389/fpls.2014.00002)
- (en) Joo-Eun Yoon, Kyu-Cheul Yoo, Alison M. Macdonald et Ho-Il Yoon, « Reviews and syntheses: Ocean iron fertilization experiments – past, present, and future looking to a future Korean Iron Fertilization Experiment in the Southern Ocean (KIFES) project », Biogeosciences, vol. 15, no 19, , p. 5847–5889 (ISSN 1726-4189, DOI 10.5194/bg-15-5847-2018, Bibcode 2018BGeo...15.5847Y)
- (en) Byeong-Mo Gim, Seongjin Hong, Jung-Suk Lee et Nam-Hyun Kim, « Potential ecotoxicological effects of elevated bicarbonate ion concentrations on marine organisms », Environmental Pollution, vol. 241, , p. 194–199 (ISSN 0269-7491, PMID 29807279, DOI 10.1016/j.envpol.2018.05.057, S2CID 44160652)
- (en) « Reuters AlertNet - RPT-FEATURE-Scientists urge caution in ocean-CO2 capture schemes » [archive du ], (consulté le )
- (en) « WWF condemns Planktos Inc. iron-seeding plan in the Galapagos », sur Geoengineering Monitor, (consulté le )
- (en) Patricia Glibert, Donald Anderson, Patrick Gentien et Edna Granéli, « The Global, Complex Phenomena of Harmful Algal Blooms | Oceanography », Oceanography, vol. 18, no 2, , p. 136–147 (DOI 10.5670/oceanog.2005.49, lire en ligne, consulté le )
- (en) J.Keith Moore, Scott C Doney, David M Glover et Inez Y Fung, « Iron cycling and nutrient-limitation patterns in surface waters of the World Ocean », Deep Sea Research Part II: Topical Studies in Oceanography, vol. 49, nos 1–3, , p. 463–507 (ISSN 0967-0645, DOI 10.1016/S0967-0645(01)00109-6, Bibcode 2001DSRII..49..463M, CiteSeerx 10.1.1.210.1108, lire en ligne)
- (en) Charles G. Trick, Brian D. Bill, William P. Cochlan et Mark L. Wells, « Iron enrichment stimulates toxic diatom production in high-nitrate, low-chlorophyll areas », Proceedings of the National Academy of Sciences, vol. 107, no 13, , p. 5887–5892 (ISSN 0027-8424, PMID 20231473, PMCID 2851856, DOI 10.1073/pnas.0910579107, Bibcode 2010PNAS..107.5887T)
- (en) F. Fripiat, M. Elskens, T. W. Trull et S. Blain, « Significant mixed layer nitrification in a natural iron-fertilized bloom of the Southern Ocean », Global Biogeochemical Cycles, vol. 29, no 11, , p. 1929–1943 (ISSN 0886-6236, DOI 10.1002/2014gb005051, Bibcode 2015GBioC..29.1929F, lire en ligne)
- (en) Jeff Tollefson, « Iron-dumping ocean experiment sparks controversy », Nature, vol. 545, no 7655, , p. 393–394 (ISSN 0028-0836, PMID 28541342, DOI 10.1038/545393a, Bibcode 2017Natur.545..393T, S2CID 4464713)
- (en) Julia Mayo-Ramsay, « Environmental, legal and social implications of ocean urea fertilization: Sulu sea example », Marine Policy, vol. 34, no 5, , p. 831–835 (ISSN 0308-597X, DOI 10.1016/j.marpol.2010.01.004)
- (en) Patricia M. Glibert, Rhodora Azanza, Michele Burford et Ken Furuya, « Ocean urea fertilization for carbon credits poses high ecological risks », Marine Pollution Bulletin, vol. 56, no 6, , p. 1049–1056 (ISSN 0025-326X, PMID 18439628, PMCID 5373553, DOI 10.1016/j.marpolbul.2008.03.010, lire en ligne, consulté le )
- (en) Carleen M. Collins et Sarah E. F. D'Orazio, « Bacterial ureases: structure, regulation of expression and role in pathogenesis », Molecular Microbiology, vol. 9, no 5, , p. 907–913 (ISSN 0950-382X, PMID 7934918, DOI 10.1111/j.1365-2958.1993.tb01220.x, S2CID 21192428)
- (en) T M El-Geziry et I G Bryden, « The circulation pattern in the Mediterranean Sea: issues for modeller consideration », Journal of Operational Oceanography, vol. 3, no 2, , p. 39–46 (ISSN 1755-876X, DOI 10.1080/1755876x.2010.11020116, S2CID 130443230)
- (en) « WWF opposes dumping of urea in Sulu Sea », sur Geoengineering Monitor, (consulté le )
- (en) B. Eliasson, P. Riemer, A. Wokaun, Ian S.F. Jones et Christian Cappelen-Smith, « Lowring the cost of carbon sequestration by ocean nourishment », dans Greenhouse Gas Control Technologies, Elsevier, (ISBN 9780080430188, DOI 10.1016/b978-008043018-8/50041-2, lire en ligne), p. 255–259
- (en) Ik Kyo Chung, Jung Hyun Oak, Jin Ae Lee, Jong Ahm Shin, Jong Gyu Kim et Kwang-Seok Park, « Installing kelp forests/seaweed beds for mitigation and adaptation against global warming: Korean Project Overview | CAKE: Climate Adaptation Knowledge Exchange », sur www.cakex.org (consulté le )
- (en) Alvaro Israel, Rachel Einav et Joseph Seckbach, Seaweeds and their Role in Globally Changing Environments, Springer Science & Business Media, (ISBN 978-90-481-8569-6, lire en ligne)
- (en) FAO. 2018. The State of World Fisheries and Aquaculture 2018 (Meeting the sustainable development goals. Rome.) (ISBN 978-92-5-130562-1, lire en ligne [PDF])
- (en) « Ocean temperature », sur Science Learning Hub (consulté le )
- (en) « Ocean pumps could counter global warming », sur New Scientist (consulté le )
- (en) John H. Duke, « A proposal to force vertical mixing of the Pacific Equatorial Undercurrent to create a system of equatorially trapped coupled convection that counteracts global warming », Geophysical Research Abstracts, (lire en ligne)
- (en) US EPA, « Harmful Algal Blooms | US EPA », US EPA, (consulté le )
- (en) Shirley, « Discovering the Effects of Carbon Dioxide Levels on Marine Life and Global Climate », soundwaves.usgs.gov (consulté le )
Liens externes
- (en) « earth :: a global map of wind, weather, and ocean conditions », sur earth.nullschool.net (consulté le ), carte mondiale actuelle de la pression partielle de dioxyde de carbone à la surface de l'océan.
- (en) « earth :: a global map of wind, weather, and ocean conditions », sur earth.nullschool.net (consulté le ), carte mondiale actuelle de la densité de flux de dioxyde de carbone mer-air.
