Acrylate de méthyle
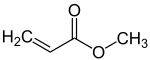
L'acrylate de méthyle est un composé chimique de formule CH2=CHCOOCH3. Il se présente sous la forme d'un liquide volatil incolore à l'odeur piquante, très inflammable, avec un point d'ébullition à 80 °C à pression atmosphérique. Sa pression de vapeur vaut, selon l'équation d'Antoine, log10(P) = A – ( B / ( T + C ) ), où P et T sont respectivement la pression en bars et la température en kelvins, avec A = 4,32327, B = 1338,663 et C = -43,516 dans un intervalle de températures de 229,5 à 353,3 K[4]. Les vapeurs sont trois fois plus denses que l'air. L'acrylate de méthyle polymérise spontanément, notamment sous l'effet de la lumière ou de températures élevées. L'enthalpie de polymérisation vaut −80 kJ/mol ou −930 kJ/kg[5], de sorte que 10 à 20 ppm de 4-méthoxyphénol HOC6H4OCH3 sont ajoutés comme stabilisant. L'acrylate de méthyle peut se conserver au moins un an en présence d'oxygène en-dessous de 35 °C.
| Acrylate de méthyle | |
| |
| Structure de l'acrylate de méthyle | |
| Identification | |
|---|---|
| Nom UICPA | prop-2-énoate de méthyle |
| No CAS | |
| No ECHA | 100.002.274 |
| No CE | 202-500-6 |
| No RTECS | AT2800000 |
| PubChem | 7294 |
| ChEBI | 82482 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore très inflammable à l'odeur âcre[1] |
| Propriétés chimiques | |
| Formule | CH2=CHCOOCH3 |
| Masse molaire[2] | 86,089 2 ± 0,004 2 g/mol C 55,81 %, H 7,02 %, O 37,17 %, |
| Propriétés physiques | |
| T° fusion | −75 °C[1] |
| T° ébullition | 80 °C[1] |
| Solubilité | 52 g/L[1] à 25 °C |
| Masse volumique | 0,95 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | 415 °C[1] |
| Point d’éclair | −3 °C[1] |
| Limites d’explosivité dans l’air | de 71 à 581 g/m3[1] (de 1,95 à 16,3 % en volume) |
| Pression de vapeur saturante | 9,11 kPa[1] à 20 °C |
| Précautions | |
| SGH[1] | |
  Danger |
|
| NFPA 704[3] | |
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 277 mg·kg-1[1] (souris, oral) |
| Unités du SI et CNTP, sauf indication contraire. | |
Production
On peut obtenir l'acrylate de méthyle par débromation de 2,3-dibromopropanoate de méthyle en présence de zinc et d'acide sulfurique[6].
La pyrolyse du lactate de méthyle CH3CH(OH)COOCH3 en présence de cétène H2C=C=O permet d'obtenir de l'acrylate de méthyle avec un bon rendement[7]. Un brevet plus récent décrit la pyrolyse du lactate de méthyle sur des zéolithes[8], aboutissant à un rendement de 93 % en acrylate de méthyle.
L'hydrocarboxylation catalysée par le tétracarbonyle de nickel Ni(CO)4 de l'acétylène C2H2 avec du monoxyde de carbone CO en présence de méthanol CH3OH, découverte par Walter Reppe, permet également d'obtenir de l'acrylate de méthyle[9]. Il existe un brevet[10] décrivant une voie de synthèse de l'acrylate de méthyle en une seule étape par oxydation du propène CH2=CH–CH3 ou de l'acroléine CH2=CHCHO avec de l'oxygène O2 en phase vapeur en présence de méthanol. La réaction du formiate de méthyle HCOOCH3 avec l'acétylène en présence de catalyseurs de métaux de transition conduit également à l'acrylate de méthyle[11]. L'alcoolyse de la β-propiolactone avec le méthanol, comme la méthanolyse de l'acrylonitrile CH2=CH–C≡N via le sulfate d'acrylamide[12] est l'un des procédés obsolètes de production de l'acrylate de méthyle.
La disponibilité d'acide acrylique CH2=CHCOOH bon marché obtenu par oxydation du propylène CH2=CHCH3 fait de l'estérification directe avec du méthanol sous catalyse acide la réaction standard utilisée par l'industrie, par exemple avec l'acide sulfurique H2SO4, l'acide p-toluènesulfonique CH3C6H4SO2OH ou des résines échangeuses d'ions acides.
Utilisations
Après l'acrylate de butyle CH2=CHCOOC4H9 et l'acrylate d'éthyle CH2=CHCOOC2H5, l'acrylate de méthyle est le troisième ester acrylique industriel le plus important. À l'instar de l'acrylate d'éthyle, l'ester méthylique réagit efficacement avec les amines sous catalyse par des bases de Lewis à travers une addition de Michael pour former de la β-alanine qui donne des tensioactifs amphotères avec les amines à longue chaîne après hydrolyse de la fonction ester :
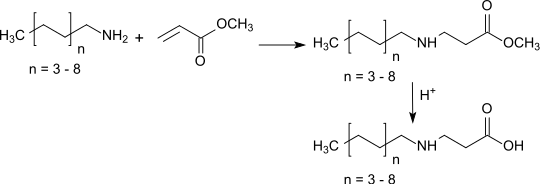
Il est abondamment utilisé pour la production d'acrylate de diméthylaminoéthyle CH2=CHCOOCH2CH2N(CH3)2 par transestérification du diméthylaminoéthanol[13].
Son utilisation comme comonomère dans la polymérisation avec divers monomères acryliques et vinyliques est largement équivalente à celle de l'acrylate d'éthyle. L'acrylate de méthyle utilisé comme comonomère donne des peintures acryliques plus dures et plus cassantes qu'avec les acrylates homologues. La copolymérisation de l'acrylate de méthyle avec l'acrylonitrile améliore le traitement en fibres à l'état fondu, ce qui peut être intéressant pour produire des matériaux en fibres de carbone[14].
L'acrylate de méthyle est utilisé pour préparer des dendrimères de polyamidoamine (en), généralement par une addition de Michael avec une amine primaire.
Notes et références
- Entrée « Methyl acrylate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 3 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Methyl acrylate, 99%, stab. with ca 15ppm 4-methoxyphenol », sur Alfa Aesar (consulté le ).
- (en) Daniel R. Stull, « Vapor Pressure of Pure Substances. Organic and Inorganic Compounds », Industrial & Engineering Chemistry Research, vol. 39, no 4, , p. 517-540 (DOI 10.1021/ie50448a022, lire en ligne)
- (de) Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme, Jedermann Verlag, mai 2015. (ISBN 978-3-86825-069-5)
- (de) F. Beilstein, Handbuch der organischen Chemie, 3e éd., vol. 1, Verlag Leopold Voss, 1893, p. 501.
- (en) Hugh J. Hagemeyer pour Eastman Kodak Co, Brevet U.S. 2417748A : Preparation of methyl acrylate, déposé le 23 décembre 1943, publié le 18 mars 1947, sur Google Patents.
- (en) Takafumi Abe et Shinichi Hieda pour Mitsubishi Gas Chemical Co Inc, Brevet U.S. 5250729A : Process for preparing unsaturated carboxylic acid or ester thereof, déposé le 4 décembre 1989, publié le 5 octobre 1993, sur Google Patents.
- (de) Walter Reppe, « Carbonylierung I. Über die Umsetzung von Acetylen mit Kohlenoxyd und Verbindungen mit reaktionsfähigen Wasserstoffatomen Synthesen α,β-ungesättigter Carbonsäuren und ihrer Derivate », Justus Liebigs Annalen der Chemie, vol. 582, no 1, , p. 1-37 (DOI 10.1002/jlac.19535820102, lire en ligne)
- (en) Natale Ferlazzo, Gian Fausto Buzzi et Marcello Ghirga pour Societa Italiana Resine SpA SIR, Brevet U.S. 3925463A : Process for the production of methyl acrylate, déposé le 29 novembre 1973, publié le 9 décembre 1975, sur Google Patents.
- (en) Zhao-Tie Liu, Jia-Qi Zhang et Xian-Gui Yang pour Chengdu Institute of Organic Chemistry of CAS National Res and Eng Centre for Coal Slurry Gasif'n and Chem Ind, Brevet U.S. 6022990A : Method for synthesizing methyl acrylate, déposé le 15 décembre 1997, publié le 8 février 2000, sur Google Patents.
- (de) H.-J. Arpe, Industrielle Organische Chemie, 6e éd., Wiley-VCH Verlag, Weinheim, 2007. (ISBN 978-3-527-31540-6)
- Jean-Michel Paul, Boris Tonnelier et Francis Augustin, Brevet WO2010136696A1 : Composition comprenant un oxyde de dialkyl étain et son utilisation comme catalyseur de transestérification pour la synthèse d'esters (méth)acryliques, déposé le 18 mai 2010, publié le 2 décembre 2010.
-
(en) V. A. Bhanu, P. Rangarajan, K. Wiles, M. Bortner, M. Sankarpandian, D. Godshall, T. E. Glass, A. K. Banthia, J. Yang, G. Wilkes, D. Baird et J. E. McGrath, « Synthesis and characterization of acrylonitrile methyl acrylate statistical copolymers as melt processable carbon fiber precursors », Polymer, vol. 43, no 18, , p. 4841-4850 (DOI 10.1016/S0032-3861(02)00330-0, lire en ligne
 )
)

