Tétrachlorure de titane
Le tétrachlorure de titane est un composé inorganique de formule TiCl4. C'est un intermédiaire important dans la production de titane métallique et de pigments dioxyde de titane. C'est un exemple d'halogénure métallique inhabituel, particulièrement volatil. Au contact de l'air humide, il forme de spectaculaires nuages opaques de dioxyde de titane et de chlorure d'hydrogène.
| Tétrachlorure de titane | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | tétrachlorure de titane | |
| No CAS | ||
| No ECHA | 100.028.584 | |
| No CE | 231-441-9 | |
| PubChem | 24193 | |
| Apparence | Liquide incolore à odeur forte (lacrymogène) [1] | |
| Propriétés chimiques | ||
| Formule | TiCl4 | |
| Masse molaire[2] | 189,679 ± 0,009 g/mol Cl 74,76 %, Ti 25,24 %, |
|
| Propriétés physiques | ||
| T° fusion | −24,8 °C | |
| T° ébullition | 136,4 °C [1] | |
| Masse volumique | 1,726 g·cm-3 | |
| Point d’éclair | −18 °C [1] | |
| Pression de vapeur saturante | 16,5 hPa à 25 °C [1] | |
| Viscosité dynamique | 8,27×10-4 Pa·s à 25 °C | |
| Précautions | ||
| NFPA 704 | ||
| Directive 67/548/EEC[1] | ||
 C |
||
| Transport | ||
| Unités du SI et CNTP, sauf indication contraire. | ||
Propriétés et structure
Le TiCl4 est un liquide dense, incolore et distillable, mais des échantillons bruts peuvent avoir des teintes jaunes ou rouge-brun. C'est l'un des rares halogénure de métal de transition liquide à température ambiante, un autre exemple étant VCl4. Cette propriété découle du fait que TiCl4 est moléculaire, c'est-à-dire que chaque molécule de TiCl4 est relativement faiblement associées à ses molécules voisines. La plupart des chlorures métalliques sont des polymères, ou les atomes de chlore servent de ponts entre les atomes de métal. L'attraction entre les molécules de TiCl4 est faible, principalement constituée des forces de van der Waals, résultant en de faibles points de fusion et d'ébullition, proches de ceux de CCl4.
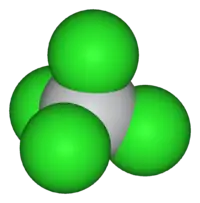
Les ions Ti4+ out une couche électronique complète, avec le même nombre d'électrons que l'argon, gaz inerte. Le tétrachlorure de titane adopte une structure tétraédrique hautement symétrique, cohérente avec sa description en tant que centre métallique d0 (Ti4+) entouré par quatre ligands identiques (Cl−). Cette structure est très proche de celles du TiBr4 et du TiI4, les trois composés partageant d'ailleurs certains propriétés. TiCl4 et TiBr4 réagissent ensemble pour donner des halogénures mixtes TiCl4 -xBrx (x = 0, 1, 2, 3 ou 4). Des mesures par résonance magnétique ont aussi montré des échanges rapides d'halogène entre TiCl4 et VCl4[3].
TiCl4 est soluble dans le toluène et les composés organochlorés, comme d'autres espèces apolaires. Il a été montrés que certains arènes formaient des complexes du type [(C6R6)TiCl3]+. TiCl4 réagit de façon exothermique avec des solvants donneurs tel que le THF pour former des adduits hexacoordonnés[4]. Avec des ligands plus encombrés (L), il forme des adduits pentacoordonnés TiCl4L.
Synthèse
TiCl4 peut être produit par le procédé au chlore (en) qui implique la réduction de minerais d'oxydes de titane, typiquement l'ilménite (FeTiO3) par le carbone sous un flot continu de chlore à 900 °C :
- 2 FeTiO3 + 7 Cl2 + 6 C → 2 TiCl4 + 2 FeCl3 + 6 CO
Les impuretés sont ensuite retirées par distillation. La coproduction de FeCl3 est indésirable, ce qui a motivé la recherche d'alternative. Par exemple, au lieu d'utiliser directement l'ilménite, on utilise du « laitier rutile » une forme impure de TiO2 dérivée de l'ilménite en y retirant le fer, soit par réduction avec le carbone, soit par extraction par l'acide sulfurique. Le TiCl4 brut peut contenir différents autres halogénures volatils, notamment le chlorure de vanadyle (VOCl3), le tétrachlorure de silicium (SiCl4) ou encore le tétrachlorure d'étain (SnCl4), ce qui nécessite une étape supplémentaire de séparation.
Chimie
Le tétrachlorure de titane est un réactif polyvalent formant de nombreux dérivés, comme illustré ci-dessous.
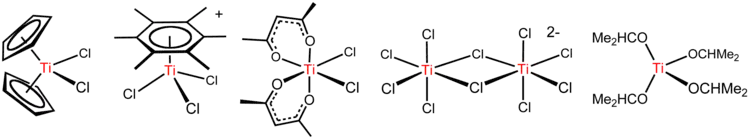
Hydrolyse et réactions analogues
La réaction la plus notable concernant TiCl4 est son hydrolyse, une réaction facile signalée par le dégagement corrosif de chlorure d'hydrogène et la formation d'oxydes et d'oxychlorures de titane. Cette réaction a fait que le TiCl4 a un temps été utilisé dans la production de fumigènes (voire paragraphe ci-dessous).
Les alcools réagissent avec TiCl4 pour donner les alcoolates correspondants de formule [Ti(OR)4]n (R = alkyle, n = 1, 2, 4). Comme leur formule l'indique, ces alcoolates peuvent adopter des structures complexes, allant du monomère au tétramère. De tels composés sont utiles en science des matériaux aussi bien qu'en synthèse organique. Parmi ces composés, on peut citer le très connu isopropoxyde de titane, présent sous la forme d'un monomère.
Les amines réagissent avec TiCl4 pour former des composés contenant des complexes amido (R2N−-containing) et imido (RN2−-containing). En réagissant avec l'ammoniac, il forme le nitrure de titane. Une réaction illustrative de cette réactivité est la synthèse du tétrakis(diméthylamido)titane Ti(NMe2)4, un liquide jaune soluble dans le benzène[5] :
- 4 LiNMe2 + TiCl4 → 4 LiCl + Ti(NMe2)4
Complexes avec des ligands simples
TiCl4 est un acide de Lewis, comme le laisse deviner sa tendance à s'hydrolyser. Avec l'éther cyclique THF, TiCl4 forme de cristaux jaunes de (THF)2. Avec des sels de chlorure, TiCl4 forme de façon séquentielle [Ti2Cl9]−, [Ti2Cl10]2−, et [TiCl6]2−[6]. De façon intéressante, la réaction avec les ions chlorures dépend du contre-ion. NBu4Cl et TiCl4 donnent un complexe pentacoordonné NBu4TiCl5, alors qu'avec le NEt4+, il donne (NEt4)2Ti2Cl10. Ces réactions soulignent l'influence des forces électrostatiques sur les structures des composés avec de fortes liaisons ioniques.
Oxydoréductions
La réduction de TiCl4 par l'aluminium est une réduction monoélectronique. Le trichlorure (TiCl3) et le tétrachlorure ont des propriétés contrastées : le trichlorure est un solide, étant un polymère de coordination (en), et est paramagnétique. Lorsque la réduction se produit dans le THF, le produit (III) se convertit en adduit TiCl3(thf)3 bleu clair.
Chimie organométallique
La plupart des composés d'organotitane sont en général produits à partir de TiCl4. Une importante réaction implique le cyclopentadiénure de sodium pour donner le dichlorure de titanocène, TiCl2(C5H5)2. ce composé et beaucoup de ses dérivés sont des précurseurs du catalyseur de Ziegler-Natta. Le réactif de Tebbe, un composé utile en chimie organique et un dérivé aluminié du titanocène issu de la réaction entre le dichlorure de titanocène et le triméthylaluminium. Il est notamment utilisé dans les réactions d'« oléfination ».
Les arènes, tels que C6(CH3)6 réagissent pour donner des complexes « tabouret de piano » [Ti(C6R6)Cl3]+ (R = H, CH3; voir deuxième schéma de la figure ci-dessus)[7]. Cette réaction illustre le haut caractère de l' acide de Lewis de l'espèce TiCl3+, produite par le départ d'un ion chlorure de TiCl4 capturé par AlCl3.
Réactif en synthèse organique
TiCl4 a des usages limités mais divers en synthèse organique, du fait de son acidité de Lewis et de son oxophilie[8]. Il est par exemple utilisé dans l'addition aldolique de Mukaiyama. Une aptitude-clé dans cette application est la tendance de TiCl4 à activer les aldéhydes (RCHO) par formation d'adduits tels que (RCHO)TiCl4OC(H)R. Il est aussi utilisé dans la réaction de McMurry en addition avec le zinc, et LiAlH4. Ces réducteurs produisent des dérivés Ti(III) qui se couplent avec les cétones, produisant des alcènes.
Applications
Production de titane métallique
La production annuelle de titane est d'environ 250 000 tonnes ; celle-ci résulte principalement de la transformation de TiCl4. Cette conversion s'effectue par réduction du chlorure par le magnésium métallique, produisant titane métallique et chlorure de magnésium :
- 2 Mg + TiCl4 → 2 MgCl2 + Ti
Cette méthode est connue sous le nom de procédé Kroll[9]. Dans le procédé Hunter (en), on utilise du sodium liquide au lieu du magnésium comme agent réducteur.
Production de dioxyde titane
Environ 90 % de la production de TiCl4 est utilisé pour produire le pigement dioxyde de titane (TiO2). La conversion implique une hydrolyse de TiCl4, formant aussi du chlorure d'hydrogène[9] :
- TiCl4 + 2 H2O → TiO2 + 4 HCl
Dans certains cas, on oxyde TiCl4 directement par le dioxygène :
- TiCl4 + O2 → TiO2 + 2 Cl2
Fumigène
TiCl4 a été utilisé dans la production de fumigènes car il produit une fumée blanche lourde qui s'élève peu dans l'air[10], TiCl4 absorbant l'eau de l'atmosphère et s'hydrolysant, formant du chlorure d'hydrogène, lui-même absorbant plus d'eau pour former de micro-gouttelettes d'acide chlorhydrique, qui, selon le taux d'humidité, peut absorber encore plus d'eau. De plus, cette réaction produit du dioxyde de titane, un composé à très fort indice de réfraction qui renvoie donc une grande partie de la lumière. Cependant, du fait de la corrosivité de cette fumée, TiCl4 n'est plus utilisé.
Toxicité et autres dangers
Les principaux risques que présente le tétrachlorure de titane viennent de sa capacité à libérer du chlorure d'hydrogène (HCl). TiCl4 est un acide de Lewis fort, qui réagit de façon exothermique en formant des adduits, même avec des bases faibles telles que le THF et de façon explosive avec l'eau, dégagent du HCl.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Titanium tetrachloride » (voir la liste des auteurs).
- « tétrachlorure de titane », sur http://www.alfa.com/ (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- S. P. Webb, M. S. Gordon, « Intermolecular Self-Interactions of the Titanium Tetrahalides TiX4 (X = F, Cl, Br) », J. Am. Chem. Soc., vol. 121, no 11, , p. 2552–2560 (DOI 10.1021/ja983339i)
- L. E. Manzer, Joe Deaton, Paul Sharp et R. R. Schrock, « Tetrahydrofuran Complexes of Selected Early Transition Metals », Inorganic Synthesis, vol. 21, , p. 135–40 (ISBN 978-0-470-13252-4, DOI 10.1002/9780470132524.ch31)
- D. C. Bradey, M. Thomas, « Some Dialkylamino-derivatives of Titanium and Zirconium », Journal of the Chemical Society, , p. 3857–3861 (DOI 10.1039/JR9600003857)
- C. S. Creaser, J. A. Creighton, « Pentachloro- and Pentabromotitanate(IV) ions », Journal of the Chemical Society, Dalton Transactions, no 14, , p. 1402–1405 (DOI 10.1039/DT9750001402)
- F. Calderazzo, I. Ferri, G. Pampaloni, S. Troyanov, « η6-Arene Derivatives of Titanium(IV), Zirconium(IV) and Hafnium(IV) », Journal of Organometallic Chemistry, vol. 518, , p. 189–196 (DOI 10.1016/0022-328X(96)06194-3)
- (en) L.-L. Gundersen, F. Rise, K. Undheim, Encyclopedia of Reagents for Organic Synthesis, New York, J. Wiley & Sons, , « Titanium(IV) chloride »
- Hans G. Völz et al. “Pigments, Inorganic” in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2006. DOI 10.1002/14356007.a20_243.pub2
- The Royal Navy at War [DVD] ()
Voir aussi
Articles connexes
Liens externes
Bibliographie
- Boustany KS, Bernauer K & Jacot‐Guillarmod A (1967) Étude sur les composés organométalliques III [1]. Action d'organomagnésiens sur des complexes du tétrachlorure de titane. Helvetica Chimica Acta, 50(5), 1305-1313 (http://onlinelibrary.wiley.com/doi/10.1002/hlca.19670500513/abstract;jsessionid=D5C496B46E14EF079F1D43F22941BC72.f02t03?deniedAccessCustomisedMessage=&userIsAuthenticated=false résumé]).
- Boustany KS, Bernauer K & Jacot‐Guillarmod A (1967) . Études sur les composés organométalliques I . Action du chlorure de benzylmagnésium et du bromure de phénylmagnésium sur le tétrachlorure de titane. Helvetica Chimica Acta, 50(4), 1080-1084 (résumé).
- Cassimatis D, Gagnaux P & Susz BP (1960) Étude des composés d'addition des acides de LEWIS X. Spectres infrarouges des composés formés par les chlorures d'acide avec le tétrachlorure de titane. Helvetica Chimica Acta, 43(1), 424-433 (résumé).
- Aubin R & Rivest R (1958) Sur les réactions des polyesters avec le tétrachlorure de titane: I. La réaction de l'oxalate de diéthyle avec le tétrachlorure de titane. Canadian Journal of Chemistry, 36(6), 915-920 (PDF, 6 pages).

