Addition aldolique de Mukaiyama
L'addition aldolique de Mukaiyama est une réaction organique de type aldolisation entre un éther d'énol silylé et un aldéhyde, catalysé par un acide de Lewis[1]. Ce choix de réactifs permet de faire des aldolisations croisées entre un aldehyde et une cétone, ou un aldéhyde différent, sans risquer la condensation de l'aldéhyde sur lui-même, ce qui réduirait fortement le rendement. Pour cette raison, cette réaction est utilisée de façon extensive en synthèse organique. Dans son utilisation originelle, l'acide de Lewis (le chlorure de titane) était utilisé en quantité stœchiométrique, mais il existe aussi des utilisations avec de vraies quantités catalytiques également. Cette réaction est aussi optimisée pour les synthèses asymétriques.
Réaction originale
La description de la réaction originale publiée par Teruaki Mukaiyama en 1973 [2] est celle entre l'éther d'énol silylé de la cyclohexanone avec le benzaldéhyde, en présence d'un équivalent de tétrachlorure de titane dans le dichlorométhane. À température ambiante, elle produit un mélange de diastéréoisomères de thréo (63 %) et érythro (19 %) β-hydroxycétone ainsi que 6 % d'une énone exocyclique.
Autres réactions
Dans un second article en 1974[3], il s'agit d'une réaction entre l'acétate d'isopropényle (l'adduit de l'acétone et de l'acide acétique) et le benzaldéhyde avec divers acides de Lewis, tels que le chlorure d'aluminium, le tétrachlorure d'étain ou le trifluorure de bore, mais beaucoup de réactions secondaires entrent alors en compétition avec la formation de l'hydroxycétone. Dans un autre article de 1974[4], Mukaiyama revient cette fois à la réaction avec l'éther d'énol silylé, avec une température réduite à −78 °C, ce qui permet d'obtenir la diastéréosélectivité désirée.
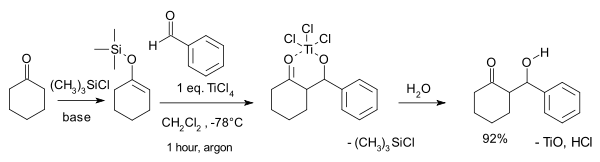
Le groupe triméthylsilyle active l'énol comme nucléophile, et le produit initial est un chélate de titane qui est brisé par hydrolyse. La capture de l'aldol initialement formé est un prérequis pour le succès de la réaction.
Une réaction typique entre deux cétones est celle entre l'acétophénone dans le rôle de l'énol, et l'acétone[5] :
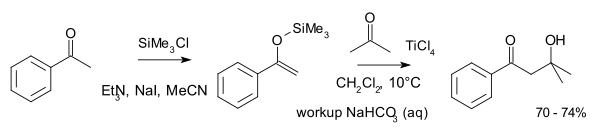
Ce type de réactions entre cétones nécessite une plus haute température.
Pour ce travail, Mukaiyama s'est inspiré des travaux antérieurs de Georg Wittig de 1966 sur des aldolisations croisées avec des imines lithiées[6] - [7]. Un travail concurrent avec des réactions aldoliques sur des énolates de lithium a également été publiée en 1973 par Herbert O. House[8].
Utilisation
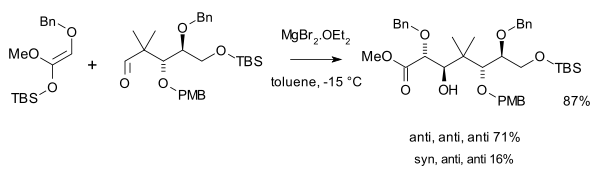
Mukaiyama a utilisé dans sa synthèse totale du taxol (1999) deux aldolisations[9] - [10], l'une avec un acétal de cétène silylé et du bromure de magnésium en excès :
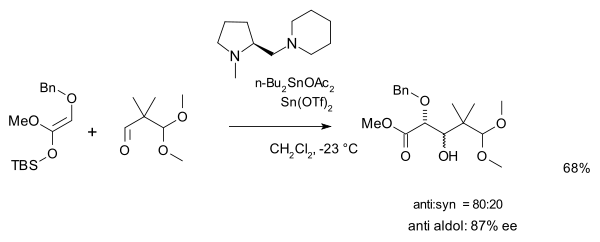
et une seconde avec un ligand chiral amine et un sel de triflate comme catalyseur :
Notes et références
- (en) T. Mukaiyama et S. Kobayashi, Organic Reactions, vol. 46, New York (NY), John Wiley & Sons, , 416 p. (ISBN 9780471086192, DOI 10.1002/0471264180.or046.01), chap. 1 (« Tin (II) Enolates in the Aldol, Michael, and Related Reactions »), p. 1-103.
- (en) T. Mukaiyama, K. Narasaka et al., « New aldol type reaction », Chem. Lett., vol. 2, no 9, , p. 1011-1014 (ISSN 0366-7022, DOI 10.1246/cl.1973.1011).
- (en) T. Mukaiyama, T. Izawa et al., « Reaction of enol acetate with acetal and carbonyl compound in the presence of Lewis acid », Chem. Lett., vol. 3, no 4, , p. 323-326 (ISSN 0366-7022, DOI 10.1246/cl.1974.323).
- (en) T. Mukaiyama, K. Banno et al., « New cross-aldol reactions. Reactions of silyl enol ethers with carbonyl compounds activated by titanium tetrachloride », J. Am. Chem. Soc., vol. 96, no 24, , p. 7503–7509 (ISSN 0002-7863, DOI 10.1021/ja00831a019).
- (en) T. Mukaiyama et K. Narasaka, « 3-Hydroxy-3-methyl-1-phenyl-1-butanone by crossed aldol reaction », Org. Synth., vol. 65, , p. 6 (ISSN 0078-6209, DOI 10.15227/orgsyn.065.0006).
- (de) G. Wittig et P. Suchanek, « Über gezielte aldokondensationen—II », Tetrahedron, vol. 22, no 8, , p. 347–358 (ISSN 0040-4020, DOI 10.1016/S0040-4020(01)82193-1).
- (en) G. Wittig et A. Hesse, « Directed aldol condensations: β-phenylcinnamaldehyde », Org. Synth., vol. 50, , p. 66 (ISSN 0078-6209, DOI 10.15227/orgsyn.050.0066).
- (en) H. O. House, D. S. Crumrine et al., « Chemistry of carbanions. XXIII. Use of metal complexes to control the aldol condensation », J. Am. Chem. Soc., vol. 95, no 10, , p. 3310–3324 (ISSN 0002-7863, DOI 10.1021/ja00791a039).
- (en) T. Mukaiyama, I. Shiina et al., « Asymmetric Total Synthesis of Taxol », Chem. Eur. J., vol. 5, no 1, , p. 121–161 (ISSN 0947-6539, DOI 10.1002/(SICI)1521-3765(19990104)5:1<121::AID-CHEM121>3.0.CO;2-O).
- TBS = t-butyldimethylsilyl, Bn = benzyl, PMB = p-methoxybenzyl ether
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Mukaiyama aldol addition » (voir la liste des auteurs).