Discoglossus sardus
Discoglosse sarde, Grenouille peinte tyrrhénienne

Discoglossus sardus, le Discoglosse sarde, plus rarement nommé Grenouille peinte tyrrhénienne, est une espèce de petits amphibiens anoures de la famille des Alytidae et du genre Discoglossus.
Qualifié d'endémique de la mer Tyrrhénienne, le Discoglosse sarde présente une aire de répartition restreinte à quelques îles de l'Ouest de la mer Méditerranée, notamment la Corse et la Sardaigne. Espèce à fort enjeu de conservation, elle est morphologiquement très proche du Discoglosse corse (Discoglossus montalentii), avec lequel elle partage une partie de son aire de répartition en Corse.
Peu exigeante en matière d'habitat, supportant même des pollutions aquatiques légères, l'espèce se rencontre dans toute sorte de zones humides, allant du niveau de la mer à plus de 1 700 mètres d'altitude. Elle se nourrit principalement d'invertébrés terrestres de petite taille.
L'espèce n'est pas menacée d'extinction à court terme et est inscrite comme « préoccupation mineure » (LC) sur la liste rouge de l'Union internationale pour la conservation de la nature (UICN), mais est néanmoins fragile et sujette à de nombreuses menaces qui justifient son statut de protection fort, tant en France qu'en Italie, où elle est intégralement protégée et inscrite en annexe 2 de la directive habitats. Outre la destruction de son habitat, notamment par l'urbanisation, elle se révèle sensible à la chytridiomycose, une maladie de peau menaçant de très nombreuses espèces d'amphibiens à travers le monde.
Peu connu du grand public, le Discoglosse sarde fait partie des espèces emblématiques de plusieurs aires protégées, notamment du parc national de Port-Cros, en France.
Description
Adultes
Le Discoglosse sarde est une espèce d'amphibiens de petite taille, de silhouette robuste, qui mesure entre 5 et 7,5 centimètres de longueur[1] - [2].
La coloration est variable, allant du brun foncé au gris, en passant par le noir et le rougeâtre. Des taches plus claires sont presque toujours présentes, les individus unis étant rares. La plupart du temps, une grande tache claire est présente entre les épaules et une grande tache foncée se trouve entre les yeux, avec une bordure antérieure plus claire et rectiligne[1]. Une tache claire, en forme de croissant, peut être présente sur le dessus de la tête, entre le museau et le milieu des yeux, au niveau de la ceinture scapulaire[1] - [2] - [3].
Le ventre est jaunâtre ou blanchâtre (crème)[1] - [2]. La pupille est en forme de gouttelette inversée et la moitié supérieure de l’iris est généralement claire (dorée), tandis que la moitié inférieure est sombre[1] - [4], comme chez tous les Discoglosses. Comme chez toutes les espèces du genre, le tympan est à peine visible[1].
La peau est le plus souvent relativement lisse. Cependant, au moment de la reproduction, les mâles présentent une livrée spéciale, caractérisée par une peau rugueuse et sèche[2]. Des verrues lisses sont présentes sur le dos et les membres et sont parfois alignées[1]. Les papilles kératinisées sont bien développées sur les cuisses[2]. Le bout du quatrième doigt est plus étroit que sa base[1]. Enfin, le museau est légèrement pointu et effilé, ce qui se voit particulièrement bien de profil[1] - [2]. La tête est plus large que longue[2].
 Individu aux taches bien visibles.
Individu aux taches bien visibles.
 Comparaison avec une paume de main humaine.
Comparaison avec une paume de main humaine. Détail de la tête.
Détail de la tête. Adulte de couleur sombre.
Adulte de couleur sombre. Adulte plus clair.
Adulte plus clair.
Dimorphisme sexuel
Le dimorphisme sexuel est plus marqué pendant la période du rut, mais il est possible pour des experts de distinguer les sexes toute l'année[2] - [5]. Il existe une différence entre les proportions corporelles des mâles et des femelles[6].
Hors période de reproduction, les mâles présentent un tubercule interne du carpe bien développé tandis qu'il ne l'est pas chez les femelles. De plus, le pouce est aplati en forme de croissant chez le mâle et ne l'est pas chez la femelle[7].
Lors de la période de reproduction, le tubercule interne, le pouce et le premier doigt sont couverts d’une callosité brune chez le mâle et on note la présence d’épines noires sur la mandibule inférieure, parfois la gorge, ainsi que le ventre, les cuisses, les tibias et les pieds chez les mâles[7] - [8]. Les femelles ne présentent, en période de reproduction, ni de callosités brunes, ni d'épines noires[7].
Pontes et têtards
Les œufs sont bicolores, noirs à brunâtres avec un pôle gris-blanc. Ils ont un diamètre de 1 à 1,5 mm et sont contenus dans une capsule gélatineuse individuelle de 3 à 4 mm[5].

Les têtards de Discoglosse ont une coloration brun-noirâtre et possèdent une membrane caudale peu développée, ornée de réticulations très fines, visibles uniquement à la loupe[9]. Mesurant moins de 35 mm[4], ils se caractérisent par un tube d'évacuation de l'eau (spiracle) ventral, alors qu'il est latéral, sur le côté gauche, chez les autres espèces d'amphibiens corses[5]. Leur queue mesure une fois et demie la longueur de leur corps[4]. De plus, ces têtards présentent, dès un stade très précoce de leur développement, un filet de polygones fermés dans leur épiderme, structure unique chez les têtards d'amphibiens corses[10]. Cette structure est visible avec une loupe[11]. Leur identification est donc relativement facile.
Cependant, il est très difficile de distinguer les tétards du Discoglosse sarde de ceux du Discoglosse corse. Un examen à la loupe binoculaire est nécessaire, afin d'observer le disque buccal[7]. Chez le Discoglosse sarde, le bord papillaire est incomplet et la somme des subrangées (lèvre inférieure et lèvre supérieure) des dents est inférieure à 9, tandis que chez le Discoglosse corse, le bord papillaire est complet et la somme des subrangées est supérieure ou égale à 10[7] - [11].
Plusieurs cas de têtards partiellement albinos ont été relevés, notamment dans une population de l'île de Giglio, en 1969[12]. Des observations histologiques ont montré qu'il n'y avait aucune trace de mélanine dans les tissus des individus albinos[12].
Confusions

L'espèce la plus proche du Discoglosse sarde est le Discoglosse corse (Discoglossus montalentii), élevé au rang d'espèce en 1984[13]. Cette espèce, endémique stricte de Corse, se différencie du Discoglosse sarde par des critères subtils. Les deux espèces cohabitent sur le même site en de nombreux points en Corse[1]. On parle de synthopie.
Vu de profil, son museau est arrondi, alors qu'il est pointu chez sardus. Chez sardus, le bout du quatrième doigt est plus étroit que sa base, alors qu'il est plus large que sa base chez montalentii[1] - [10]. De plus, la partie située entre l’œil et la narine est horizontale chez montalentii, alors qu'elle est légèrement inclinée vers la pointe du museau chez sardus[10]. On peut également citer la longueur de la patte postérieure, qui peut atteindre au moins le coin de l’œil et le plus souvent la pointe du museau chez montalentii, alors qu'elle atteint au maximum un point situé entre l’œil et la pointe du museau chez sardus[10].
D'autres critères différencient les deux espèces (peau plus rugueuse chez montalentii, rapport de la longueur du museau/urostyle (homologue à des côtes fusionnées) : tibia de 1,71 à 1,76 chez montalentii et de 1,90 à 1,94 chez sardus)[10]. Globalement, le Discoglosse sarde a une variabilité morphologique intraspécifique plus importante que le Discoglosse corse[7].
Enfin, leurs exigences écologiques et les habitats qu'ils occupent permettent parfois de les séparer ou au moins d'orienter l'identification. En effet, le Discoglosse corse est quasiment inféodé aux torrents intacts d'altitude, jusqu'à 1 900 mètres (avec quelques exceptions en bord de mer), tandis que le Discoglosse sarde occupe des habitats plus divers jusqu'en bord de mer[1].
Leur chant est également très différent[11], celui de montalentii ressemblant à celui du Sonneur à ventre jaune (Bombina variegata)[1].
Écologie et comportement
L'espèce est sédentaire. Les adultes sont actifs de jour comme de nuit et se rencontrent toujours à proximité de points d'eau[2]. Leur activité est liée à la température, ainsi qu'à l'humidité de l'air. Quand la température est inférieure à 7 degrés ou que l'humidité est insuffisante (inférieure à 45 %), les adultes trouvent refuge dans des abris divers (sous des pierres, amas de feuilles) et deviennent inactifs[2] - [14] - [8]. L'hivernage et l'estivation sont principalement conditionnés par l'action asséchante du mistral[15].
Une observation de 1998 permet également d'avancer l'hypothèse que lors de fortes pluies, pouvant aboutir à une crue, les individus seraient capables de quitter le bord de l’eau pour gagner des endroits à l’abri de la crue potentielle, deux juvéniles ayant été observés très au-dessus du niveau de la rivière, alors que les précipitations étaient importantes[11]. Cette observation concerne cependant l'espèce proche Discoglossus montalentii et n'est restée qu'au stade de l'hypothèse. Une autre hypothèse mentionne la possible capacité des individus à s'enterrer dans le lit encore humide des cours d'eau en été[11].
Reproduction
La saison de reproduction s'étale sur presque toute l'année, de fin février à novembre-décembre[4]. Le chant du mâle est peu audible et ressemble à un grognement guttural[1], à une stridulation monotone de 20 secondes au maximum[11]. Il est émis de nuit et sous l'eau et est produit durant les phases d'inspiration et d'expiration[16]. Seuls les mâles effectuent des cris d'accouplement. Les analyses révèlent que le chant consiste en deux groupes d'impulsion disposés en série et que la durée de ce chant dépend de la température de l'eau, ainsi que de la taille des mâles chanteurs[16]. Quelques légères différences de chants ont été relevées entre les individus corses et les individus sardes, à l'aide de matériel d'enregistrement[17].

L’amplexus est rapide et lombaire (les pattes antérieures du mâle encerclent la taille de la femelle au niveau des membres postérieurs) et se forme de jour comme de nuit, mais se produit généralement au crépuscule[5] - [2]. Les callosités nuptiales présentes sur ses doigts aident le mâle à maintenir sa prise[4].
Les pontes, au nombre de deux à quatre par an, s’échelonnent majoritairement entre avril et juin, mais peuvent intervenir plus tôt, dès fin janvier, ou plus tard dans l’année, jusqu'en novembre[2]. Les œufs, dissociés, de plusieurs centaines par ponte (entre 300 et 1500), sont déposés sur des plantes aquatiques ou au fond de l’eau, dans des zones souvent ombragées et forment habituellement des nappes et non des amas[18] - [11]. Ils donnent naissance à des têtards en une dizaine de jours[2], voire moins, l'éclosion ayant parfois lieu au bout de 3 jours[8]. Il est à noter que les spermatozoïdes sont très peu mobiles, ce qui entraîne un fort pourcentage d'œufs non fécondés, pouvant atteindre jusqu'à 60 % du total[8]. La durée du développement larvaire varie de 30 à 45 jours en fonction des ressources alimentaires, de la température de l'eau et de la salinité. Le développement est accéléré par la salinité de l'eau, les têtards pouvant en effet se développer dans des eaux saumâtres (contenant jusqu'à 5 grammes de NaCl par litre)[2]. Les jeunes s'éloignent peu de leur lieu de naissance. Ils mesurent 16 mm à 1 an, 30 mm à 2 ans et 45 mm à 3 ans[8]. La maturité sexuelle du Discoglosse sarde est atteinte à la fin de la troisième année de développement[2].

À titre d'exemple, sur le site de l'Ospedale en Corse (945 mètres d'altitude), les adultes sont actifs dès le mois de mars, lorsque la température de l’eau est de 6 degrés et jusqu’en octobre[7]. Les œufs sont pondus de fin avril à fin mai, sur un substrat rocheux, lorsque la température de l’eau est supérieure à 11 degrés. Les têtards sont quant à eux observés de mai à août et la métamorphose se produit de fin juin à fin août[7]. En comparaison, sur la côte nord occidentale (550 mètres à 720 mètres d'altitude), la ponte est légèrement plus longue, allant de mi-avril à la troisième semaine de juin[10]. Sur le Rizzanese et le Fiumicicoli (80 mètres à 200 mètres d'altitude), les pontes sont déjà écloses entre la mi-mars et le début du mois d’avril[19]. Enfin, des relevés ont également été effectués dans la vallée d'Asco et les dates de ponte sont les suivantes : le à 350 mètres d'altitude, le à 500 mètres d'altitude, le à 800 mètres d'altitude et pas avant le à 1 000 mètres d'altitude[11].
Les pontes étant étalées sur une longue période, on peut observer simultanément des pontes, des têtards et des adultes sur un même site[4].
La longévité de l’adulte est d'au moins 9 ans[2] et possiblement de 15 ans[15].
Alimentation et prédateurs
Le Discoglosse sarde est un prédateur opportuniste, qui consomme de nombreuses proies différentes, mais est spécialisé dans la capture d'individus de petite taille[2]. Les adultes se nourrissent principalement d'invertébrés terrestres, notamment d'isopodes (14 % du total des proies ingérées), de larves de diptères (10 %) et d'araignées (9 %). Les espèces aquatiques représentent qualitativement moins d'un tiers des proies capturées (moins de 15 % en volume)[7]. En détail, des études réalisées sur l'espèce montrent qu'elle consomme, en milieu aquatique, quelques larves et adultes de coléoptères aquatiques (hors dytiques), des larves de trichoptères, quelques adultes d'hétéroptères et, en milieu terrestre, des isopodes, des myriapodes, des araignées, des gastéropodes, quelques collemboles, quelques diptères, coléoptères, fourmis et larves de lépidoptères, ainsi que des oligochètes[20].
Une comparaison entre les niches écologiques du Discoglosse sarde, du Discoglosse corse et de l'Euprocte corse (Euproctus montanus) montre que le Discoglosse sarde est celui qui a la plus grande largeur de niche écologique[20]. L'espèce peut faire preuve de cannibalisme, notamment de la part d'adultes sur de jeunes individus. Les têtards se nourrissent quant à eux de débris végétaux et d'algues[7].

Les jeunes et les adultes peuvent être prédatés par des carnivores divers, dont le Sanglier (Sus scrofa) et le sont notamment par des serpents, tels que la Couleuvre à collier de Corse (Natrix helvetica corsa), la Couleuvre verte et jaune (Hierophis viridiflavus), ainsi que la Couleuvre vipérine (Natrix maura) sur l'île du Levant[21]. Sur l'île de Port-Cros, la prédation par la Couleuvre de Montpellier (Malpolon monspessulanus) est également possible sur les adultes, tandis que les jeunes peuvent aussi être consommés par le Lézard des murailles (Podarcis muralis)[22] - [15].
Les têtards ont quant à eux un grand nombre de prédateurs, comme des insectes aquatiques carnivores et surtout des poissons, indigènes, comme la Truite commune (Salmo trutta) en Corse, mais aussi introduits, comme le Gambusie (Gambusia affinis) en Corse et à Port-Cros ou le Rotengle (Scardinius erythrophtalmus) à Port-Cros[21]. D'autres amphibiens peuvent aussi prédater les têtards, comme l'Euprocte corse (Euproctus montanus)[21] - [20]. Enfin, des oiseaux migrateurs peuvent aussi consommer les œufs et les larves[15].
Habitat

L'espèce se rencontre à proximité de l'eau et n'est pas très exigeante dans les habitats occupés. Elle présente une amplitude écologique assez étendue et se retrouve dans des habitats divers, allant de mares temporaires aux ruisseaux lents, en passant par les réservoirs d'eau et ce quels que soient les milieux environnants (maquis aride ou forêt humide de conifères)[1] - [2], privilégiant toutefois les zones bordées de végétation[11]. Elle fréquente également les marais côtiers plus ou moins saumâtres (les têtards peuvent s'y développer) et ce dès le niveau de la mer, les fontaines, ainsi que les canaux d'irrigation, les flaques, les ornières et les torrents de montagne, jusqu'à 1 300 mètres en Corse et près de 1 800 mètres en Sardaigne[1] - [2] (1 770 mètres précisément, dans la vallée de Tavignano)[23] - [8]. Alors qu'elle préfère habituellement les endroits frais, l'espèce peut néanmoins se rencontrer dans des eaux dont la température est élevée dans la journée, par ailleurs fortement colonisée par des algues[11]. Elle présente une grande tolérance, notamment aux facteurs d'oxygène dissous de l'eau[11].
Elle est aussi capable de s'adapter à des milieux perturbés ou modifiés par l'action humaine et se reproduit par endroits dans des biotopes plus ou moins artificiels. Elle tolère par ailleurs les pollutions organiques légères[2].
Plusieurs habitats classés dans le référentiel EUNIS (European Union Nature Information System) abritent cette espèce[2]. C'est le cas des mares temporaires méditerranéennes (code EUNIS 3170), habitat prioritaire à l'échelle nationale[24], considérée à très fort enjeu et en mauvais état de conservation en région PACA[25], des rivières des étages planitiaire à montagnard avec végétation du Ranunculion fluitantis et du Callitricho-Batrachion (code EUNIS 3260) et des rivières intermittentes méditerranéennes du Paspalo-Agrostidion (code EUNIS 3290)[2].
Répartition
Cette espèce est considérée comme une tyrrhénienne endémique et se rencontre uniquement sur certaines îles de Méditerranée occidentale, notamment en Sardaigne et en Corse[26] - [1], où elle s'observe dans la plupart des régions, du cap Corse à l'extrême-sud de l'île[11] - [8].
Elle se retrouve également sur quelques petites îles annexes à la Sardaigne (îles de Caprera, La Maddalena, San Pietro et Asinara) et à la Corse (îles Lavezzi), ainsi que sur l'archipel toscan, sur l'île de Giglio, l'île de Montecristo et sur la péninsule de Monte Argentario[1], la seule station continentale d'origine naturelle de l'espèce[27].
De plus, l'espèce se rencontre également dans le département du Var, sur deux des îles d'Hyères, l'île de Port-Cros et l'île du Levant[26] - [1]. Sur Port-Cros, l'espèce ne se rencontre que sur quelques sites : le vallon de la Fausse Monnaie, le vallon de la Solitude, le bassin versant de Notre-Dame, au moins un des oueds côtiers de Port-Man, ainsi que la Pointe de Marma et Calanque Longue (au nord-ouest de l'île)[28]. Quelques autres secteurs ont été connus, mais ne sont plus occupés en 2018 : le vallon du Janet (dernière mention connue en 2015), le vallon de Port-Man (dernière mention connue en 2016) et huit petits points d’eau artificiels de type puits (dernière mention connue en 2001), ces derniers étant tous à sec lors des prospections[28]. De plus, l'espèce a aussi été notée dans les eaux saumâtres de la roselière du Manoir, où la reproduction est potentiellement forte, mais très irrégulière, ainsi que dans des zones humides du bord de mer et dans le vallon Noir[15]. Enfin, l'espèce s'est aussi reproduite dans la retenue du barrage en 2002 et s'y reproduit régulièrement depuis[15]. Sur le Levant, l'espèce est présente dans des effectifs bien moindres et est limitée par le très faible nombre de sites de reproduction potentiels. Ces derniers sont de petite taille, isolés les uns des autres et sont tous situés dans la partie ouest de l'île[15].
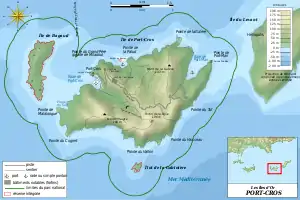
Enfin, une population introduite, originaire de Corse (identifiée par variation génétique du gène mitochondrial du cytochrome b), est implantée sur le continent depuis au moins 2011, dans le département des Bouches-du-Rhône, sur la commune de Marseille[27] - [23]. Il s'agit de la seconde population continentale de l'espèce. L'effectif maximal observé sur cette station est de 60 individus en 2018, dont des têtards[27], et la surface concernée par la présence de l'espèce est estimée à 0,66 km2. L'introduction accidentelle d'individus sur une zone non incluse dans l'aire de répartition originelle de l'espèce pose un problème de conservation difficile à résoudre, l'espèce étant intégralement protégée[27].
Des têtards issus de la population de l’île de Port-Cros ont été introduits dans un affluent de la Môle, dans le Var, à titre expérimental en 1955, aboutissant sur une population reproductrice, présente au moins jusqu’en 1959[14].
Dénomination et phylogénie
Origine évolutive
La distance génétique, calculée selon le modèle de Nei, sur la base de 35 locus, indique 0,92 entre Discoglossus sardus et Discoglossus montalentii, 1,06 entre Discoglossus montalentii et Discoglossus pictus et 0,42 entre Discoglossus sardus et Discoglossus pictus. Cela signifie que le Discoglosse sarde (Discoglossus sardus) est plus proche génétiquement du Discoglosse peint (Discoglossus pictus), espèce se rencontrant historiquement uniquement au Maghreb, en Sicile et à Malte (également introduite en Espagne et dans le sud de la France), que du Discoglosse corse (Discoglossus montalentii), pourtant très proche morphologiquement et vivant dans la même zone géographique[13].

La spéciation des espèces du genre Discoglossus s'est produite par isolement géographique, comme l'attestent des preuves paléobiogéographiques et génétiques[13]. Le genre est originaire du Miocène supérieur[29]. L'hypothèse évolutive la plus plausible est que l'ancêtre du Discoglosse corse (Discoglossus montalentii) a atteint la Corse depuis le sud de la France par le passage libéré lors de l'assèchement de la mer Méditerranée au cours de la crise de salinité messinienne, il y a 5,33 millions d'années[13]. L'origine du Discoglosse sarde (Discoglossus sardus) semble être beaucoup plus récente, car l'espèce a probablement atteint la Corse et la Sardaigne depuis la Toscane, par l'intermédiaire d'un pont terrestre formé au cours d'une des régressions marines, il y a 1 à 2 millions d'années[13]. À l'exception de celle du Discoglosse corse, plus ancienne, toutes les spéciations ayant abouti aux espèces actuelles du genre Discoglossus ont eu lieu plus ou moins de manière simultanée et la spéciation est allopatrique[29].
Génétique
Des études génétiques publiées en 2020 révèlent que les populations de Corse et celles de Sardaigne ne sont pas réciproquement monophylétiques à base d’ADN mitochondrial. En effet, un individu de Corse (col de Eustache) est, contre toute attente, regroupé avec les haplotypes sardes[27].
Le Discoglosse sarde et le Discoglosse corse peuvent s'hybrider, comme cela a déjà été effectué en laboratoire, mais cela est très rare dans la nature, en raison du mécanisme d’isolement éthologique (chants différents des mâles chez les deux espèces), qui empêche le croisement entre les deux espèces[2] - [7].
Le Discoglosse sarde possède 2n = 28 chromosomes bi-armés, comme presque toutes les espèces du genre, avec les organisateurs nucléolaires (NOR) situés sur le bras court de la septième paire de chromosome[30].
Étymologie et dénomination
Le seul nom vernaculaire français valide est « Discoglosse sarde »[2], mais on retrouve parfois le nom « Grenouille peinte tyrrhénienne »[4]. En anglais, l'espèce est nommée Tyrrhenian Painted Frog[26] ou Sardinia Painted Frog[26] et en italien Discoglosso sardo[31].
Le nom vernaculaire est une francisation du nom latin. Pour ce dernier, discoglossus est issu du grec dίskos qui signifie « disque » et glôssa qui signifie « langue ». Cela fait référence à la langue de cet amphibien, de forme circulaire[4]. Quant au latin sardus il signifie « de Sardaigne », localité dans laquelle il a d'abord été identifié[4].
Taxinomie

L'espèce est décrite par le naturaliste suisse Johann Jakob von Tschudi en 1837[32]. La description originale de l'espèce est publiée dans un article du naturaliste suisse Carl Adolf Otth, intitulé « Beschreibung einer neuen europäischen Froschgattung, Discoglossus » (Description d'un nouveau genre de grenouilles européennes, Discoglossus), dans le périodique Neue Denkschriften der Allgemeinen Schweizerischen Gesellschaft für die Gesammten Naturwissenschaften (Nouveaux mémorandums de la Société générale suisse pour l'ensemble des sciences naturelles)[32].
Discoglossus sardus a pour synonymes[33] :
- Dicoglossus pictus sardus Tschudi, 1837 ;
- Discoglossus pictus sardoa (Gené, 1838) ;
- Discoglossus pictus sardus Tschudi, 1837 ;
- Discoglossus sardous (Gené, 1838) ;
- Pseudes sardus (Tschudi, 1837) ;
- Pseudis sardoa Gené, 1838 ;
- Rana sardoa (Gené, 1838) ;
- Rana sardus (Tschudi, 1837).
Menaces et conservation
Statut de conservation
L'Union internationale pour la conservation de la nature (UICN) considère que l'espèce est en « préoccupation mineure » (LC)[23]. L'espèce n'est pas fortement menacée à court terme[2].
Cependant, l'espèce est inscrite en « vulnérable » (VU) sur la liste rouge des amphibiens et reptiles de Provence-Alpes-Côte d'Azur, où les populations des Îles d'Hyères sont très réduites et isolées de l'effectif principal, situé en Corse[34] - [35]. Sur la liste rouge des amphibiens de Corse, l'espèce est considérée comme « quasi-menacée » (NT)[36]. L'état de conservation de l'espèce est jugé « défavorable inadéquat » d'après les critères de la Directive Habitats Faune Flore du réseau Natura 2000[37].
En Italie, l'espèce est inscrite en tant que « vulnérable » (VU) sur la liste rouge des vertébrés d'Italie[38].
Menaces
Différentes menaces pèsent sur le Discoglosse sarde, certaines sur la population dans son ensemble et d'autres uniquement sur certaines sous-populations de plus petite taille.
L'espèce, dans sa globalité, ne semble pas sérieusement menacée par l'expansion des activités humaines[39]. Cependant, la destruction de ses habitats de prédilection constitue une menace sérieuse. En effet, les zones humides de petite taille sont très vulnérables aux aménagements et aux drainages, aux comblements, curages et endiguement des cours d'eau qui les alimentent, aux plantations artificielles, à la rectification des berges, ainsi qu'à la canalisation destinée à l'urbanisation et aux pollutions diverses[2] - [3]. La destruction directe d'individus par écrasement lors de travaux est également un risque important, tout comme le dérangement direct par la présence humaine (bruit, piétinement) ou le dérangement indirect du aux outils de travaux[3]. Même si l'espèce tolère de légères pollutions, une dégradation trop importante de la qualité de l'eau peut également être néfaste[3]. Le piétinement engendré par le bétail sur les zones humides abritant l'espèce peut également s'avérer néfaste pour cette dernière[40]. L'alevinage des truites dans certains cours d'eau est aussi un facteur défavorable pour le maintien de l'espèce au stade de têtards[41]. L'absence de débroussaillage aux abords des cours d'eau peut s'avérer néfaste au développement des larvaire du Discoglosse sarde, réduisant l'ensoleillement propice aux œufs et larves[15]. Enfin, la présence de la plante exotique envahissante (EEE) qu'est l'Herbe de la pampa (Cortaderia selloana) entraîne l'assèchement précoce des zones humides favorables à la reproduction de l'espèce et participe aussi à la fermeture du milieu, notamment sur l'île du Levant[15]. Sur cette même île, l'introduction de la Grenouille rieuse (Pelophylax ridibundus) constitue également une menace potentielle pour le maintien de la population présente sur l'île[23].
Globalement, la tendance actuelle de la population est à la décroissance[23]. L'espèce reste tout de même encore relativement commune en Sardaigne et en Corse (en 1999, l'espèce n'y est pas considérée comme rare[21]). Cette île abrite probablement les plus importantes populations de l'espèce[2] - [8].
Les populations les plus vulnérables sont celles situées sur les îles et îlots de petite taille, dont les populations sont isolées génétiquement et qui constituent des effectifs plus modestes. De plus, sur ces territoires de petite taille, les sites potentiels de reproduction sont limités[2]. C'est notamment le cas sur les îles Lavezzi, où l'espèce ne se rencontre que sur un unique point d'eau de 10 m2[2].

Sur les îles d'Hyères, la population est également réduite et en diminution. En 1956, elle était estimée à environ 5 000 adultes (pour un total de plus de 3 500 dénombrés)[42], tandis qu'elle est estimée à environ 2 000 individus en 2008[15]. Sur l'île du Levant, la population dénombrée n'excède pas 250 adultes en 2008 et est considérée comme très menacée à court terme[15]. En 2005, la densité estimée d'individus reproducteurs sur Port-Cros est de 27,5 individus pour 100 mètres[43]. Les relevés de 2018 montrent une forte régression des populations sur l'île de Port-Cros par rapport à 1956, de l'ordre de 25 à 43 fois moins dans le vallon de Notre-Dame, de 122 à 244 fois moins dans le vallon de la Fausse Monnaie et de 115 à 279 fois moins dans le vallon de la Solitude[28]. En 1956, les jeunes individus sont notés comme très abondants, alors qu'en 2018, ils ne représentent plus qu'entre 4 % et 14 % des contacts[28]. Différents facteurs expliquent ce déclin significatif en un peu plus de soixante ans, notamment l’introduction de poissons prédateurs du genre Gambusia en 1992, notamment dans le barrage[44] (éliminés en fin 2001), ainsi que l'arrivée spontanée du Sanglier (Sus scrofa) en 2007[34], dont la population s'est développée sur l'île à partir de 2013, pour atteindre entre 40 et 45 individus en 2017[28]. Ce dernier prédate en effet différents amphibiens, dont le Discoglosse sarde sur l'île[45], notamment parce que les ressources alimentaires sont y sont limitées. D'autre part, l'aménagement de seuils en pierre sèche dans le lit des ruisseaux temporaires a entraîné une raréfaction des sites de reproduction favorables[15]. Une remontée des effectifs a été constatée sur l'île de Port-Cros, notamment entre 1996 et 2001 en raison de cumuls de pluie importants, ayant entraîné le maintien en eau des sites de ponte, ce qui laisse présager qu'une partie de la réussite de la reproduction d'une année sur l'autre est liée à la répartition de la pluviométrie, qu'il n'est pas possible de gérer[15].
Le changement climatique est également une menace plus globale, qui concerne également la population des îles d'Hyères, les assecs prolongés étant de plus en plus fréquents et pouvant nuire au bon déroulement de la reproduction[28].
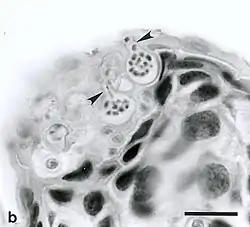
Enfin, une autre menace concerne l'espèce : la présence du chytridiomycète Batrachochytrium dendrobatidis, un champignon pathogène et parasite, responsable de la chytridiomycose, une maladie de peau pouvant être mortelle chez les amphibiens et responsable du déclin et de la disparition de nombreuses espèces à travers le monde[34] - [46]. Ce champignon est capable de parasiter presque l'ensemble des espèces d'amphibiens à travers le monde[47]. Il se développe entre 6 degrés et 28 degrés, avec un optimum thermique situé entre 17 degrés et 23 degrés[48]. Les amphibiens adultes touchés dans la forme mortelle de la maladie présentent une desquamation de la peau, particulièrement au niveau des membres et du ventre[46]. La maladie touche également les têtards, mais n'est pas systématiquement mortelle lors de ce stade. Différentes lignées du champignon, avec une virulence variable, existent à travers le monde, la lignée responsable des vagues de mortalité étant la lignée bd-GPL[46].
En Corse, des prélèvements ont été effectués sur les populations d'amphibiens en 2009 et ont révélé la présence du pathogène, particulièrement présent chez l'Euprocte corse, ainsi que chez les deux espèces de Discoglosses présentes sur l'île[46]. Aucun cas de lésion ou de mortalité liée au champignon n'a été relevé sur l'île (en date de 2015). Sur l'île de Port-Cros, le champignon a été détecté sur cinq individus en 2011 (sur un total de 30 individus testés), mais n'a pas été retrouvé en 2017[28]. Enfin, en Sardaigne, plusieurs cas de mortalité sont observés chez le Discoglosse sarde entre 2006 et 2008 et sont imputés au champignon pathogène[49]. Trois sites sont concernés (Laghetto dei Pompieri, Monte Olia et Affluente Pisciaroni), dans le Monte Limbara, au nord de l'île. Plusieurs dizaines d'individus, certains au stade larvaires et d'autres au stade adulte, sont retrouvés morts[49]. Il s'agit du premier cas de mortalité dû à la chytridiomycose en dehors d'Espagne[49], où la maladie est bien implantée. La localisation des épisodes de mortalité est également surprenante, car l'habitat ne correspond pas aux occurrences classiques d'apparition du pathogène, les cours d'eau étant à sec l'été, alors qu'habituellement, les épisodes de mortalité dus à la maladie ont lieu dans des sites où la présence d'eau est permanente[49].
Conservation
L'espèce est strictement protégée en France par l'article 2 de l'arrêté du fixant la liste des amphibiens et des reptiles représentés sur le territoire métropolitain protégés sur l'ensemble du territoire national et les modalités de leur protection[50]. Il est interdit de détruire ou d'enlever des œufs et des nids, ainsi que de détruire, mutiler, capturer ou enlever un individu. Il est aussi interdit de perturber intentionnellement des animaux, pour autant que la perturbation remette en cause le bon accomplissement des cycles biologiques de l'espèce considérée. La destruction, l'altération ou la dégradation des sites de reproduction et des aires de repos des animaux est également proscrite. Enfin, la détention, le transport, la naturalisation, le colportage, la mise en vente, la vente ou l'achat, l'utilisation, commerciale ou non, des spécimens prélevés est également interdite en France[50].
En Italie, l'espèce est également protégée, par la loi n°503 de 1981 (annexe 2), qui est l'application de la Convention de Berne sur le territoire national[51].
L'espèce est également inscrite en annexe 2 (faune) de la convention de Berne, une convention internationale qui a pour but d'assurer la conservation de la vie sauvage et du milieu naturel de l'Europe[2].
Enfin, l'espèce est inscrite en annexe 2 (espèces de faune et de flore d'intérêt communautaire) et annexe 4 (mesures nécessaires à une protection stricte des espèces de l'annexe) de la directive « Habitats Faune Flore » du réseau Natura 2000, qui a pour objectif de maintenir la diversité biologique des milieux de l'Union européenne, tout en tenant compte des exigences économiques, sociales, culturelles et régionales dans une logique de développement durable[2].
Différentes mesures de gestion sont prises pour garantir le bon état des populations de l'espèce, particulièrement lorsqu'elle se trouve dans des espaces naturels protégés, comme c'est le cas dans le parc national de Port-Cros, sur les îles d'Hyères, ou encore dans les zones Natura 2000, soumises à des documents d'objectifs (DOCOB), un document de diagnostic et un document d’orientation pour la gestion des sites Natura 2000. Sur les îles d'Hyères, dans le cadre du document d'objectif des sites Natura 2000, plusieurs mesures spécifiques de conservation sont identifiées et à mettre en place, notamment la création de petites retenues d'eau propices à la reproduction, l'entretien des sites de ponte déjà existants et leur restriction d'accès, l'éradication des poissons introduits (uniquement sur l'île du Levant où ils sont présents sur trois des quatre retenues collinaires), l'aménagement des berges des retenues d'eau et l'éradication de l'Herbe de la pampa sur l'île du Levant, ainsi que la sensibilisation à la présence de l'espèce auprès du grand public et des occupants des îles (habitants, professionnels du tourisme, militaires, etc.)[15].
En Corse, la préservation du Discoglosse sarde dépend principalement du maintien d'un réseau hydrographique de qualité. Il est également important de conserver, voire de restaurer les petites zones humides du littoral pour augmenter le nombre de sites favorables à l'espèce[2].
En Italie, l'espèce est présente dans plusieurs espaces naturels protégés et bénéficie ainsi de la gestion et de la protection qui y sont associées. C'est le cas sur l'île de Montecristo, qui est une réserve intégrale[52], incluse dans le parc national de l'archipel toscan[53], du parc national de l'archipel de La Maddalena et du parc national du Golfe d'Orosei et du Gennargentu, ainsi que du parc régional des sept frères - Mont Genis, tous les trois situés en Sardaigne[23].
Voir aussi
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- Jeroen Speybroek, Wouter Beukema, Bobby Bok et Jan Van Der Voort (trad. de l'anglais), Guide Delachaux des amphibiens et reptiles de France et d'Europe, Paris/impr. en Chine, Delachaux et Niestlé, , 432 p. (ISBN 978-2-603-02534-5), p. 127-130-131.

Liens externes
- (en) Référence Amphibian Species of the World : Discoglossus sardus Tschudi, 1837 (consulté le )
- (en) Référence AmphibiaWeb : espèce Discoglossus sardus (consulté le )
- (en) Référence Animal Diversity Web : Discoglossus sardus (consulté le )
- (en) Référence Catalogue of Life : Discoglossus sardus Tschudi in Otth, 1837 (consulté le )
- (en) Référence Fauna Europaea : Discoglossus sardus Tschudi, 1837 (consulté le )
- (fr+en) Référence GBIF : Discoglossus sardus Tschudi, 1837 (consulté le )
- (fr) Référence INPN : Discoglossus sardus Tschudi in Otth, 1837 (TAXREF) (consulté le )
- (en) Référence IRMNG : Discoglossus sardus Tschudi in Otth, 1837 (consulté le )
- (fr+en) Référence ITIS : Discoglossus sardus Tschudi in Otth, 1837 (consulté le )
- (en) Référence NCBI : Discoglossus sardus (taxons inclus) (consulté le )
- (en) Référence Tree of Life Web Project : Discoglossus sardus (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- (en) Référence UICN : espèce Discoglossus sardusTschudi, 1837 (consulté le )
Notes et références
- Speybroek, Beukema, Bok et Van Der Voort (2018)
- F. Bensettiti et V. Gaudillat, « Cahiers d'habitats Natura 2000. Connaissance et gestion des habitats et des espèces d'intérêt communautaire. Tome 7. Espèces animales », La Documentation française, , p. 159–161 (lire en ligne [PDF], consulté le )
- DREAL PACA, pôle Natura 2000, « Fiches d’information synthétiques - E1190 - Discoglosse sarde », Documentation DREAL PACA, (lire en ligne [PDF], consulté le )
- J-P. Corolla, D. Buron et F. André, « Fiche Discoglossus spp. Discoglossus sardus », Fiches DORIS, (lire en ligne, consulté le )
- R. Fleuriau et V. Bosc, « Suivi des populations de Discoglosses sur la zone d’emprise du barrage du Rizzanese en vue de leur conservation – Phase 1 », Pulication du CEN Corse, (lire en ligne [PDF], consulté le )
- (en) B.T. Clarke et B. Lanza, « Notes on the morphology and distribution of the Corsican Painted Frogs : Discoglossus sardus Tschudi and D. montalentii Lanza, Nascetti, Capula & Bullini », Bull. Mus Reg. Sci. Nat., Torino, vol. 8, , p. 531-544 (lire en ligne [PDF], consulté le )
- S. Salvidio, R. Sindaco et L. Emanueli, « Etude de l’écologie et de la protection des Discoglosses en Corse », Rapport final à la Diren-Corse, Universita’di Genova Institute di Zoologia, , p. 130
- PNRC et BE Biotope, « Document d’objectif du site Natura 2000, Zone Spéciale de Conservation FR9400611 : Massif du Renoso », Documentation Natura 2000, , p. 358 (lire en ligne [PDF], consulté le )
- (it) B. Lanza, « Guide per il riconoscimento delle specie animali delle acque interne Italiane. 27. Anfibi, Rettili (Amphibia, Reptilia) », CNR, Collana del Progetto Finalizzato « Promozione della Qualità dell’Ambiente », vol. AQ/1/205, , p. 23-37
- J. Kostenzer, « Contribution à la répartition de Discoglossus montalentii et Discoglossus sardus en Corse », Rapport à la Diren-Corse, , p. 12
- J. Kostenzer, « Données complémentaires sur la répartition de Discoglossus montalentii et Discoglossus sardus (Amphibiens, Anoures) en Corse », Bulletin de la Société herpétologique de France, vol. 122, , p. 19-31 (lire en ligne, consulté le )
- (it) E. Capanna, « Albinismo parziale in una popolazione insulare di Discoglossus Sardus Tschudi », Italian Journal of Zoology, vol. 36, , p. 135-141 (lire en ligne, consulté le )
- (en) B. Lanza, G. Nascetti, M. Capula et L. Bullini, « Genetic relationships among west mediterranean discoglossus with the description of a new spiecies (Amphibia Salientia Discoglossidae) », Monitore Zoologico Italiano - Italian Journal of Zoology, , p. 133-152 (lire en ligne, consulté le )
- L.-P. Knoepffler, « Contribution à l’étude du genre Discoglossus (Amphibiens Anoures) », Vie et Milieu, vol. 13, , p. 1–94 (lire en ligne, consulté le )
- Parc national de Port-Cros, « Document d'Objectifs Natura 2000 - La Côte d'Hyères et son archipel (FR9301613), les Iles d'Hyères (FR9310020) - Document d’Objectifs Volume II « Application et mesures de gestion » », Documentation Natura 2000, , p. 960 (lire en ligne, consulté le )
- (de) E. Weber et H. Schneider, « Artspezifische Paarungsrufe bei Discoglossus pictus Otth, 1837 und Discoglossus sardus Tschudi, 1837 (Discoglossidae, Anura) », Zeitschrift für Naturforschung, vol. 26, , p. 1055-1057 (lire en ligne, consulté le )
- (en) F. Glaw et M. Vences, « Bioacoustic differentiation in Painted frogs (Discoglossus) », Amphibia-reptilia, vol. 12, , p. 385-394 (lire en ligne [PDF], consulté le )
- C. Miaud et J. Muratet, Identifier les oeufs et les larves des amphibiens de France. Techniques et pratiques, INRA Édition, , 200 p. (lire en ligne)
- V. Bosc et R. Fleuriau, « Etude des Discoglossidés sur la zone d’emprise du barrage du Rizzanese en vue de leur conservation Inventaires des populations à l’amont du barrage : bassins versants des ruisseaux du Codi et du Saint Antoine (Corse du Sud, communes de Sorbollano, Levie, Zoza, Altagène et Sainte Lucie de Tallano) », AAPNRC, EDF GDF Corse, , p. 36
- (en) S. Salvidio, R. Sindaco et L. Emanueli, « Feeding habits of sympatric Discoglossus montalentii, Discoglossus sardus and Euproctus montanus during the breeding season », Herpetological Journal, vol. 9, , p. 163-167 (lire en ligne, consulté le )
- M. Delaugerre, « Plan de restauration des Discoglosses corse et sarde (Amphibiens, Anoures, Discoglossidés). État des connaissances. Rapport final », Agence pour la gestion des espaces naturels de Corse, direction de la nature et des paysages, , p. 29
- J. Gagliardi, « Protection de la faune du parc national de Port-Cros : Thèse pour le doctorat vétérinaire », Thèse d'excercice, , p. 30-31-62-65
- (en) UICN, consulté le 17 mai 2021
- F. Bensettiti, V. Gaudillat et J. Haury, « « Cahiers d'habitats » Natura 2000. Connaissance et gestion des habitats et des espèces d'intérêt communautaire. Tome 3 - Habitats humides. - Fiche sur les mares temporaires méditérranéennes », La Documentation française, , p. 139-141 (lire en ligne [PDF], consulté le )
- DREAL PACA, pôle Natura 2000, « Fiches d’information synthétiques - H3170 - Mares temporaires méditérranéennes », Documentation DREAL PACA, (lire en ligne [PDF], consulté le )
- Amphibian Species of the World, consulté le 9 juin 2021
- (en) J. Renet, R. Duguet, M. Policain, A. Piquet, V. Fradet, P. Priol, G. Deso, F. Grimal, G. Sotgiu et M. Vences, « Alien populations of painted frogs, genus Discoglossus, on the southeastern coast of France: two examples of anthropogenic introduction », Amphibian & Reptile Conservation, vol. 14(3), , p. 189–199 (lire en ligne [PDF], consulté le )
- R. Duguet, P. Priol, G. Deso et D. Geoffroy, « Mise à jour des connaissances sur le Discoglosse sarde Discoglossus sardus Tschudi in Otth, 1837 dans l'île de Port-Cros en 2018 : habitats potentiels, état de la population et mesures de gestion », Scientific reports of the Port-Cros national park, vol. 33, , p. 101-126 (lire en ligne, consulté le )
- (en) M. Pabijan, A. Crottini, D. Reckwell, I. Irisarri, JS. Hauswaldt et M. Vences, « A multigene species tree for Western Mediterranean painted frogs (Discoglossus) », Mol Phylogenet Evol., vol. 64, , p. 690-6 (lire en ligne, consulté le )
- (en) G. Odierna, G. Aprea, T. Capriglione, P. Parisi, O. Arribas et M.A. Morescalchi, « Chromosomal and molecular analysis of some repeated families in Discoglossus Otth, 1837 (Anura, Discoglossidae) : Taxonomic and phylogenetic implications », Italian Journal of Zoology, vol. 66, , p. 133-152 (lire en ligne, consulté le )
- « Sardegna Foreste - Sardegnaforeste - Flora e fauna - Fauna - Anfibi », sur web.archive.org, (consulté le )
- (de) C. Otth, « Beschreibung einer neuen europäischen Froschgattung, Discoglossus », Neue Denkschriften der Allgemeinen Schweizerischen Gesellschaft für die Gesammten Naturwissenschaften, vol. 1, , p. 1-8 (lire en ligne, consulté le )
- GBIF Secretariat. GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei accessed via GBIF.org, consulté le 17 mai 2021
- M.-A. Marchand, C. Roy, J. Renet, J. Delauge, D. Meyer et C. Hayot, « Liste rouge régionale des amphibiens et reptiles de Provence-Alpes-Côte d’Azur », Liste rouge régionale, , p. 16 (lire en ligne [PDF], consulté le )
- UICN France, MNHN et SHF, « La Liste rouge des espèces menacées en France - Chapitre Reptiles et Amphibiens de France métropolitaine », Liste rouge nationale, , p. 3 (lire en ligne [PDF], consulté le )
- J. Linossier, G. Faggio et V. Bosc, « Listes rouges régionales des oiseaux nicheurs, des reptiles et des amphibiens de Corse. Document de synthèse », Liste rouge régionale (CEN Corse), , p. 14 (lire en ligne [PDF], consulté le )
- Inventaire national du patrimoine naturel, « Résultats de l'évaluation Habitat Faune Flore du réseau Natura 2000 chez le Discoglosse sarde », Muséum national d'histoire naturelle (consulté le )
- (it) C. Rondinini, A. Battistoni, V. Peronace et C. Teofili, « Lista Rossa IUCN dei Vertebrati Italiani », Liste rouge nationale (Comitato Italiano IUCN e Ministero dell’Ambiente e della Tutela del Territorio e del Mare), , p. 56 (lire en ligne [PDF], consulté le )
- M. Delaugerre et M. Cheylan, Atlas de Répartition des Batraciens et Reptiles de Corse, L'Oikéma, , 128 p. (lire en ligne)
- P. Moneglia, A. Burguet-Moretti, E. Lair et A. M. Pastinelli, « Document d’objectifs du site Natura 2000 FR9400598 « Massif de Tenda et forêt de Stella » - Secteur de Stella », Documentation Natura 2000, , p. 104 (lire en ligne [PDF], consulté le )
- DREAL Corse, « Document d’objectifs du site Natura 2000 FR9402007 Site à Botrychium simplex et chaigneraies du Bozio - Tome 2 : Objectifs et Actions », Documentation Natura 2000, , p. 79 (lire en ligne [PDF], consulté le )
- LP. Knoepffler, « Port-Cros. Les reptiles, les amphibiens », Vie, Nature, Environnement, vol. 7, , p. 62-64
- A. Joyeux, Statut du Discoglosse sarde (Amphibien, Anoure) dans le Parc national de Port-Cros. Étude en vue de sa conservation, École pratique des hautes études, Laboratoire de Biogéographie des vertébrés, Faculté des sciences, Université de Montpellier, , 33 p.
- E. Pesme, « Etude de l’habitat reproducteur de Discoglossus sardus (Amphibien, Anoure) sur l’île de Port-Cros et élaboration d’un plan de gestion des milieux humides pour la conservation de cette espèce patrimoniale », Scientific reports of the Port-Cros national park, , p. 67
- (en) Kelly C. Jones, Thomas A. Gorman, Brandon K. Rincon et John Allen, « Feral swine Sus scrofa : a new threat to the remaining breeding wetlands of the Vulnerable reticulated flatwoods salamander Ambystoma bishopi », Oryx, vol. 52, no 4, , p. 669–676 (ISSN 0030-6053 et 1365-3008, DOI 10.1017/S0030605316001253, lire en ligne [PDF], consulté le )
- R. Fleuriau et V. Bosc, « Suivi des populations de Discoglosses sur la zone d’emprise du barrage du Rizzanese en vue de leur conservation – Phase 2 », Pulication du CEN Corse, (lire en ligne [PDF], consulté le )
- C. Miaud et C. Montgelard, « Prévalence et identification génétique d’un champignon parasite des amphibiens dans l’herpétofaune d’Alsace », BUFO, UMR CEFE-CNRS (EPHE),
- (en) J. Piotrowski, S. Annis et J. Longcore, « Physiology of Batrachochytrium dendrobatidis, a chytrid pathogen of amphibians », Mycologia, vol. 96, , p. 9-15 (lire en ligne, consulté le )
- (en) J. Bielby, S. Bovero et G. Sotgiu, « Fatal chytridiomycosis in the tyrrhenian painted frog », Ecohealth, vol. 6, , p. 27-32 (lire en ligne, consulté le )
- État français, « Arrêté du 8 janvier 2021 fixant la liste des amphibiens et des reptiles représentés sur le territoire métropolitain protégés sur l'ensemble du territoire national et les modalités de leur protection », Journal officiel de la République française, (lire en ligne, consulté le )
- (it) Etat italien, « LEGGE 5 agosto 1981, n. 503 », Journal officiel italien, (lire en ligne, consulté le )
- J.-C. Lefeuvre, « Rapport d'expertise du Comité pour les activités du Conseil de l’Europe en matière de diversité biologique et paysagère pour le renouvellement de la Réserve Naturelle de l’île de Montecristo (Italie) », Documentation de la Direction de la Culture et du Patrimoine culturel et naturel du Conseil de l'Europe, , p. 15 (lire en ligne, consulté le )
- (it) L. Lombardi, V. Cherici, P. Sposimo et B. Lastrucci, « Studio di indicenza - Piano del Parco nazionale Archipelago Toscano », Documentation de la région de Toscane, , p. 85 (lire en ligne, consulté le )
