Gaz moutarde
Le gaz moutarde est un composé chimique cytotoxique et vésicant qui a la capacité de former de grandes vésicules sur la peau exposée.
| Gaz moutarde | |||
  |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | 1-chloro-2‑[(2‑chloroéthyl)sulfanyl]éthane | ||
| Synonymes |
sulfure de 2,2'‑dichlorodiéthyle |
||
| No CAS | |||
| No ECHA | 100.209.973 | ||
| PubChem | |||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C4H8Cl2S [Isomères] |
||
| Masse molaire[1] | 159,077 ± 0,013 g/mol C 30,2 %, H 5,07 %, Cl 44,57 %, S 20,16 %, |
||
| Propriétés physiques | |||
| T° fusion | 13,5 °C[2] | ||
| T° ébullition | 216 °C[2] | ||
| Solubilité | 684 mg·l-1 dans l'eau à 25 °C[2] | ||
| Pression de vapeur saturante | 0,11 mmHg à 25 °C[2] | ||
| Précautions | |||
| Directive 67/548/EEC | |||
 T+  N |
|||
| Transport | |||
|
|||
| Classification du CIRC | |||
| Groupe 1 : Cancérogène pour l'homme[3] | |||
| Unités du SI et CNTP, sauf indication contraire. | |||
Mis au point par le chimiste allemand Fritz Haber[4], il a été particulièrement utilisé comme arme chimique visant à infliger de graves brûlures chimiques des yeux, de la peau et des muqueuses, y compris à travers les vêtements et à travers le caoutchouc naturel des bottes et masques, durant la Première Guerre mondiale et lors de plusieurs conflits coloniaux, puis, plus récemment, lors de la guerre Iran-Irak et pendant la guerre civile syrienne.
Sous sa forme pure et à température ambiante, c'est un liquide visqueux incolore et inodore qui provoque, après un certain temps (de quelques minutes à quelques heures), des cloques sur la peau. Il attaque également les yeux et les poumons.
Son nom vient du fait qu'une forme impure de ce gaz avait une odeur qui ressemblait à celle de la moutarde, de l'ail ou du raifort. Il est aussi nommé parfois ypérite (dérivé du nom de la ville d'Ypres (Ieper en flamand) en Belgique, où il fut utilisé massivement au combat en [5] après un premier test allemand contre les troupes britanniques à Ypres en juillet de la même année), moutarde au soufre, Kampfstoff LOST ou gaz LOST. Il peut être létal mais sa première fonction est d'être très fortement incapacitant.
Découverte et synthèses
Découverte
Aux alentours de 1822, le chimiste français César Despretz fait réagir du dichlorure de soufre et de l'éthylène mais ne mentionne pas d'effets du produit de réaction. Cette réaction est reproduite en 1854 par un autre chimiste français, Alfred Riche, qui ne décrit pas non plus de propriétés indésirables.
Il faut attendre 1860 et les travaux de Frederick Guthrie, un chimiste anglais, pour synthétiser et caractériser le gaz moutarde et identifier ses propriétés irritantes. La même année, le chimiste allemand Albert Niemann répète la réaction et constate des propriétés vésicantes de la molécule.
En 1886, Viktor Meyer publie un article proposant une synthèse de la molécule avec un bon rendement. Le 2-chloroéthanol réagit avec du sulfure de potassium aqueux pour former le thiodiglycol qui, en présence de trichlorure de phosphore, forme le gaz moutarde. Le rendement étant supérieur, les effets indésirables sur la santé en cas d'exposition sont accrus. Ces effets sont apparus sur l'assistant de Meyer et, afin d'exclure des symptômes psychosomatiques, le composé chimique est testé sur des lapins de laboratoire qui pour la plupart en moururent.
En 1913, le chimiste anglais Hans Thacher Clarke, alors qu'il travaille à Berlin dans le laboratoire d'Emil Fischer, remplace le trichlorure de phosphore par de l'acide chlorhydrique dans la réaction de Meyer. Il est hospitalisé pendant deux mois pour des brûlures après la rupture d'un de ses flacons de gaz moutarde. Selon Meyer, le rapport de Fischer sur cet accident à la Société chimique allemande a orienté l'Empire allemand sur la voie des armes chimiques.
Caractéristiques chimiques
Le sulfure de dichlorodiéthyle est une molécule symétrique à chaîne courte, avec un atome central de soufre et deux atomes de chlore aux deux extrémités, de formule chimique C4H8Cl2S , appartenant à la famille des thioéthers. Les composés avec l'élément structurel BC2H4X, où X est n'importe quel groupe partant et B est une base de Lewis, peuvent former des ions -onium cycliques (sulfonium, ammonium, etc.) qui sont de puissants agents alkylants.
Le gaz moutarde est un liquide visqueux à des températures normales. Le composé pur a un point de fusion de 14 °C et se décompose avant ébullition à 218 °C.
Synthèses
Avec la méthode Depretz, le dichlorure de soufre réagit avec de l'éthylène :
SCl2 + 2 C2H4 → (ClC2H4)2S
Avec la méthode de Meyer, le thiodiglycol est formé par la réaction entre le 2-chloroéthanol et du sulfure de potassium. La molécule forme en présence de trichlorure de phosphore le gaz moutarde.
3 (HOC2H4)2S + 2 PCl3 → 3 (ClC2H4)2S + 2 P(OH)3
Avec la méthode Meyer–Clarke, l'acide chlohydrique concentré (HCl) est employé à la place du PCl3 :
(HOC2H4)2S + 2 HCl → (ClC2H4)2S + 2 H2O
Le chlorure de thionyle et le phosgène, ce dernier étant également un agent suffocant, ont également été utilisés comme agents de chloration. Ces composés, en excès, restent sous forme d'impuretés dans le produit final et peuvent donc produire des mécanismes supplémentaires de toxicité.
L'acronyme allemand « LOST » vient de la combinaison des noms des deux chimistes allemands Lommel (LO) et Steinkopf (ST)[6] qui développèrent un procédé de production en masse pour l'utilisation militaire alors qu'ils travaillaient pour l'entreprise allemande Bayer AG.
Toxicité cellulaire
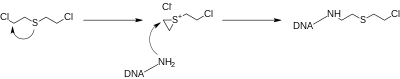
Les gaz moutarde au soufre réagissent facilement avec les ions chlorure en solution dans les cellules par substitution nucléophile intramoléculaire pour former des ions sulfonium cycliques. Ces intermédiaires très réactifs ont tendance à alkyler de façon permanente les nucléotides dans les brins d'ADN, empêchant la division cellulaire et entraînant la mort cellulaire programmée. Si la mort cellulaire n'est pas immédiate, l'ADN endommagé peut entraîner à terme le développement de cancers. Le stress oxydatif est une autre pathologie impliquée dans la toxicité du gaz moutarde.
Utilisation comme arme de guerre
Première Guerre mondiale
 Chien portant un masque à gaz. En 1914-1918, des chiens étaient utilisés comme mascotte, comme animal de trait, pour transporter des plis, ou par les services sanitaires pour signaler les blessés. Comme les chevaux, on a tenté de les protéger par des masques, quand ils ne servaient pas de cobayes.
Chien portant un masque à gaz. En 1914-1918, des chiens étaient utilisés comme mascotte, comme animal de trait, pour transporter des plis, ou par les services sanitaires pour signaler les blessés. Comme les chevaux, on a tenté de les protéger par des masques, quand ils ne servaient pas de cobayes._-_Gassed_-_Google_Art_Project.jpg.webp) L'ypérite attaque prioritairement les muqueuses humides (poumons, lèvres), la peau moite et les yeux, rendant les victimes aveugles, ce qui complique encore leur prise en charge et les soins. (Gassed, par John Singer Sargent, 1918, huile sur toile, 231 × 611 cm).
L'ypérite attaque prioritairement les muqueuses humides (poumons, lèvres), la peau moite et les yeux, rendant les victimes aveugles, ce qui complique encore leur prise en charge et les soins. (Gassed, par John Singer Sargent, 1918, huile sur toile, 231 × 611 cm).
La première utilisation lors de combats de l'ypérite a lieu durant la nuit du 12 au lors d'essais allemands contre les troupes britanniques stationnées près d'Ypres, trois semaines avant l'offensive britannique signant le début de la troisième bataille d’Ypres. Durant cette bataille, à partir du mois de septembre, le gaz moutarde est massivement utilisé. Les troupes britanniques s'emparent en novembre 1917 d'un stock d'obus allemands au gaz moutarde lors de la bataille de Cambrai. Les Britanniques mettent pratiquement un an pour industrialiser le procédé Despretz-Niemann-Guthrie. À partir de septembre 1918, le gaz moutarde est massivement employé lors de la rupture de la ligne Hindenburg.
Après analyses des échantillons prélevés sur les champs de bataille en , les Français André Job et Gabriel Bertrand proposent en la production du gaz par barbotage d'éthylène sous pression dans du chlorure de soufre selon le procédé de Despretz. La France produit 7 000 obus à ypérite par mois à la fin de 1917, pour atteindre 88 000 obus par mois en 1918[7].
Le gaz moutarde, très stable, s'attaque à la peau, aux voies respiratoires, aux yeux et contamine pendant plusieurs semaines la zone où elle a été projetée : il est donc principalement employé pour neutraliser une zone donnée. Ainsi, lors de phases défensives, l'artillerie déverse les obus toxiques pour bloquer la progression des troupes assaillantes. En phase offensive, l'artillerie assaillante cherche à neutraliser les canons adverses par contamination de zone, à cibler les zones de renfort ou de stationnement de troupes pour désorganiser l'adversaire. Ce type de gaz est également utilisé pour l'encagement du champ de bataille car il permet aussi de limiter l'arrivée de renfort. Le champ de bataille est ainsi pollué, les zones contaminées ne peuvent être franchies sans décontamination.


Dans les années 1930 et 1940, des centaines de recrues indiennes de l’armée britannique ont été utilisées afin de déterminer quelle quantité de gaz était nécessaire pour tuer un être humain. Les quantités utilisées sur les soldats indiens n'étaient pas mortelles, mais ces derniers ne disposaient pas de protections adéquates et n'étaient pas informés des risques qu'ils encouraient. Beaucoup ont souffert de graves brûlures et développé des maladies[8].
Utilisation dans d'autres conflits

- Par l'URSS, contre la révolte basmatchi[9].
- 1925, par l'Espagne et la France pendant la guerre du Rif[10] - [9] - [11].
- Le même produit est utilisé par la Grande-Bretagne en Palestine contre les Kurdes irakiens à l’été 1920.
- 1934-1935, par l'Italie en Libye et durant l'invasion de l'Éthiopie[9]; Hailé Sélassié le dénonce devant la Société des Nations le [10].
- 1937-1945, par le Japon contre la Chine durant la guerre sino-japonaise.
- 1939-1945, par les médecins nazis à titre expérimental sur des détenus des camps de concentration[12].
- 1963-1967, par l'Égypte contre la république arabe du Yémen durant la guerre du Yémen[9].
- 1983-1988, par le régime de Saddam Hussein contre les populations kurdes au nord de l'Irak (massacre de Halabja). Le gaz a également été déployé durant la guerre entre l'Irak et l'Iran[13].
- 1978-1987, par la Libye dans le nord du Tchad durant le conflit tchado-libyen[14] - [15].
- Par le régime syrien, pendant la guerre civile syrienne (2011)[16].
Après la guerre du Golfe, plusieurs centaines de tonnes de gaz moutarde sont éliminées en Irak par l'UNSCOM.
Début 2014, le stock de 26,3 tonnes d'ypérite détenu par la Libye a fini d'être détruit par les États-Unis après un contrat d'un montant maximal de 950 millions de dollars passé en à trois sociétés[17].
Protestations
Comme en témoigne l'appel de la Croix-Rouge lancé « aux belligérants contre l'emploi de gaz vénéneux »[18] du , alors que les usines de munitions commencent à augmenter la fabrication d'armes chimiques pour atteindre environ 1/3 de la fabrication des obus à la fin de l'automne 1918, l'usage des gaz « vénéneux » suscitera l'indignation de nombreux groupes et personnalités dans tous les camps. Néanmoins, la course aux armements se poursuivant, elle se traduira par une production continue et massive d'armes chimiques jusqu'à la fin de la guerre froide. Nonobstant le protocole de Genève de 1925 (Protocole concernant la prohibition d'emploi à la guerre de gaz asphyxiants, toxiques ou similaires et de moyens bactériologiques), ce n'est que 70 ans plus tard que des décisions importantes visant l'interdiction et la destruction de ces armes seront prises (la Convention sur l'interdiction des armes chimiques est signée en 1993).
Chimie
Certains additifs permettent de le rendre gazeux.
Plusieurs variantes ont vu le jour :
- H, HS ou moutarde de Levinstein, fabriquée grâce à la réaction sous contrôle entre de l'éthylène et du monochlorure de soufre. Sans distillation, le résultat contient 20 à 30 % d'impuretés, ce qui fait qu'elle ne se conditionne pas aussi bien que la version HD ;
- HD, nommée Pyro par les Britanniques, gaz moutarde distillé et pur à environ 96 %. Le terme de gaz moutarde se réfère généralement à cette variante ;
- HT, nommée Runcol par les Britanniques. Cette variante était obtenue par la réaction entre du thiodiglycol (en) et du chlorure de soufre ;
- HL, un mélange entre la variante HD et la lewisite (L), qui fut testé dans les années 1920 ;
- HQ, un mélange entre la variante HD et la sesquimoutarde (Q). Cette dernière formule est due à Gates et Moore en 1946.
Effets
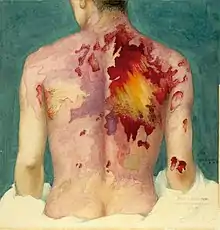


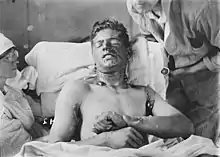
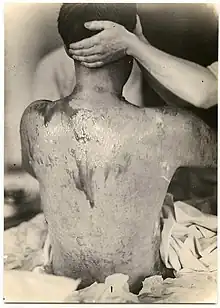

Les gaz moutarde sont extrêmement toxiques et ont de puissants effets vésicants sur les victimes. Leurs capacités alkylantes les rendent fortement cancérogènes et mutagènes. De plus, ils sont hautement lipophiles, ce qui accélère leur absorption dans le corps. Étant donné que les personnes exposées aux agents moutarde souffrent rarement de symptômes immédiats et que les zones contaminées peuvent sembler tout à fait normales, les victimes peuvent recevoir sans le savoir de fortes doses.
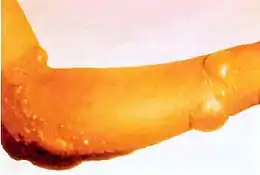
Dans les 24 heures suivant l'exposition, les victimes ressentent des démangeaisons intenses et une irritation cutanée. Si cette irritation n'est pas rapidement traitée, des cloques remplies de liquide jaune (pus) commencent à se former partout où l'agent est entré en contact avec la peau, les zones moites et les muqueuses étant les parties les plus sensibles. Ce sont des brûlures chimiques et elles sont très invalidantes. Les gaz moutarde pénètrent facilement dans les tissus des vêtements tels que la laine ou le coton, de sorte que ce n'est pas seulement la peau exposée qui est brûlée. Selon le niveau de contamination, les brûlures à l'agent moutarde peuvent varier entre les brûlures du premier et du deuxième degré, bien qu'elles puissent aussi être tout aussi graves, défigurantes et dangereuses que celles du troisième degré. Les brûlures graves (c'est-à-dire couvrant plus de 50 % de la peau de la victime) sont souvent mortelles, la mort survenant au bout de quelques jours ou quelques semaines.
Si les yeux de la victime ont été exposés à l'ypérite, ils deviennent douloureux et une conjonctivite (également connue sous le nom d'œil rose) apparaît, puis un gonflement des paupières, entraînant une cécité temporaire. Une exposition oculaire extrême aux vapeurs de gaz moutarde peut entraîner une ulcération de la cornée, des cicatrices de la chambre antérieure et une néovascularisation. Dans ces cas graves et peu fréquents, la greffe de cornée est utilisée comme option de traitement. Un myosis, lorsque la pupille se contracte plus que d'habitude, peut également survenir, probablement lié à l'activité cholinomimétique du gaz moutarde.
L’ypérite est un puissant vésicant, sous forme de vapeurs ou dispersé sous forme de gouttelettes, il s'introduit dans les voies respiratoires et détruit les muqueuses, provoquant une détresse respiratoire. Si les poumons sont atteints, il apparaît alors des emphysèmes et des œdèmes liés à la présence de fluides pouvant entraîner une mort similaire à la noyade si la dose est très forte.
À terme, le patient présente une anémie, une baisse de la résistance immunitaire et développe une prédisposition aux cancers, l’ypérite étant un agent mutagène, et ceci même à de faibles concentrations. Il peut en effet entraîner une lésion grave : rupture simultanée de deux liaisons phosphodiester homologues, entraînant une cassure de la double hélice d'ADN[19]. En cas d'ingestion d’aliments contaminés, on assiste à une perte de poids importante et des troubles digestifs. Sous forme liquide, l'ypérite peut contaminer des zones de manière durable, ce qui augmente le risque de contamination par ingestion ou contact avec des objets souillés. Elle reste durablement active à l'abri de l'air, et dans l'air en dessous de 6 °C.
Témoignage d'un Kurde, concernant une attaque de l'armée irakienne, dans les années 1980 : « Une odeur d'ail et de fruits pourris m'a d'abord mis en alerte, puis les gens que je croisais se plaignaient de ne plus pouvoir respirer, ils avaient de violentes quintes de toux et des brûlures aux yeux[20]. »
Utilisations non militaires
Dès 1918, les observations ont montré que le gaz moutarde était un suppresseur de l'hématopoïèse. Des autopsies réalisées sur des soldats américains morts du gaz moutarde par des chercheurs de l'Université de Pennsylvanie ont confirmé cette observation en constatant des diminutions du nombre de globules blancs. Ces observations ont incité l'Office américain de la recherche scientifique et du développement à financer des recherches sur les armes chimiques au sein des départements de biochimie et de chimie de l'Université de Yale au cours de la Seconde Guerre mondiale.
Un groupe de l'Université de Yale a commencé des études sur les moutardes azotées et leur impact sur le traitement du syndrome de Hodgkin et sur d'autres lymphomes et leucémies, les premiers tests sur l'homme ont débuté en 1942.
Les moutardes azotées sont utilisées dans le traitement des cancers, en entrant dans la composition de certaines chimiothérapies dites cytotoxiques[21] - [22] - [23].
Source de pollution et de risque à long terme
Au XXe siècle, des millions de tonnes d'obus non explosés ou non utilisés ont été jetés en mer. Nombre d'entre eux contenaient de l'ypérite et d'autres toxiques de guerre. Ces munitions immergées se corrodent lentement et après 80 ans environ commencent à libérer leur contenu. Ce contenu toxique présente un danger pour la faune marine[24] et peut en outre être remonté dans les filets de pêche ou éparpillé par des travaux sous-marins. Les obus à l'ypérite immergés sont ainsi devenus une source durable de risques pour l'homme et les écosystèmes.
L'ypérite se dégrade lentement, il faut plusieurs siècles pour la dégrader dans l'eau froide. L'ypérite est stable et, selon une étude belge récente, dans un milieu stable (vase non remuée, non bioturbée), le gaz moutarde perdu par un obus corrodé immergé après la Seconde Guerre mondiale reste « dans un rayon de 3 cm autour de l’obus »[25].
Il en va autrement si cet obus est déplacé ou remonté dans un chalut ou par le courant. Dans ce dernier cas, la cargaison peut être contaminée (l'ypérite ne se transforme en gaz ou n'est active qu'à partir de 6 °C) et les pêcheurs peuvent être brûlés. Par exemple, en mer Baltique où de nombreuses immersions de munitions chargées à l'ypérite ont eu lieu. Des pêcheurs suédois ou polonais (24 cas) ont été brûlés par de l'ypérite ramenée dans leurs filets, et plus récemment en 1997[26]. On peut se demander si des poissons contaminés n'ont pas déjà été commercialisés. Mais, sauf accident ou acte terroriste, les problèmes majeurs potentiels sont surtout de moyen et long terme. En effet, pour « améliorer » l'efficacité militaire de l'ypérite, efficacité dans le froid, effets synergiques avec l'arsenic, etc., les chimistes ont produit un « Gaz moutarde visqueux » (Viscous mustard gas) en lui ajoutant d'autres produits, ayant pour effet d'épaissir la substance[27].
Le « Gaz moutarde visqueux » a un aspect totalement différent du gaz moutarde ordinaire, il réagit également très différemment notamment dans l'eau où il reste très stable. Sa couleur va du brun-rougeâtre au noir en passant par le marron-vert[27]. Sa consistance évoque à la fois une pâte épaisse et très collante et la cire d'abeille. Environ 20 % du gaz moutarde produit a été transformé en gaz moutarde visqueux. Des agents épaississants insolubles dans l'eau tels que du polystyrène et de la « cire montan » (ou cire de lignite) empêchent ce gaz moutarde de réagir avec l'eau de mer, mais il reste écotoxique[28] et très toxique pour les humains qui le touchent ou en inhalent les vapeurs ou des particules. L'hydrolyse naturelle en est très ralentie et ne se fait qu'après que le gaz moutarde a diffusé à partir du gaz moutarde visqueux[27]. Les agents épaississants restent et forment une croûte incluant souvent du sable fin et de particules de vase, pouvant évoquer une galette de pétrole. Le produit reste ainsi actif des décennies voire plus. Plus le morceau est gros, plus longue sera sa durée de vie[27]. Comme il est élastique, il est très difficile de le récupérer par des moyens mécaniques[27].
Vadim Paka, directeur d'un institut d'océanographie russe, a montré en Baltique que quelques espèces de microorganismes s'adaptent à la présence d'ypérite. Ils pourraient servir de bioindicateurs[29].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ChemIDplus
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 1 : Cancérogènes pour l'homme », sur http://monographs.iarc.fr, CIRC, (consulté le ).
- François-Guillaume Lorrain, « Grande Guerre : Fritz Haber, ce Juif qui a participé à exterminer les siens », sur lepoint.fr, (consulté le ).
- Daniel Riche, La Guerre Chimique et Biologique, Belfond, Paris, 1982 (ISBN 2-7144-1518-0), p. 104.
- (en) Sulfur Mustard Research—Strategies for the Development of Improved Medical Therapy
- Foch et la bataille de 1918, p. 161, André Laffargue, éditions Arthaud.
- (en-GB) Rob Evans, « Military scientists tested mustard gas on Indians », The Guardian, (ISSN 0261-3077, lire en ligne, consulté le ).
- Blister Agent: Sulfur Mustard (H, HD, HS), CBWinfo.com
- Sven Lindqvist, Maintenant tu es mort. Le siècle des bombes, Le Serpent à plumes, 2002, p. 102-103.
- (en) Daniel Feakes, Mary Kaldor (éditeur), Helmut Anheier (éditeur) et Marlies Glasius (éditeur), Global Civil Society Yearbook 2003, Oxford University Press, (ISBN 0-19-926655-7, lire en ligne), « Global society and biological and chemical weapons », p. 87–117.
- Christian Bernardac, Les Médecins maudits, France empire, .
- « Les armes chimiques dans l'Histoire », sur http://non-proliferation.irsn.fr/, Institut de radioprotection et de sûreté nucléaire (consulté le ).
- Stéphane Mantoux, Les Guerres du Tchad, 1969-1987, Paris, 978-2917575499, , 108 p. (ISBN 979-10-210-0264-7), p. 97.
- Colonel Petit, « 53) Les bombardements du 10 septembre 1987 », sur air-insignes.fr (consulté le ).
- .
- Philippe Chapleau, « Libye : le dernier stock de gaz moutarde détruit par la firme US Parsons », sur Ouest-France, (consulté le ).
- Appel aux belligérants contre l'emploi de gaz vénéneux
- Encyclopaedia Universalis Thesaurus, article « Radiobiologie » par Ethel Moustacchi et Raymond Devoret, p. 462 à 465.
- Collectif (préf. Bernard Kouchner), Le livre noir de Saddam Hussein, Oh ! Éditions, , 700 p. (ISBN 2915056269), cité par Patrice de Méritens dans Le Figaro Magazine du 3 septembre 2005.
- Paul Depovere, « Du gaz moutarde à la chimio », Athena, no 336, (lire en ligne, consulté le )
- Andrée Marquet, « De l’arme chimique à l’agent thérapeutique : deux exemples », L'Actualité chimique, no 391, , xiii-xviii (lire en ligne [PDF], consulté le ).
- Etienne Meyer-Vacherand, « Le méthotrexate, du gaz moutarde à la chimiothérapie », Fertile Pharmacopée, sur letemps.ch, (consulté le ).
- Emelyanov, E.M., Kravtzov, V.A., et Paka, V.T. 2000. Danger to life of areas of dumped trophy chemical munitions in the Skagerrak Sea and in the Bornholm Basin. Baltic Sea. In: Local Agenda 21. Through Casc Method Research and Teaching Towards a Sustainable Future. München, Mering, 58-64.
- Commission OSPAR ; Autres usages et impacts de l’homme ; Munitions immergées, Bilan de santé 2010
- Une bombe à retardement dans les mers du Nord, sur le site presseurop.eu, consulté le 8 février 2014
- HELCOM, 1994 (voir bibliographie)
- Waleij, A.; Ahlberg, M.; Berglind, R.; Muribi, M.; Eriksson, J. (2002). Ecotoxicity of mustard gas, Clark I, Clark II and the metabolite tetraphenyldiarsine oxide occurring in sea-dumped chemical munition, in: Missiaen, T. et al. (2002). Chemical munition dump sites in coastal environments. p. 121-132,
- Paka, V and Spiridonov, M, ‘Research of Dumped Chemical Weapons made by R/V “Professor Shtokman” in the Gotland, Bornholm and Skagerrak Dump Sites’, Eds. T Missiaen, and JP Henriet, Chemical Munition Dump Sites in Coastal Environments, 2002, p. 27-42.