Sulfure de potassium
Le sulfure de potassium est un composé inorganique et un solide ionique de formule brute K2S. Ce solide incolore n'est normalement pas rencontré en conditions naturelles car il réagit facilement et de manière irréversible avec l'eau en formant de l'hydrogénosulfure de potassium (KHS) et de l'hydroxyde de potassium (KOH). En outre, l'anion sulfure s'oxyde très rapidement au contact de l'oxygène atmosphérique et se transforme en anion sulfate.
| Sulfure de potassium | |
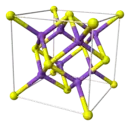 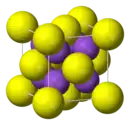 ions S2− (en jaune) et ions K+ (en violet) |
|
| Identification | |
|---|---|
| Nom UICPA | sulfure de potassium |
| Synonymes |
monosulfure de dipotassium |
| No CAS | |
| No ECHA | 100.013.816 |
| No CE | 215-197-0 |
| No RTECS | TT6000000 |
| Code ATC | |
| InChI | |
| Apparence | incolore pur impur jaune-marron |
| Propriétés chimiques | |
| Formule | K2S [Isomères] |
| Masse molaire[1] | 110,262 ± 0,005 g/mol K 70,92 %, S 29,08 %, |
| Propriétés physiques | |
| T° fusion | 840 °C |
| T° ébullition | déc. |
| Solubilité | réaction avec l'eau → KHS + KOH soluble dans l'éthanol, le glycérol |
| Masse volumique | 1,81 g·cm-3 |
| Cristallographie | |
| Structure type | antifluorite |
| Précautions | |
| Directive 67/548/EEC[2] | |
 C  N |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Structure
Le sulfure de potassium adopte une structure antifluorite ce qui signifie que les petits ions K+ occupent les sites tétraédriques des anions F− dans la fluorine et les centres S2−, plus gros, occupent les sites de coordination 8 des Ca2+. Li2S, Na2S et Rb2S cristallisent de la même façon[3].
Synthèse et réactions
K2S résulte de la combinaison du potassium et du soufre. En laboratoire, il peut être obtenu en faisant réagir du soufre élémentaire avec du potassium métallique dissout dans de l'ammoniac liquide anhydre. Ce type de synthèse n'est cependant pas courant vu les précautions de sécurité requises.
Il peut être produit industriellement par thermo-sulfato réduction (TSR) en chauffant du sulfate de potassium, K2SO4 avec du carbone:
- K2SO4 + 2 C → K2S + 2 CO2
- K2SO4 + 4 C → K2S + 4 CO
Ce sel contient des anions S2− qui sont très basiques et qui s'hydrolysent complètement selon l'équation suivante :
- S2− + H2O → HS− + OH−
- K2S + H2O → KHS + KOH
Lors de son utilisation pour provoquer la précipitation de sulfures métalliques insolubles (métaux de transition et métaux lourds), cette solution d'ions HS− et OH− se comporte comme une source de S2−. Les autres sulfures de métaux alcalins se comportent de façon semblable[3].
Utilisation dans les feux d'artifice
Du sulfure de potassium peut se former lorsque de la poudre noire contenant un excès de soufre est brûlée. Il est un intermédiaire important dans de nombreux effets pyrotechniques, tels que le Senko Hanabi et certaines formulations de paillettes[4].
Utilisation en bijouterie
En formant du sulfure d'argent (Ag2S) en film très mince, il peut donner toutes sortes de teintes à la surface d'objets en argent (orange, rouge, bleu, jusqu'au noir). Ce phénomène optique est dû à l'interférence en lame mince également responsable de l'apparition des moires à la surface de fins films d'huile flottant à la surface de l'eau. De pareils films d'oxyde d'argent (Ag2O) provoquent également des reflets moirés à la surface de l'argenterie oxydée.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Potassium sulfide » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Ancien système de signalisation des substances dangereuses, périmé depuis 2010 et 2015, lien à mettre à jour »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?) (consulté le )
- Holleman, A. F.; Wiberg, E. (2001). "Inorganic Chemistry" Academic Press: San Diego, (ISBN 0-12-352651-5).
- Shimizu, Takeo. "Fireworks: the Art, Science, and Technique." Pyrotechnica Publications : Austin, 1981. (ISBN 0-929388-05-4).