Borohydrure
Le terme borohydrure désigne aussi bien l'anion BH4− que ses sels. Il peut également servir pour désigner des composés du type BH4–nXn−, comme pour le cyanoborohydrure de sodium Na+BH3CN− et le triéthylborohydrure de lithium Li+(CH3CH2)3BH−.
Les borohydrures sont très utilisés comme réducteurs en synthèse organique. Ils peuvent également présenter un intérêt académique et industriel en chimie minérale[1]. Le borohydrure de lithium LiBH4 et le borohydrure de sodium NaBH4 sont les plus importants, mais d'autres borohydrures sont également bien connus[2].
Histoire
Les borohydrures de métaux alcalins ont été décrits pour la première fois en 1940 par Hermann Irving Schlesinger et Herbert C. Brown. Ils avaient obtenu du borohydrure de lithium à partir de diborane B2H6 :
Ils poursuivirent leurs travaux dans les années 1940 en vue de produire des dérivés volatils de l'uranium avant l'utilisation de l'hexafluorure d'uranium UF6, et obtirent ainsi du borohydrure d'uranium(IV) U(BH4)4 et des dérivés méthylés U(BH4)3BH3CH3 et U(BH3CH3)4, qui s'avérèrent particulièrement volatils[3].
Les méthodes de production contemporaines font intervenir la réduction du borate de triméthyle B(OCH3)3 avec de l'hydrure de sodium NaH[2].
Structure
L'anion borohydrure présente une géométrie tétraédrique qu'il conserve dans la plupart des composés qui l'incorporent[4]. La réactivité des liaisons B–H dépend des autres ligands. Les groupes donneurs d'électrons comme le groupe éthyle –CH2CH3 rendent l'anion borohydrure très nucléophile, comme dans les triéthylborohydrures, qui contiennent l'anion (CH3CH2)3BH−. A contrario, l'anion cyanoborohydrure BH3CN− est un réducteur plus faible en raison de la nature acceptrice d'électrons du substituant cyano –C≡N. Le contre-ion influence également le pouvoir réducteur du réactif.
| Borohydrure [no CAS] |
M. mol. (g/mol) |
Masse vol. (g/cm3) |
Point de fusion (°C) |
Sol. dans H2O (g/100 mL à 25 °C) |
Sol. dans MeOH (g/100 mL à 25 °C) |
Sol. dans Et2O (g/100 mL à 25 °C) |
Sol. dans THF (g/100 mL à 25 °C) |
|---|---|---|---|---|---|---|---|
| LiBH4 [16949-15-8] |
21,78 | 0,66 | 280 | 20,9 | Décomp. (44 dans EtOH) | 4,3 | 22,5 |
| NaBH4 [16940-66-2] |
37,83 | 1,07 | 505 | 55 | 16,4 (à 20 °C) | Insoluble | 0,1 (à 20 °C) |
| NaBH3CN [25895-60-7] |
62,84 | 1,20 | 240 avec décomp. | Toléré[5] | 217 | Insoluble | 36 |
| KBH4 [13762-51-1] |
53,94 | 1,17 | 585 (sous H2) | 19 | Insoluble | Insoluble | Insoluble |
| LiBHEt3 [22560-16-3] |
105,94 | — | — | Insoluble | Insoluble | N/A | Élevée |
Applications
Le borohydrure de sodium est le principal borohydrure produit industriellement, notamment pour réduire le dioxyde de soufre SO2 en dithionite de sodium Na2S2SO4 :
Le dithionite est utilisé pour blanchir la pâte de bois[2]. Le borohydrure de sodium est également utilisé pour réduire les aldéhydes et les cétones dans la fabrication de produits pharmaceutiques, notamment le chloramphénicol, le thiamphénicol, la vitamine A, l'atropine et la scopolamine, ainsi que de nombreux parfums et arômes.
En raison de leur teneur élevée en hydrogène, les complexes et les sels de borohydrure ont été étudiés pour de possibles applications de stockage de l'hydrogène[6]. Comme cela avait été mis en évidence lors de travaux connexes sur le borazane BH3NH3, les difficultés liées à la mise en œuvre de ces technologies avaient trait à la cinétique lente des réactions, les rendements en hydrogène faibles et des difficultés de régénération des borohydrures initiaux.
Complexes
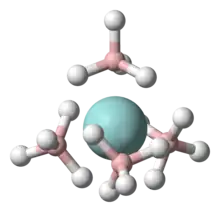
Dans ses complexes, l'ion borohydrure est lié à l'ion métallique par l'intermédiaire de un à trois atomes d'hydrogène pontants[1] - [7] - [8]. Dans la plupart de ces complexes, l'ion BH4− est bidenté. Certains complexes homoleptiques de borohydrures sont volatils, comme le borohydrure d'uranium U(BH4)4[3].
Les complexes métalliques de borohydrure par simple élimination du sel[9] :
Certains borohydrures métalliques donnent des borures métalliques sous l'effet de la chaleur. Lorsque le complexe de borohydrure est volatil, cette décomposition est à la base du dépôt chimique en phase vapeur (CVD) de couches minces de borures métalliques[10]. Par exemple, le diborure de zirconium ZrB2 et le diborure d'hafnium HfB2, deux céramiques ultraréfractaires, peuvent être obtenus par dépôt en phase vapeur de borohydrure de zirconium(IV) Zr(BH4)4 et de borohydrure d'hafnium Hf(BH4)4[10] :
Ces diborures métalliques sont utilisés comme revêtements en raison de leur très grande dureté et des valeurs élevées de leur point de fusion, de leur résistance mécanique, de leur résistance à l'usure et à la corrosion, et de leur conductivité électrique[10].
Notes et références
- (en) Viktor D. Makhaev, « Structural and dynamic properties of tetrahydroborate complexes », Russian Chemical Reviews, vol. 69, no 9, , p. 727 (DOI 10.1070/RC2000v069n09ABEH000580, lire en ligne)
- (en) Ulrich Wietelmann, Michael Felderhoff et Peter Rittmeyer, « Hydrides », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a13_199.pub2, lire en ligne)
- (en) H. I. Schlesinger, Herbert C. Brown, B. Abraham, A. C. Bond, Norman Davidson, A. E. Finholt, James R. Gilbreath, Henry Hoekstra, Leo Horvitz, Earl K. Hyde, J. J. Katz, J. Knight, R. A. Lad, Darwin L. Mayfield, Louis Rapp, D. M. Ritter, Anthony M. Schwartz, Irving Sheft, L. D. Tuck et A. O. Walker, « New Developments in the Chemistry of Diborane and the Borohydrides. I. General Summary », Journal of the American Chemical Society, vol. 75, no 1, , p. 186-190 (DOI 10.1021/ja01097a049, lire en ligne)
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e éd., Butterworth-Heinemann, 1997. (ISBN 978-0-08-037941-8)
- Robert O. Hutchins, MaryGail K. Hutchins et Matthew L. Crawley, « Encyclopedia of Reagents for Organic Synthesis, 8 Volume Set », dans Robert O. Hutchins, MaryGail K. Hutchins, Matthew L. Crawley, Encyclopedia of Reagents for Organic Synthesis, (ISBN 978-0471936237, DOI 10.1002/047084289X.rs059.pub2), « Sodium Cyanoborohydride »
- (en) Tomasz Jaroń, Wojciech Wegner et Wojciech Grochala, « M[Y(BH4)4] and M2Li[Y(BH4)6−xClx] (M = Rb, Cs): new borohydride derivatives of yttrium and their hydrogen storage properties », Dalton Transactions, vol. 42, no 19, , p. 6886-6893 (PMID 23503711, DOI 10.1039/C3DT33048F, lire en ligne)
- (en) Tobin J. Marks et John R. Kolb, « Covalent transition metal, lanthanide, and actinide tetrahydroborate complexes », Chemical Reviews, vol. 77, no 2, , p. 263-293 (DOI 10.1021/cr60306a004, lire en ligne)
- (en) Maria Besora et Agustí Lledós, « Coordination Modes and Hydride Exchange Dynamics in Transition Metal Tetrahydroborate Complexes », Contemporary Metal Boron Chemistry I, , p. 149-202 (ISBN 978-3-540-78633-7, DOI 10.1007/430_2007_076, lire en ligne)
- (de) K. Franz, H. Fusstetter et H. Nöth, « Metallboranate und Boranatometallate. IX [1]; Äther‐Addukte von Tris(boranato)‐titan(III) und dimere Alkoxy‐bis(boranato)‐titan(III)‐Verbindungen », Zeitschrift für anorganische und allgemeine Chemie, vol. 472, no 2, , p. 97-113 (DOI 10.1002/zaac.654270202, lire en ligne)
- (en) James A. Jensen, John E. Gozum, Deborah M. Pollina, and Gregory S. Girolami, « Titanium, zirconium, and hafnium tetrahydroborates as "tailored" CVD precursors for metal diboride thin films », Journal of the American Chemical Society, vol. 110, no 5, , p. 1643-1644 (DOI 10.1021/ja00213a058, lire en ligne)