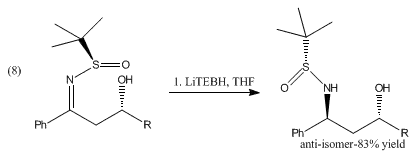Triéthylborohydrure de lithium
Le triéthylborohydrure de lithium, ou LiTEBH, est un composé chimique de formule LiEt3BH. Commercialisé sous la marque Super-Hydrure, c'est un réducteur énergique utilisé en chimie organique et organométallique. Il se présente sous la forme d'un solide blanc à grains incolores, mais est le plus souvent utilisé et commercialisé comme solution dans le THF[3]. Le triéthylborohydrure de sodium, qui lui est apparenté, est quant à lui disponible en solution dans le toluène. La réaction du LiTEBH avec l'eau, les alcools et les acides est exothermique et peut être violente, libérant de l'hydrogène et du triéthylborane Et3B, qui est pyrophorique.
| Triéthylborohydrure de lithium | |||
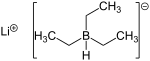
| |||
| Structure du triéthylborohydrure de lithium | |||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.040.963 | ||
| No CE | 245-076-8 | ||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C6H16BLi |
||
| Masse molaire[1] | 105,943 ± 0,015 g/mol C 68,02 %, H 15,22 %, B 10,2 %, Li 6,55 %, |
||
| Propriétés physiques | |||
| Masse volumique | 0,892 g·cm-3[2] à 25 °C (1 mol·L-1 dans le THF) | ||
| Point d’éclair | −17 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
    Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Le LiTEBH est un réducteur plus énergique que le borohydrure de lithium LiBH4 et le tétrahydruroaluminate de lithium LiAlH4. On peut l'obtenir en faisant réagir de l'hydrure de lithium LiH avec du triéthylborane Et3B dans le tétrahydrofurane C4H8O :
Les solutions de LiTEBH dans le THF sont stables indéfiniment en l'absence d'humidité.
Réactions
Le LiEt3BH réduit les halogénoalcanes en alcanes[3] - [4]. Il réduit également une grande variété de groupes fonctionnels, comme le font de nombreux autres hydrures. Il est cependant utilisé pour réduire les substrats difficiles, comme les carbonyles inaccessibles par encombrement stérique, comme l'illustre la réduction de la 2,2,4,4-tétraméthyl-3-pentanone. Il est par ailleurs utilisé pour réduire les anhydrides d'acide en alcools. Les lactones sont réduites en diols. Les énones α,β subissent une addition 1,4 donnant des énolates de lithium. Les disulfures sont réduits en diols via des thiolates. Les acides carboxyliques sont déprotonés, mais les carboxylates de lithium correspondants ne sont pas réduits.
Les époxydes subissent une ouverture du cycle pour donner l'alcool correspondant. Les époxydes asymétriques peuvent être traités avec régiosélectivité aussi bien qu'avec stéréosélectivité, favorisant l'attaque sur la position la plus accessible :
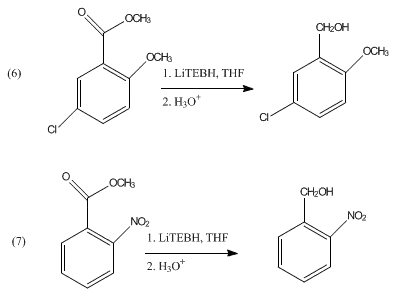
Le LiEt3BH ne réduit pas les acétals. Il peut en revanche être utilisé dans le clivage par réduction des mésylates et des tosylates[5]. Il peut déprotéger sélectivement les groupes N-acyle tertiaires sans affecter les amides secondaires[6]. On a également observé la réduction d'esters aromatiques pour former les alcools correspondants :
Le LiEt3BH réduit également les pyridines et les isoquinoléines respectivement en pipéridines et tétrahydroisoquinoléines (en)[7]. La réduction de β-hydroxysulfinyl-imines avec le catécholborane (en) et le LiEt3BH donne des alcools anti-1,3-aminés[8] :
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Super-Hydride® solution 1.0 M lithium triethylborohydride in THF, consultée le 15 juillet 2018.
- (en) Marek Zaidlewicz et Herbert C. Brown, « Lithium Triethylborohydride », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rl148, lire en ligne)
- (en) S. Krishnamurthy et Herbert C. Brown, « Selective reductions. 27. Reaction of alkyl halides with representative complex metal hydrides and metal hydrides. Comparison of various hydride reducing agents », The Journal of Organic Chemistry, vol. 45, no 5, , p. 849-856 (DOI 10.1021/jo01293a018, lire en ligne)
- (en) Hans H. Baer et Miroslawa Mekarska-Falicki, « Stereochemical dependence of the mechanism of deoxygenation, with lithium triethylborohydride, in 4,6-O-benzylidenehexopyranoside p-toluenesulfonates », Revue canadienne de chimie, vol. 63, no 11, , p. 3043-3052 (DOI 10.1139/v85-505, lire en ligne)
- (en) Hideyuki Tanaka et Kunio Ogasawara, « Utilization of lithium triethylborohydride as a selective N-acyl deprotecting agent », Tetrahedron Letters, vol. 43, no 25, , p. 4417-4420 (DOI 10.1016/S0040-4039(02)00844-4, lire en ligne)
- (en) Bruce E. Blough et F. Ivy Carroll, « Reduction of isoquinoline and pyridine-containing heterocycles with lithium triethylborohydride (Super-Hydride », Tetrahedron Letters, vol. 34, no 45, , p. 7239-7242 (DOI 10.1016/S0040-4039(00)79297-5, lire en ligne)
- (en) Takuya Kochi, Tony P. Tang et Jonathan A. Ellman*, « Asymmetric Synthesis of syn- and anti-1,3-Amino Alcohols », Journal of the American Chemical Society, vol. 124, no 23, , p. 6518-6519 (PMID 12047156, DOI 10.1021/ja026292g, lire en ligne)