Azoture de chlore
L'azoture de chlore (ClN3) est un composé inorganique de formule ClN3, découvert en 1908 par Friedrich Raschig[4]. L’azoture de chlore concentré est notoirement instable et explose spontanément à toute température[5].
| Azoture de chlore | ||
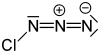
| ||
 | ||
| Identification | ||
|---|---|---|
| Synonymes |
nitrure de chlore, ou chlorure d'azote |
|
| No CAS | ||
| No CE | 231-208-1 | |
| No RTECS | BD0525000 | |
| Code ATC | D10 | |
| PubChem | 61708 | |
| Apparence | gaz incolore[1] | |
| Propriétés chimiques | ||
| Formule | ClN3 [Isomères] |
|
| Masse molaire[2] | 77,473 ± 0,003 g/mol Cl 45,76 %, N 54,24 %, 77,4731 g/mol |
|
| Propriétés physiques | ||
| T° fusion | 173 K (−100 °C)[3] | |
| T° ébullition | −15 °C[3] | |
| Solubilité | Soluble dans le butane, le pentane, le benzène, le méthanol, l'éthanol, l'éther diéthylique, l'acétone, le chloroforme, le tétrachlorométhane et le disulfure de carbone ; très peu soluble dans l'eau | |
| Limites d’explosivité dans l’air | Sensibilité extrême aux chocs et aux frictions à toute température et en toute proportion | |
| Composés apparentés | ||
| Autres composés |
Azoture de fluor |
|
| Unités du SI et CNTP, sauf indication contraire. | ||
Préparation
L'azoture de chlore est préparé en diffusant du dichlore gazeux sur de l'azoture d'argent, ou par une addition d’acide acétique à une solution d’hypochlorite de sodium et d'azoture de sodium[6]. Traité à l’ammoniac, il est possible qu'une ou plusieurs des trois azinamines possibles NH2N3, NH(N3)2, et N(N3)3 se forment.
Caractéristiques
L’azoture de chlore est extrêmement réactif. Il peut parfois même réagir sans provocation apparente. Il est donc trop réactif pour être commercialisé à moins qu’il ne soit fortement dilué en solution. L’azoture de chlore réagit de manière explosive avec le buta-1,3-diène, l'éthane, l'éthylène, le méthane, le propane, le phosphore, l’azoture d'argent, et le sodium. En présence d’acide, l'azoture de chlore se décompose, libérant de l'acide chlorhydrique gazeux corrosif et toxique[7].
Informations réglementaires
Son utilisation est strictement réglementée par le Département des Transports des États-Unis.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chlorine azide » (voir la liste des auteurs).
- Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, 1re Ed., 1975, p. 458. (ISBN 3-432-02328-6).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Gurdeep Raj, Advanced Inorganic Chemistry Vol-1, p. 745. (ISBN 81-87224-03-7), page sur Googlebook).
- (en) Frierson, W. J. et Browne, A. W., « Chlorine Azide. II. Interaction of Chlorine Azide and Silver Azide. Azino Silver Chloride, N3AgCl », Journal of the American Chemical Society, vol. 65, no 9, , p. 1698–1700 (DOI 10.1021/ja01249a013)
- (en) Frierson, W. J., Kronrad, J. et Browne, A. W., « Chlorine Azide, ClN3. I. », Journal of the American Chemical Society, vol. 65, no 9, , p. 1696–1698 (DOI 10.1021/ja01249a012)
- (en) F. Raschig, « Über Chlorazid N3Cl », Berichte der Deutschen Chemischen Gesellschaft, vol. 41, no 3, , p. 4194–4195 (DOI 10.1002/cber.190804103130)
- 61708