Virus de la grippe A (H5N8)
Le sous-type H5N8 du virus de la grippe A fait référence aux types de deux antigènes présents à la surface du virus : l'hémagglutinine de type 5 et la neuraminidase de type 8. Le virus de la grippe A est un virus à ARN monocaténaire de polarité négative à génome segmenté (8 segments) qui appartient au genre Alphainfluenzavirus de la famille des Orthomyxoviridae. Il est classé dans les « grippes aviaires » (groupe de virus qui infectent uniquement ou presque toujours des espèces d’oiseaux (sauvages ou domestiques et alors généralement des volailles dans ce dernier cas), même si certains de ces virus peuvent aussi infecter des oiseaux en cage, des mammifères et parfois l’Homme. Leur pathogénicité varie d'une part selon leur type génétique, et d'autre part selon la santé immunitaire des espèces infectés. Ces virus ont en commun de principalement infecter des voies respiratoires chez les espèces animales-hôtes. Le sous-type H5N8 est parfois considéré comme l'un des moins pathogènes pour l'homme, mais le risque épidémiologique qu'il représente est difficile à évaluer en raison de sa capacité à muter, susceptible de le rendre bien plus dangereux.

| Type | Virus |
|---|---|
| Domaine | Riboviria |
| Embranchement | Negarnaviricota |
| Sous-embr. | Polyploviricotina |
| Classe | Insthoviricetes |
| Ordre | Articulavirales |
| Famille | Orthomyxoviridae |
| Genre | Alphainfluenzavirus |
- Espèce : virus de la grippe A
- sous-type H1N1
- sous-type H1N2
- sous-type H2N2
- sous-type H2N3
- sous-type H3N1
- sous-type H3N2
- sous-type H3N8
- sous-type H5N1
- sous-type H5N2
- sous-type H5N3
- sous-type H5N6
- sous-type H5N8
- sous-type H5N9
- sous-type H6N1
- sous-type H6N2
- sous-type H7N1
- sous-type H7N2
- sous-type H7N3
- sous-type H7N4
- sous-type H7N7
- sous-type H7N9
- sous-type H9N2
- sous-type H10N7
Comme d'autres sous-types de virus de la grippe, le sous-type A (H5N8) est en constante évolution et peut donc contrer le système immunitaire de ses hôtes. Il est susceptible de parfois produire des variants dits « hautement pathogènes » (HP) pour les oiseaux, ce qui s'est notamment produit à partir de en Corée. Dans ces cas, l'évolution du virus grippal est généralement rapide et constante, et préoccupante pour les écoépidémiologistes car rendant la fabrication de vaccins presque impossible (quand un vaccin a été testé et distribué, le virus peut déjà avoir muté et l’avoir contourné). « H5N8 est hautement pathogène pour les volailles »[2], mais jusqu’en 2014 « aucun cas de contamination humaine n'a été recensé dans le monde »[2]. Son évolution phylogénétique (par le jeu de mutations et/ou de réassortiments génétiques) pourrait cependant éventuellement le rendre infectieux voire hautement pathogène pour l’Homme. L'importance de ce risque est impossible à évaluer. Ce virus fait pour cette raison l’objet d’une attention particulière de la part des réseaux de surveillance vétérinaire. En France, les virus de la grippe aviaire sont classés dans la catégorie « Dangers sanitaires »[3].
Parmi les risques et dangers zootechniques existent des risques de contamination entre oiseaux d’élevages et entre oiseaux sauvages, ainsi qu'entre ces deux catégories phylogénétiques d’oiseaux. À ce jour, selon l’OMS les risques sanitaires pour l’homme sont limités à des personnes en contact direct avec des oiseaux malades (ou des œufs ou déjections/fumiers provenant d’animaux malades)[4].
D'abord détecté en Irlande dans les années 1980, puis aux États-Unis, puis plusieurs fois repéré dans les années 2000-2014 en Chine (en 2010, avec un virus dérivant d’une souche trouvée sur une oie « Goose/Guangdong/1/1996 (Gs/GD) » puis détecté chez des canards d’élevage du Jiangsu en Chine[5]), puis au Japon, et surtout en Corée du Sud où plusieurs souches de variants réassortis du H5N8 inhabituellement pathogènes du virus[6] ont causé de graves épidémies aviaires[7] - [8]).
Dénominations
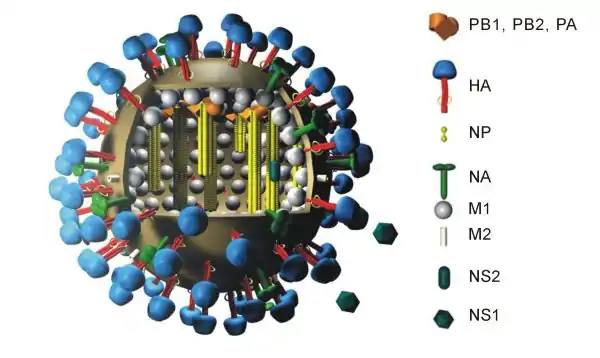
- Le nom générique « H5N8 » fait référence à deux sous-types d’antigènes présents à la surface du virus :
- l’hémagglutinine (HA) de type 5 (faisant notamment l’objet d’une surveillance en Corée dans les années 2010) ;
- la neuraminidase (NA) de type 8.
- Chaque variant de ces sous-types est nommé d’après l'espèce, le pays et l'année de découverte, avec par exemple A/Turkey/Ireland/1378/83 - H5N8 décrivant un virus trouvé chez la dinde.
Apparu en Irlande en 1983 (chez des dindes et canards), puis aux États-Unis, puis plusieurs fois repéré dans les années 2000-2014 en Chine (en 2010, avec un virus dérivant d’une souche trouvée sur une oie « Goose/Guangdong/1/1996 (Gs/GD) » ensuite détecté chez des canards d’élevage du Jiangsu[5]), au Japon, et en Corée du Sud où plusieurs variants réassortis du H5N8[6] ont alors causé de graves épidémies aviaires (avec dans ce cas un variant inhabituellement pathogène du virus[7] - [8]).
L'adjdonction d'un préfixe HP au nom d'un virus (ex. : influenza A HP H5N8 signifie que cette souche est hautement pathogène pour ses hôtes aviaires. Parfois ce type de virus peut muter et s'adapter à l'Homme, au porc ou d'autres mammifères (chiens, chats, phoque…).
Symptomatologie
La période d'incubation chez les volailles peut être de quelques heures à quelques jours (1 à 3) chez les oiseaux individuels[9] et jusqu'à 2 semaines dans le troupeau. Une période d'incubation de 21 jours, qui tient compte de la dynamique de transmission du virus, est utilisée pour une population aviaire dans le cadre de la lutte contre la maladie. On pense également que la période d'incubation des virus de la grippe aviaire chez les mammifères est courte et peut ne durer que 1 à 2 jours dans certains cas[10].
Chez les oiseaux :
- Chez le canard d'élevage chinois (canard de Pékin) exposé à 3 variants du sous-types H5N8 coréens étudiés en 2014, quand l'animal n'était pas asymptomatique ou qu'il n'a pas guéri, on a observé un rapide amaigrissement et affaiblissement, un regard vitreux des secousses de la tête puis la mort[11] ;
- Chez des sarcelles élégantes expérimentalement infectées, l'une est morte 3 jours après l'inoculation, sans avoir présenté de symptômes particuliers ; d'autres ont produit une quantité importante de virions, mais sans symptômes apparents chez l'animal infecté[11] ;
- Par contre, aucun des Colverts sauvages infectés expérimentalement n'est mort, et ils n'ont présenté que des symptômes bénins ou aucun symptôme, bien qu’excrétant de grandes quantités de virions (plus qu'avec le H5N1)[11].
Chez l'Homme : les symptômes attendus d'une infection par le virus H5N8 devraient principalement être respiratoires et de type "syndrome pseudo-grippal" (fièvre, frissons, maux de tête, toux et fatigue).
Un risque accru de conjonctivite a également été associé à ce virus chez la ou les personnes proches d’oiseaux malades ou de matières contaminantes (fientes…)[12].
Histoire écoépidémiologique
En Asie
Un nouveau variant hautement pathogène a sévi dans la péninsule sud-coréenne début [13] - [7] - [8], avec une extension rapide et géographiquement large des foyers (8 foyers éloignés les uns des autres[14]. En moins d'un an, ce sont en 2014 plus de 10 millions de volailles d’élevage qui ont dû être abattues dans le pays, [« soit presque 6 % de la production nationale »[15]. La Corée du Nord, déjà touchée par le H5N1 en 2013 reconnait en avoir également été fortement touchée par le H5N8 et avoir euthanasié de nombreux oiseaux[16].
Des oiseaux sauvages ont aussi été trouvés touchés par le virus A H5N8 dont la Sarcelle élégante ainsi que d’autres oiseaux migrateurs (infectés et morts du virus)[17] - [18] - [19] - [20].
Un an plus tôt, AH5N8 avait aussi été trouvé sur un canard chinois vendu dans un marché de volailles vivantes[21] - [22].
Le variant hautement pathogène HP H5N8 qui a sévi en Corée du Sud en 2014 est réassorti et semble avoir nettement gagné en pathogénicité, tant pour les oiseaux sauvages que domestiques. Il a été isolé sur des oiseaux migrateurs sauvages (parfois asymptomatiques) et chez des oiseaux d’élevage (vivants et morts) et notamment chez des Colverts (vivants et morts), mais aussi chez des poulets, oies et canards d’élevage avec en général plus de 70 % d’oiseaux infectés dans les élevages touchés[20].
Le , le Japon a signalé à l’OIE un cas d’infection sub-clinique sur la côte Est[23], suivi d’un foyer signalé (Chosei-gun, Nagara-machi, CHIBA) le . Le , il est confirmé que 2 échantillons fécaux d’Anatidae sauvages prélevés le (parmi un total de 50) contenaient le H5N8. Une étude de pathogénicité virale est annoncée.
À partir du , trois élevages de volailles du sud-ouest du Japon sont victimes de cette grippe aviaire. 85 000 poulets au total sont exterminés dans ces trois fermes situées à Miyazaki, Nobeoka et Nagato[24]. Le , un nouveau cas apparaît à Kasaoka : l'intervention des forces d'autodéfense japonaises est demandée pour tuer les 200 000 poulets de cette ferme dans les quatre jours suivant, selon le protocole[25]. Une zone de quarantaine est établie dans un rayon de dix kilomètres, concernant 21 fermes pour près d'un million de poulets[25]. Un nouveau cas se déclare le à Arita, les 73 000 poulets de cet élevage et d'un autre voisin sont tués[26].
En Europe
Les premiers foyers et cas connus de H5N8 (virus a priori d’origine asiatique) ont été détectés en Europe en 1983 dans des élevages de volaille (en Irlande, et d'autres ont suivi épisodiquement).
- Irlande : L'épidémie zoonotique (sans doute la plus connue avant 1994) de grippe aviaire due au sous-type viral H5N8 en Europe a eu lieu en Irlande en 1983[27].
Les volailles sur deux élevages avicoles avaient alors présenté les symptômes habituels d’une grippe aviaire, avec en plus une diarrhée marquée et des signes de nervosité et la dépression. Les volailles des élevages géographiquement les plus proches n’ont pas tardé à montrer les mêmes signes d'infection, bien qu’aucun contact entre les exploitations agricoles n’ait pu être démontré. En tout, environ 8 000 dindes, 28 020 poulets et poussins et 270 000 canards avaient alors été abattus (soit 97 % de tous les canards d’élevages commerciaux du pays à cette date)[28].
Pour les variants de ce virus qui ont pu être testés en le laboratoire, les résultats cliniques ont démontré que les dindes étaient les plus vulnérables à l'infection, mais que ce virus ne produisait pas de symptômes chez les canards ou ne les affectaient pas[29]. - Allemagne : De nouveaux cas ont été repérés en 2014, avec un variant confirmé le [30] dans un élevage industriel de dindes en Allemagne (dans le Land du Mecklembourg-Poméranie-Occidentale, dans le nord-est du pays ; au sud du littoral de la mer Baltique, avec 31.000 dindes potentiellement concernées et abattues par précaution).
. Une sarcelle d'hiver (Anas crecca) apparemment saine, abattue par des chasseurs et testée dans le cadre du programme régional de surveillance oiseau sauvage du land de Mecklembourg-Poméranie-Occidentale était "positive" pour ce virus AHP(H5N8)[31]. - Pays-Bas : La présence du même virus est - quelques jours plus tard - confirmé aux Pays-Bas, avec un premier foyer (confirmé le ) à Ter Aar dans un élevage de 150.000 volailles à Hekendorp (village de la commune néerlandaise d'Oudewater, dans la province d'Utrecht, non loin des zones humides du Nieuwkoopse plassen. (les 150 000 dindes (poulets selon d’autres sources) ont été abattues (par asphyxie au CO2) par précaution le 17 nov).
Une seconde exploitation néerlandaise est touchée, située à 25 km de la 1re[32]. D’autres exploitations néerlandaises se sont rapidement révélées touchées par un virus grippal qui semble être le même[33]. les Pays-Bas sont le premier exportateur de volailles industrielles en Europe (plus d’un million de tonnes par an). - Royaume-Uni: Quelques jours après les cas néerlandais, le Royaume-Uni signale un foyer (le ) dans un grand élevage de canards situé à Nafferton (en) dans le Yorkshire de l'Est[34] - [35]. Cette région est susceptible de recevoir en automne des oiseaux migrateurs venant de l’Est, mais l’entreprise élève ses canards pour le compte de « Cherry Valley », leader anglais dans ce marché, produisant environ 7 millions de canards de Pékin chaque année au Royaume-Uni[12], et qui possède également des bureaux en Chine et en Allemagne rapporte le journal The Telegraph. Le journal précise que cette entreprise élève aussi 2,8 milliards de canards par an en Chine. Ce journal cite aussi John Oxford (professeur émérite de virologie à l'Université de Londres) ; ce dernier rappelle que les virus grippaux ne sont pas transportés par le vent à grande distance, mais que des vêtements ou les trousses à outils de travailleurs se déplaçant entre l’Allemagne et l’Angleterre auraient pu être "contaminées" et ainsi étendre l’épidémie d’un pays à l’autre. Selon lui des œufs, des fientes ou des transferts d’oiseaux vivants pourraient aussi expliquer une même source pour deux foyers éloignés[12].
L'autorité sanitaire anglaise et l'entreprise ont annoncé qu'environ 6000 canards de cet élevage devaient être tués au CO2 puis brûlés dans un site sécurisé. Les fonctionnaires du DEFRA ont aussi demandé à tester les derniers lots d’œufs mis en incubation dans l'écloserie de l'entreprise (à Usselby, dans le Lincolnshire)[12]. - Italie: le à Veneto, mais un autre cas allemand le même jour .
Les premiers foyers européens sont apparus presque conjointement, mais pour certains distants de à 25 km à plus de 100 km les uns des autres[32]. Ce fait a fait suggérer que des oiseaux migrateurs aient pu contribuer à véhiculer le virus dans le pays et outre-manche, mais aussi de l’Asie à l’Europe de l’Ouest[2], hypothèse fréquemment avancée pour ce type d’épidémie/zoonose. Cependant, il ne s’agit que d’une hypothèse parmi d’autres, car dans le passé des transports de volailles ou de poussins ou le déplacement de personnes ont aussi été des causes prouvées de diffusion du virus.
Ces cas ont suscité en Belgique, France, Suisse et dans d’autres pays proches un renforcement de la veille sanitaire et vétérinaire (avec en France et une saisine l'Anses par le ministère de l'Agriculture).
Une épizootie d'influenza A-H5N8 se déclare fin 2020 en Europe[36]. Elle atteint un premier élevage français début décembre, dans le département des Landes[37] - [38].
Un virus de type H5N8 est détecté dans un cadavre de phoque retrouvé échoué sur la côte polonaise de la mer Baltique en novembre 2016[39].
Précautions prises en Europe
Conformément à la réglementation européenne et pour limiter les risques commerciaux ou liés aux transports de marchandises ou d’animaux susceptibles de contribuer à une diffusion du virus, les exportations de volailles et d’œufs ont été suspendues pour une durée de 72 heures, et de 30 jours pour les élevages situés dans un rayon de 10 kilomètres autour de celui affecté[15].
Le directeur de l’OIE a également rappelé qu’« il est également nécessaire d'essayer d'éviter les contacts entre les oiseaux d'élevage et les oiseaux sauvages. Par exemple, il faut mettre la nourriture des volailles d'élevage à l'intérieur des bâtiments, au lieu d'à l'extérieur, pour qu'elle ne soit pas contaminée par les oiseaux sauvages lorsqu'ils la mangent »[2].
Les travailleurs exposés à des volailles malades ou jugées « porteuses saines » doivent médicalement surveillés durant dix jours afin de documenter de possibles symptômes et un traitement préventif antiviral (de type Tamiflu) est parfois proposé[12].
En France : Étant donné la géographie des premières zones déclarées touchées à l’automne 2014 et étant donné le sens des flux migratoires automnaux (Globalement et principalement nord-sud), la France s’attend à aussi détecter des foyers où trouver des animaux sauvages (dont potentiellement des espèces gibier telle que les canards) touchés.
Le ministère français de l'agriculture s’est dit prêt[40] à « activer le Plan national d’intervention sanitaire d’urgence », plan qui concerne les « professionnels des filières animales » et qui s’applique obligatoirement[41] en liaison avec la Commission Européenne[42] et sur la base d’un décret (de ) fixant les « modalités de fixation de la liste des dangers sanitaires de première et deuxième catégorie et d'approbation des programmes collectifs volontaires ainsi que des schémas régionaux de maîtrise des dangers sanitaires visant à organiser la prévention, la surveillance et la lutte contre les dangers sanitaires concernant les animaux » (et les végétaux)[3]).
Selon France 3, en Picardie (zone de passage de millions d’oiseaux migrateurs), la Fédération des chasseurs a alerté ses adhérents en les encourageant à signaler à l’ONCFS les cygnes et canards retrouvés morts[43].
En Europe en 2020
En 2020-2021, 380 000 canards ont été tués en France: la pandémie se propage au sein des élevages, avec la faune sauvage, mais le recours à une même société de transport pourrait également jouer un rôle.
D'autres facteurs peuvent également être en cause comme le manque de distanciation physique des animaux ou l'aspect mono-race des élevages[44].
Aux États-Unis
De 1998 (plus de 10 ans après la détection des premiers cas européens) à 2011, plusieurs foyers ont été signalés aux États-Unis[45]
Classification du virus H5N8, spécificités et statut épidémiologique
Les membres de cette famille de virus évoluant très rapidement, ils sont regroupés, quand on dispose des connaissances le permettant, par arborescence phylogénétique en clades à partir des souches originelles identifiées.
Bien que H5N8 ait autrefois été considéré comme l'un des sous-types peu pathogènes et à faible risque de le devenir, son statut épidémiologique est en train de changer, car plusieurs fois, le H5N8 a joué un rôle d’incubateur naturel pour le virus H1N1 hautement pathogène[46].
En 2014, les souches identifiées en Corée du Sud sont réassorties à partir de virus aviaires différents[47], avec 2 variants identifiés en 2004 dans ce pays, dits 1) « souche Gochang » et 2) « souche Buan »). Selon les données accumulées durant les 6 premiers mois de 2014, ce H5N8 est susceptible de causer des pertes importantes dans les élevages et de toucher des oiseaux d'eau sauvages, mais ne semble pas contaminant pour l’Homme (sur 397 analyses sérologiques de personnes à risque, c'est-à-dire ayant approché ou manipulé des volailles malades ou susceptible de l’être, aucune sérologie positive n'a été détectée en Corée du Sud)[47].
Une étude a testé la pathogénicité d’une souche coréenne de 2014 sur la souris de laboratoire et le furet et a conclu a une pathogénicité accrue de l'une des souches coréennes pour les mammifères : la souche « H5N8 Buan 2 » s’est montrée très peu pathogène pour le furet et « modérément hautement pathogène » pour la souris[47].
Concernant le tropisme du virus pour certains organes-cible : Pour 10 types d’organes/tissus explorés, la charge virale était plus élevée dans les poumons, la trachée et parfois l’intestin ; trois organes susceptibles de contribuer à la réplication/dissémination du virus[48]. Les auteurs de cette étude ont conclu à une « possibilité sporadique d’infections de petits groupes de cas humains chaque fois que les virus de la grippe circule chez les poulets », notamment pour les personnes directement exposées aux volailles[48]. Ils insistent néanmoins sur le fait que le AHP (H5N8) ne semble pas avoir en 2014 franchi la barrière des espèces dans la nature[48], et qu’il convient de continuer à aussi surveiller les virus A (H7N9), A (H5N1) et A (H5N6)[48]. Cependant, dès , les autorités de Corée du Sud ont signalé que le virus est apte à infecter le chien (onze chiens, asymptomatiques, testés entre le 11 et le ont révélé des anti-corps au H5N8, dans deux fermes (à Cheonan, à 80 km au sud de Séoul, et à Buyeo, à environ 100 km plus au sud)[49]. Or le chien est proche de l'homme et est consommé en Corée (cynophagie).
Au même moment un article du journal Clinical Infectious Diseases (en) signale que dans la province du Guangdong (Chine), des tests faits sur des chiens errants fréquentant les marchés de volaille ont pour la première fois détectés des chiens ayant été infectés par un sous-type viral proche (virus de la grippe A (H10N8)), ce qui laisse penser que l'organisme canin peut aussi être un lieu de réassortiment génétique pour plusieurs souches virales en circulation[50]. Or le H10N8 pourrait ne pas être anodin pour l'Homme : quelque temps auparavant (le ), la Chine avait signalé puis confirmé qu'une patiente de 75 ans (morte d'une pneumonie sévère dans la province du Jiangxi) était la 1re infection humaine connue par un virus du sous-type A (H10N8)[50]. ; deux mois plus tard (le ) 3 autres cas humains de H10N8 étaient ont été confirmés dans la même province du Jiangxi, dont deux mortels[50].
Chez l’oiseau, chez l'Homme
- Chez les oiseaux, il existe 16 sous-types de virus grippaux pour l’hémagglutinine. Seuls les sous-types H5 et H7 sont actuellement réputés hautement pathogènes chez les oiseaux. Ces virus grippaux sont réputés être habituellement transportés à travers le monde dans les intestins des oiseaux sauvages migrateurs. Ils sont très rarement mortels et souvent n’occasionnent pas de symptôme visible. Cependant certains sous-types (H5N1 par exemple) ont produit des agents infectieux parmi les plus mortels jamais enregistrés chez les individus infectés.
- Chez l’homme, les sous-types de virus grippaux pathogènes ou hautement pathogènes concernent essentiellement les porteurs des antigènes N1 et N2 (qui comprennent la grippe commune saisonnière, et dont proviennent les souches sélectionnées chaque année pour la fabrication des vaccins antigrippaux, le plus souvent dû sous-type N2, mais pas encore pour ceux des sous-types H5 moins bien connus). Le virus A (H5N8) est endémique chez diverses espèces d'oiseaux mais il n’est pas réputé directement pathogène pour l'homme (ou en tous cas bien moins que le sous-type H5N1).
Indices, facteurs ou conditions de dangerosité du virus H5N8
Les virus de type « HxNx » semblent tous avoir une origine aviaire ou en grande partie aviaire. Ils co-évoluent en permanence avec le système immunitaire des oiseaux, généralement sans provoquer de mortalités massives détectables chez leurs hôtes à l'échelle des métapopulations. Les migrations aviaires sont l’occasion de transferts géographiques de virus, habituellement sans conséquences majeures pour les populations d'oiseaux, mais certains de ces virus - exceptionnellement - peuvent muter (par exemple par glissement antigénique ou à la suite d'un ré-appariement pour devenir plus pathogènes pour les oiseaux et/ou très pathogènes pour d’autres espèces (on parle alors de « franchissement de la barrière des espèces »). Dans ce cas des problèmes de sécurité sanitaire et de risque biologique peuvent apparaître.
Lors de la découverte du premier foyer aviaire anglais de 2014, le gouvernement britannique, s’est voulu rassurant arguant que « le risque pour la santé humaine est très faible, et il n’y en a aucun pour la chaîne alimentaire »[15]. Au même moment, Elizabeth Mumford de l’OMS se montrait prospectivement plus nuancée en expliquant que : « Si sa propagation augmente, il n'y a pas de raison qu'il n'y ait pas de cas humains, mais tout dépend du virus et de son évolution »[15].
Risques et dangers épidémiologiques
L'aspect potentiellement dangereux du virus AH5N8 pour l'Homme en 2014 est lié au fait que le génome de variants recombinés de ce virus pourraient intégrer des gènes du H5N7 (plus infectant pour l’homme) et/ou du H5N1 HP (hautement pathogène). Une souche émergente pourrait alors être plus pathogène et/ou plus transmissible de l’animal à l’homme (et éventuellement d’homme à homme).
Or :
- ces deux virus sont endémiques depuis plusieurs années en Asie ;
- Le H5N1 apparu en en Asie du Sud-Est a [de 2003 à oct 2014] officiellement infecté au moins 668 personnes, dont 393 sont mortes, ce qui lui confère un taux de mortalité de 59 %, - plus élevé que celui de l’épidémie de fièvre Ebola en Afrique de l'Ouest en 2014 (36 %) (cette comparaison n'est donnée qu'à titre indicatif, car ces deux zoonoses diffèrent épidémiologiquement : Ebola se transmet plutôt d’humain à humain, alors que H5N1 s’acquiert essentiellement par contact avec un oiseau ou autre animal infectés) ;
- Le H5N8 peut être véhiculé par des canards « porteurs sains » (c'est-à-dire asymptomatiques mais excrétant le virus) comme on en a par exemple trouvé en Corée du Sud en 2011 parmi les oiseaux d’eau migrateurs et chassables[51] - [52].
- Une recombinaison potentiellement dangereuse pourrait aussi se faire avec d’autres variants du « groupe H5 » connus (au moins depuis les années 1980) pour être parfois très pathogènes pour la volaille et/ou pour l'homme, le H5N1 étant le plus préoccupant de 2000 à 2015 voire au-delà car il continue à circuler en Asie et au Moyen-Orient (ayant par exemple en 2014 causé 3 morts humaines en Égypte dont 2 en )[53].
- Pour qu’il soit une source de risque pandémique, il n'est pas nécessaire que le virus soit mortel, il suffit qu'il acquiert une capacité à infecter l'Homme et une forte contagiosité d’homme à homme (ou de d'oiseau à mammifères, dont l’homme). Mi-, aucun indice de telle adaptation n'existe.
- Comme rappelé par Elizabeth Mumford de l’OMS lors d’une conférence de presse le ; concernant le H5N8 : « les canards sauvages peuvent continuer à migrer tout en étant infectés par le virus et le propager »[15]. Et il est « absolument certain » que d'autres volatiles seront affectés et « probable que des humains le soient également "compte tenu de la large circulation du virus" »[4], mais toujours selon Elizabeth Mumford sauf si le virus évoluait en s’adaptant à l’Homme ces cas humains devraient être « quelques cas isolés » touchant des personnes en contact étroit avec des oiseaux porteurs du virus car le sous-type H5 n’a pas à ce jour montré de capacité à être contagieux d’un humain à l’autre[4]. Selon elle « Tous les gènes de ce virus (H5N8) sont tous des gènes aviaires. Il n'y a pas de composant ni humain, ni porcin dans le génome", l'analyse génétique montre qu'il préfère se lier à des récepteurs aviaires. Cela demeure un virus aviaire »[4].
Risques et dangers écoépidémiologiques
L’importance du H5N8 en termes de risque écoépidémiologique est mieux cernée :
- Il a été constaté que MDK / W452 (nouveau virus AH5N8 notamment présent en Corée du Sud en 2014 et jugé « réassorti » en Chine orientale à partir de virus hébergés et transportés par des oiseaux sauvages aquatiques migrateurs[54] se montre souvent mortel pour les poulets, mais qu’il semble avoir une virulence très atténué chez le canards (0 à 20 % de morts). Le Canard colvert peut donc être porteur sain)[55], et efficacement transporter et diffuser le virus[54], d’autant qu’il a été montré en 2014 que la réplication virale et l’excrétion de virions sont plus élevées dans l’organisme des colverts infectés par le H5N8 que dans ceux de colverts expérimentalemnet infectés par H5N1[54], et que le virus peut se propager par contacts entre canards domestiques cet canards colverts[54].
- Un virus de la grippe aviaire devenu « hautement pathogène » (HP) peut (notamment s'il trouve une population immunitairement affaiblie) décimer certaines populations d’oiseaux sauvages ou domestiques, comme cela a été le cas avec un variant de type Qinghai A H5N1 qui a en 2005 causé d’importantes mortalités d’oiseaux d'eau avant leur migration automnale de l’Asie vers l’Europe et l’Afrique[56] - [57].
Des transferts intercontinentaux de virus peuvent aussi se faire via le commerce d’oiseaux, de poussins ou d’œufs ou même de fumier à base de fientes. Il peut aussi exister des phénomènes de transferts entre des oiseaux sauvages migrateurs et des oiseaux d’élevages (industriels notamment), et inversement. - Plusieurs milliards de canards sont élevés en Chine chaque année, et leurs fientes sont également contaminantes. Et dans certains pays (comme la France) des millions de canards d’élevage sont diffusés dans la nature en automne pour les besoins de la chasse en plaine ou dans les zones humides.
Risques pour l'Industrie de la volaille
S'il s'adapte bien aux animaux d'élevages et à leur contexte de gestion, Le H5N8 (et en particulier ses variants très pathogènes) deviendront aussi un enjeu économique important pour les éleveurs.
- Il a été périodiquement détecté (par exemple dans un élevage dans l’Idaho en 2008[58]), mais fait maintenant l’objet d’une attention particulière, car un variant hautement pathogène de H5N8 a été détecté en 2009-2010 en Chine continentale (en même temps que trois variant du H5N5 dérivant de la lignée asiatique H5N1 hautement pathogènes de la grippe aviaire)[59]. Les études de pathogénicité faites sur ces 4 variants ont montré qu’ils étaient tous très virulente chez les poulets, alors que leur virulence variait (de modérée à forte) chez la souris. Leur virulence variait aussi (de légère à intermédiaire) chez les canards colverts expérimentalement infectés[59]. Une autre étude a montré que ce virus peut être pathogène pour les chiens et plus encore pour les chats.
- Des analyses phylogénétiques ont montré que ces virus étaient des virus réassortis ayant acquis des éléments génomiques de virus H5N1 non identifiés (gènes PB1, NP et NA) et se sont développés en trois génotypes distincts (B-D)[59]. Ces résultats ont mis en évidence l'émergence et le développement de virus de grippe aviaire hautement pathogène H5 à plusieurs sous-types NA dans les zones d'endémie du H5N1, constituant une menace potentielle pour l'industrie de la volaille et de la santé publique[59]).
Une caractérisation moléculaire a en outre prouvé que chacun de ces virus pouvait résister à des agents antiviraux[59]. - Une souche européenne de H5N8[60] a été testée en 1986) en laboratoire sur plusieurs espèces aviaires domestiquées (poulets de 2 semaines, dindons, cailles et canards, infectés par voie intra‐musculaire, intra‐nasale et par contact avec 8 souches virales de grippe appartenant au sous type H‐5)[61]. Cette souche, comme plusieurs autres testées lors de la même étude s’est montrée « extrêmement pathogène pour le poulet et le dindon », mais dans ce cas sans signe clinique ni mortalité observés chez les canards expérimentalement infectés. Deux virus seulement, dk/Ireland and ty/Ireland, ont entraîné chez ceux‐ci des réponses sérologiques alors que l'injection par voie intra‐musculaire de tern/SA et ty/Italy n'a entraîné des réactions HI positives que chez quelques canards[61]. Les cailles ont fait preuve de résistance à certains des virus A H5N8 testés (pourtant très pathogènes pour le poulet et la dinde) et moindrement à d’autres[61]. La transmission du virus à partir des oiseaux infectés par voie intra‐nasale et à partir de ceux placés à leur contact a varié considérablement à la fois avec les hôtes et les virus ainsi qu'avec les différentes combinaisons de ceux‐ci[61]. Bien que les récepteurs de l’hôte ciblés par les protéines externes du virus MDK/W452(H5N8) soient principalement aviaires, ce virus possède une certaine capacité théorique à se fixer sur des récepteurs de type mammifères ou humains, ce qui pourraient peut-être permettre à ce virus d’infecter des tissus des voies respiratoires humaines et de s’y reproduire. Chez la souris, la souche virale MDK/W452(H5N8) s’est néanmoins montrée modérément pathogène, avec un tropisme tissulaire moins large que dans le cas des souches A (H5N1) hautement pathogènes du virus de la grippe.
- Des recombinaisons génétiques avec le H5N1 qui circule encore, pourrait modifier l'évolution génétique des souches préexistantes de H5N8 notamment dans les élevages de volaille.
En Angleterre, c’est un élevage de canards qui a été touché en 2014[53], or les canards sont réputés résistants à ce virus[59] voire susceptibles de se comporter en « porteur sain »[59] en n’étant que modérément affaiblis par le virus. Des canards sauvages pourraient ainsi véhiculer le virus vers les élevages, puis inversement les élevages pourraient contaminer d'autres canards sauvages.
Risques liés à l'érosion génétique
Il est maintenant scientifiquement admis que l'érosion génétique diminue les chances et capacité d'adaptation des espèces aux maladies et aux changements de leur environnement[62].
Il existe un paradoxe et une source de biais en gestion du risque sanitaire avicole, induit par trois problèmes au moins, qui contribuent à faire des élevages et de la nature des lieux anormalement et de plus en plus favorables aux grandes épizooties :
- Les euthanasies massives de volailles d'élevages victimes d'épizooties contribue indiscutablement à court et moyen termes à limiter la diffusion de souches virales HP. Mais elles contribuent dans le même temps - et irréversiblement - à éroder le patrimoine génétique des animaux d'élevage[63].
- L'introduction dans la Nature d'oiseaux de repeuplement issus d'élevages (faisans, cailles, canards, perdrix, etc.) contribue également à une perte de diversité génétique et à une pollution génétique du métagénome des populations de ces espèces. À titre d'exemple, en France ce sont environ un million de canards colverts d'élevage et 14 millions des faisans qui sont ainsi annuellement artificiellement élevés et relâchés dans la nature pour la chasse[64] - Moutou, F. (1997). Place des oiseaux sauvages en épidémiologie animale. Oiseaux à risques en ville et en campagne : vers une gestion intégrée des populations ?, 263 p ; Éditions Quae, (avec Google Livre).
- La primauté et les aides financières données à l'élevage intensif et industriel, conjuguées à la mondialisation de l'économie avicole ont permis d'énormes gains de productivité en deux siècles, mais au prix d'un effondrement de la diversité génétique des espèces avicoles, et d'une forte diminution du nombre de races et souches élevées dans le monde.
Et pour diverses raisons (pratiques, économique et sanitaires), les oiseaux reproducteurs utilisés pour remplacer ceux qui sont morts de maladie ou ont été euthanasiés (par millions chaque année depuis quelques décennies) dans les élevages industriels, artisanaux ou familiaux sont presque toujours des oiseaux issus de souches sélectionnées pour les besoins de l'industrie avicole et non pour leur diversité génétique ou capacité à résister aux virus et maladies bactériennes opportunistes. Malgré la mise en place de protocoles inspirés des techniques de minimisation des coefficients de consanguinité[65] L'homogénéisation génétique de l'élevage mondial faciliter les épizooties mondiales.
Risques liés à la chasse
Des canards d’élevage introduits à fins de repeuplement dans la nature en saison de chasse (automne-hiver) comme « gibier » pour alimenter les loisirs cynégétiques et/ou compenser les pertes dues aux tirs des années précédentes[66], sont chassés dans plusieurs pays européens (dont en chasse de nuit dans certains pays). D'autres oiseaux chassables sont potentiellement vulnérables au H5N8. Ces animaux seront souvent en contact avec les chiens de chasse (dressés pour les ramener dans leur gueule) et/ou avec les chasseurs et leur famille ou avec d’autres consommateurs ou utilisateurs de ces canards tirés à la chasse.
Notes et références
- (en) « Virus Taxonomy: 2018b Release », ICTV, (consulté le ).
- « OIE/Grippe aviaire : il est possible que le virus H5N8 découvert en Europe est venu de l'Asie » (Interview de B Vallat, directeur de l’OIE) 20 novembre 2014 d’après l’agence de presse Xinhua (18 novembre 2014) reprenant un communiqué du Dr Bernard Vallat, directeur général de l'Organisation mondiale de la santé animale (OIE).
- .Décret no 2012-845 du 30 juin 2012 relatif aux dispositions générales organisant la prévention, la surveillance et la lutte contre les dangers sanitaires de première et deuxième catégorie NOR: AGRG1220694D
- L’Obs/Monde (2014) « L'OMS prévoit peu de cas humains avec la grippe aviaire H5N8 » ; Publié le 18-11-2014 à 18h46]
- Wu H, Peng X, Xu L, Jin C, Cheng L, Lu X, Novel Reassortant Influenza A(H5N8) Viruses in Domestic Ducks, Eastern China. Emerg Infect Dis. 2014;20:1315–8.
- Avian Flu Diary (avec carte du Japan’s MAFF pour la Corée du Sud en 2014)
- Lee, Y. J., Kang, H. M., Lee, E. K., Song, B. M., Jeong, J., Kwon, Y. K., ... & Lee, H. S. (2014). « Novel reassortant influenza A (H5N8) viruses, South Korea, 2014 ». Emerging infectious diseases, 20(6), 1087 DOI: 10.3201/eid2102.141268
- Kim YI, Pascua PN, Kwon HI, Lim GJ, Kim EH, Yoon SW, Park SJ, Kim SM, Choi EJ, Si YJ, Lee OJ, Shim WS, Kim SW, Mo IP, Bae Y, Lim YT, Sung MH, Kim CJ, Webby RJ, Webster RG, Choi YK. (2014), « Pathobiological features of a novel, highly pathogenic avian influenza A(H5N8) virus » ; Emerging Microbes & Infections. 2014 Oct; 3(10)e75 (résumé)
- Dynamique de propagation du virus influenza aviaire hautement pathogène (IAHP) sous-type H5 (clade 2.3.4.4) chez les volailles domestiques en France 2016-2017
- Avian Influenza Fowl Plague, Grippe Aviaire
- yun-Mi Kang, Eun-Kyoung Lee, Byung-Min Song, Jipseol Jeong, Jun-Gu Choi, Joojin Jeong, Oun-Kyong Moon, Hachung Yoon, Youngmi Cho, Young-Myong Kang, Hee-Soo Lee, and Youn-Jeong Lee, Novel Reassortant Influenza A(H5N8) Viruses among Inoculated Domestic and Wild Ducks, South Korea, 2014 ; Volume 21, mis en ligne en novembre 2014 avant sortie du no 2 février 2015 ; DOI: 10.3201/eid2102.141268
- Nicola Harley & Edward Malnick (2014) Article intitulé « Bird flu outbreak: cull begins at East Yorkshire duck farm », publié par The Telegraph, 2014-11-19, consulté 2014-22-19
- yonhapnews (2014) News intitulée A cause du H5N8, 2000000 de volailles ont été abattues en été abattues en Corée du Sud, 30 janvier 2014
- Highly pathogenic avian influenza, Information received on 10/02/2014 from Dr TaeYung Kim, Director General, Livestock Policy Bureau, Ministry for Food, Agriculture, Forestry & Fisheries, Sejong-Si, Korea (Rep. of), OIE, Fev 2014
- Romain Loury (2014) art. intitulé « La grippe aviaire revient ; La grippe aviaire refait surface en Europe, avec l’arrivée d’une nouvelle souche originaire d’Asie, la H5N8. Très pathogène pour la volaille, son risque de transmission à l’homme semble pour l’instant assez faible, rassurent les autorités européennes », 2014-11-19, consulté 2014-11-22
- Yonhapnews (2014), News intitulée : La Corée du Nord touchée par une vaste épidémie de grippe aviaire, Séoul, 2014-04-09 (Yonhap)
- NIH (2014) Liste von H5N8-Nachweisen ; Auf: fludb.org - Influenza Research Database, consulté 2014-11-06
- [New Avian Flu Virus Ravages Poultry in Korea] source : Sciencemag.org du 2014-02-06
- Weltorganisation für Tiergesundheit: Highly pathogenic avian influenza, Korea (Rep. of). ; publiée 18/01/2014 par le Dr TaeYung Kim, Directeur Général, du “Livestock Policy Bureau, Ministry for Food, Agriculture, Forestry & Fisheries, Sejong-Si, de la république du Corée”
- J. Jeong, H. M. Kang, E. K. Lee et al.: “Highly pathogenic avian influenza virus (H5N8) in domestic poultry and its relationship with migratory birds in South Korea during 2014”. In: Veterinary microbiology. (Vet Microbiol.) 10. Octobre 2014, Bd 173, Nr. 3-4, S. 249-57,
- Kunkun Zhao et al.: (2013)Characterization of three H5N5 and one H5N8 highly pathogenic avian influenza viruses in China. In: Veterinary Microbiology. Band 163, Nr. 3–4, 2013, S. 351–357, doi:10.1016/j.vetmic.2012.12.025
- Wu H, Peng X, Xu L, Jin C, Cheng L, Lu X, et al. (2014) Novel reassortant influenza A(H5N8) viruses in domestic ducks, eastern China. Emerging infectious diseases. Aout 2014 ;20(8):1315-8
- rapport OIE (Japon, pour un évènement (d’infection sub-clinique) daté du 3 novembre 2014) ; test faits par isolement viral et RT-PCR
- Alexandre Ducom, « Crise de grippe aviaire H5N8 dans le sud-ouest du Japon », BE Japon no 712, le 9 janvier 2015
- Alexandre Ducom, « En bref : 4e cas de grippe aviaire au Japon, dans la préfecture d'Okayama », BE Japon no 713, le 16 janvier 2015
- Alexandre Ducom, « En bref : 5e cas de grippe aviaire au Japon, dans la préfecture de Saga », BE Japon no 714, le 23 janvier 2015
- Alexander, D. J., Murphy, T. M., & McNulty, M. S. (2003). « Avian influenza in the British Isles during 1981 to 1985 ». Avian Diseases, 70-78 (résumé)
- Dennis J. Alexaner et al.: Highly pathogenic avian influenza outbreaks in Europe, Asia, and Africa since 1959, excluding the Asian H5N1 virus outbreaks. In: David E. Swayne (Hrsg.): Avian Influenza. Blackwell Publishing, 2008, S. 223, (ISBN 978-0-8138-2047-7)
- Swain, David "Avian Influenza"
- Immediate notification report: Report reference: 14-015-00003 REF OIE 16474 (PDF) Meldung der deutschen Behörden an die Weltorganisation für Tiergesundheit ; 2014-11-06
- Martin Beer H5N8 HPAI virus detected in a wild bird in Germany, ProMED 22 Nov 2014
- Un autre cas de grippe aviaire aux Pays-Bas, Journal Le Métro, 21 novembre 2014
- CIDRAP (2014) European Centre for Disease Prevention and Control (ECDC) sounds H5N8 warning after another possible outbreak, Center for Infectious Disease Research and Policy ; Academic Health Center (University of Minnesota, Minneapolis), 2014-11-20, consulté 2014-11-22
- Bird flu: Culling to begin at Nafferton farm. Source : bbc.com 2014-11-18
- Bird flu outbreak: cull begins at East Yorkshire duck farm ; The Telegraph, 2014-11-19
- « Influenza aviaire : le point sur la situation en Europe », sur agriculture.gouv.fr (consulté le )
- « Bénesse-Maremne. L'exploitation de canards a bien été touchée par le virus H5 de l’influenza aviaire », sur actu.fr (consulté le )
- « Influenza aviaire : un élevage de canards infecté dans le département des Landes », sur agriculture.gouv.fr (consulté le )
- Dai-Lun Shin, Ursula Siebert, Jan Lakemeyer et Miguel Grilo, « Highly Pathogenic Avian Influenza A(H5N8) Virus in Gray Seals, Baltic Sea », Emerging Infectious Diseases, vol. 25, no 12, , p. 2295–2298 (ISSN 1080-6040 et 1080-6059, PMID 31742519, PMCID PMC6874272, DOI 10.3201/eid2512.181472, lire en ligne, consulté le )
- Communiqué diffusé le 17 novembre 2014
- European Commission. Council Directive 2005/94/EC of 20 December 2005 on Community measures for the control of avian influenza and repealing Directive 92/40/EEC [10 Nov 2014]. Voir http://eur-lex.europa.eu/legal-content/EN/TXT/?qid=1415609228714&uri=CELEX:32005L0094
- [ttp://daaf972.agriculture.gouv.fr/spip.php?rubrique145 Présentation de ce qu’est le Plan national d’intervention sanitaire d’urgence en France], Service déconcentré du Ministère de l'Agriculture.
- France 3 Grippe aviaire H5n8 : vigilance en Picardie, France 3 TV (info mise à disposition par Sabine et Bernard Godard, journalistes à FR3)
- https://www.lemonde.fr/planete/article/2021/01/13/grippe-aviaire-l-industrie-agricole-a-cree-un-nid-douillet-pour-les-pathogenes_6066123_3244.html
- Liste des cas de H5N8 ; source : fludb.org - Influenza Research Database, consulté 2014-11-06
- "RCI Inactivation of Avian Influenza". http://www.activtek.eu.
- « Reassortant strain from multiple source of Avian Influenza viruses (A/duck/Jiangsu/k1203/2010) » in Kisoon Kim (2014) « assessment of human infection with currently circulating H5N8 avian Influenza virus in Korea » ; National Institute of Health Korea Centers for Diseases Control and Prevention (KCDC)
- Kisoon Kim (2014) « Assessment of human infection with currently circulating H5N8 avian Influenza virus in Korea » ; National Institute of Health Korea Centers for Diseases Control and Prevention (KCDC) (autre lien/archive pour la même présentation)
- Yonhap (2014), News intitulée Des chiens touchés par la grippe aviaire 2014-03-24
- Shuo Su & al. (2014) First Evidence of H10N8 Avian Influenza Virus Infections among Feral Dogs in Live Poultry Markets in Guangdong Province, China ; Clin Infect Dis. (2014) doi: 10.1093/cid/ciu345 En ligne 2014-05-07
- Kim HR, Kim BS, Bae YC, Moon OK, Oem JK, Kang HM, H5N1 subtype highly pathogenic avian influenza virus isolated from healthy mallard captured in South Korea. Vet Microbiol. 2011;151:386–9
- Sakoda Y, Sugar S, Batchluun D, Erdene-Ochir TO, Okamatsu M, Isoda N, Characterization of H5N1 highly pathogenic avian influenza virus strains isolated from migratory waterfowl in Mongolia on the way back from the southern Asia to their northern territory. Virology. 2010;406:88–94
- Grippe aviaire : deux morts en Égypte, vigilance en Europe ; France 24, 19/11/2014, consulté 22/11/2014
- Kang HM, Lee EK, Song BM, Jeong J, Choi JG, Jeong J, et al. Novel reassortant influenza A(H5N8) viruses among domestic and wild ducks, South Korea, 2014. Emerging infectious diseases (Volume 21, Number 2—February 2015) (résumé)
- Young-Il Kim a& al. (2014) Pathobiological features of a novel, highly pathogenic avian influenza A(H5N8) virus ; Emerg Microbes Infect. Oct 2014; 3(10): e75., DOI :10.1038/emi.2014.75
- Chen H, Deng G, Li Z, Tian G, Li Y, Jiao P, The evolution of H5N1 influenza viruses in ducks in southern China. Proc Natl Acad Sci U S A. 2004;101:10452–7. DOIPubMed
- Liu J, Xiao H, Lei F, Zhu Q, Qin K, Zhang XW, Highly pathogenic H5N1 influenza virus infection in migratory birds. Science. 2005;309:1206. DOIPubMed
- Simunich, M. M. (2009). « H5N8 LPAI in an Idaho game bird farm-2008 ». Proceedings of the USAHA/AAVLD Committee on Animal Emergency Management. San Diego, California.
- Zhao, K., Gu, M., Zhong, L., Duan, Z., Zhang, Y., Zhu, Y., ... & Liu, X. (2013). Characterization of three H5N5 and one H5N8 highly pathogenic avian influenza viruses in China. Veterinary microbiology, 163(3), 351-357 (résumé)
- souche : A/duck/ Ireland/ 113/84 (H5N8), dk/Ireland
- Alexander, D. J., Parsons, G., & Manvell, R. J. (1986). Experimental assessment of the pathogenicity of eight avian influenza A viruses of H5 subtype for chickens, turkeys, ducks and quail. Avian pathology, 15(4), 647-662 (résumé)
- Filippo Barbanera, Oliver R.W. Pergams, Monica Guerrini, Giovanni Forcina, Panicos Panayides, Fernando Dini (2010) ; Genetic consequences of intensive management in game birds ; Biological Conservation ; Vol143, no 5, mai 2010, Pages 1259–1268 (résumé)
- Audiot, A. (1995) Races d'hier pour l'élevage de demain. Éditions Quae.
- Moutou, François Évaluation des risques d'épizootie
- De Rochambeau, H., & Chevalet, C. (1985). Minimisation des coefficients de consanguinité moyens dans les petites populations d’animaux domestiques. Génét. Sél. Évol, 17, 459-480.
- Raffin, J. P., & Lefeuvre, J. C. (1982). Chasse et conservation de la faune sauvage en France. Biological Conservation, 23(3), 217-241 (résumé).
Voir aussi
- Liste des principaux sous-types de virus de la grippe A (HxNy)
- Épizootie
- Grippe aviaire
- Pandémie grippale
- Risque pandémique lié à la grippe aviaire
- Histoire des épizooties de grippe aviaire
- Grippe (alias influenza ou flu en anglais)
- Grippe aviaire (alias peste aviaire)
- Grippe espagnole, pandémie de 1918.
- Grippe féline
- Grippe canine
- Grippe équine
- Virus H2N2
- Virus H1N1
- Virus H7N9
- Virus H7N7
- Zoonose