Hydrochimie
L'hydrochimie étudie les processus chimiques qui affectent la distribution et la circulation des composés chimiques des eaux[1]. Pour cela l'hydrochimie se sert essentiellement de la chimie (thermodynamique, acides-bases, précipitations-dissolutions, oxydation-réduction, interactions entre différentes phases, etc.), mais aussi de la biologie et de la géologie. Elle met en place des modèles propres tels les modèles de la dissolution du dioxyde de carbone, la précipitation et la dissolution des minéraux (oxydes, dioxydes, carbonates, etc.), la spéciation des métaux, les interactions solides-liquides. On peut également ranger dans l'hydrochimie les techniques et protocoles d'échantillonnage des eaux, l'étude de la pollution des milieux aquatiques et de nombreuses autres applications qui sont devenues des sciences à part entière au vu de leur complexité.
Applications
L'hydrochimie rencontre de nombreuses applications :
- l'origine d'une eau, de sa qualité ;
- le suivi de la qualité de l'eau (respect des normes) ;
- la détermination des flux par traçage naturel (étude des solutés et/ou des isotopes) ou artificiels (à la suite de l'injection de traceurs comme la rhodamine, etc.) ;
- la prospection minière (étude des métaux marqueurs des gisements traversés par l'eau) ;
- l'étude du cycle de l'eau et la paléoclimatologie (notamment par l'étude de la teneur en isotopes).
Méthodes d'analyse
La caractérisation de la composition de l'eau fait appel à différents procédés :
- l'analyse chimique élémentaire : déterminer la composition en éléments dissous d'une eau (concentration massique des différents solutés), en général traduite sous forme de teneurs en ions pour les éléments majeurs et exprimées habituellement en mg/L;
- les méthodes physico-chimiques : les analyses, initialement faites avec des réactions chimiques (dosages) élément par élément, sont maintenant faites avec des méthodes physiques ou physico-chimiques comme la chromatographie liquide haute pression (anions majeurs), la spectrométrie de flamme (cations majeurs), la spectrométrie de masse (isotopes de l'oxygène et de l'hydrogène en particulier), torche à plasma (analyse des traces), analyseurs de carbone (carbone organique/carbone inorganique), électrodes pour le pH et différents ions.
Classification hydrochimique des éléments et paramètres utilisés
Éléments
Paramètres physico-chimiques
pH, eH (potentiel redox), température, conductivité électrique, turbidité
Hydrochimie et cycle de l'eau
Eaux de pluie
La composition chimique de l'eau de pluie est d'abord influencée par la composition de la source de vapeur d'eau - l'eau de pluie peut par exemple avoir des similitudes remarquables avec l'eau des océans. Par la suite durant le transport de cette vapeur puis sa condensation sous forme de pluie, l'eau d'habitude s'appauvrit en certains éléments à mesure de l'éloignement de sa source, ou inversement s'enrichit au contact des poussières et pollutions atmosphériques.
Le système carbonate
Les ions carbonates et les minéraux carbonatés dans l'eau participent au pouvoir tampon de l'eau.
Le CO2 (dioxyde de carbone) est un gaz représentant environ 0,03 à 0,04 % de l'air sec. La dissolution du CO2 au contact air-eau est une réaction rapide. La quantité de CO2 dissous dépend surtout de la température et de la pression du CO2 dans l'air (habituellement entre 0,03 et 0,04 %) qui augmente rapidement dans les sols (pour atteindre environ 1 % de l'air du sol) du fait de la respiration organique. On parle aussi d'eau en équilibre avec l'air et d'eau en équilibre avec le sol. Dans certains cas, l'eau peut être en équilibre avec d'autres sources de CO2 importantes, comme des eaux carbo-gazeuses thermales, les marais et les tourbes.
L'équilibre de dissolution et dégazage du CO2 s'écrit :
- (1) CO2 gazeux ⇌ CO2 dissous
La réaction du CO2 dissous et de l'eau liquide conduit à la formation du CO2 aqueux (H2CO3) suivant l'équilibre :
- (2) CO2 dissous + H2O ⇌ H2CO3
Dans des conditions normales de température et de pression, l'équilibre (2) conduit à l'équation :
- (3) H2CO3 = p(CO2 gazeux) × 10-1,46
Le CO2 aqueux se dissocie suivant les équilibres entre les différentes espèces ioniques HCO3- et CO32- et l'eau :
- (4) H2CO3 + H2O ⇌ HCO31− + H+
- (5) HCO31− + H2O ⇌ CO32− + H+
On voit ainsi comment le CO2 gazeux, par dissolution dans l'eau puis par réaction avec les molécules d'eau peut former l'anion HCO3- également appelé bicarbonate ou encore hydrogénocarbonate. Dans une eau naturelle, les couples H+ et carbonates sont souvent les seuls apportant un peu d'acidité permettant la dissolution des minéraux carbonatés (Calcite, Magnésite, Dolomite, etc.). Un des phénomènes les plus concrets de cette dissolution est la formation de karst dans les massifs calcaires. Inversement lorsque la pression en CO2 diminue, du fait par exemple de l'émergence de l'eau à l'air libre, la diminution de la concentration en bicarbonate induit la précipitation des carbonates - c'est le phénomène à l'origine de la construction d'une tufière.
Modèles hydrochimiques
Plusieurs modèles sont utilisés par les hydrochimistes, pour résoudre des systèmes d'équilibre complexes et calibrer des données expérimentales et éprouver des scénarios. Souvent un modèle nécessite une base de données recensant les constantes d'équilibres des phases minérales d'une eau. Une référence dans la matière est la suite Phreeq, mais de nombreux autres modèles existent (CHEAQS, ChemEQL, CHESS, FITEQL, MEDUSA, MINEQL, MITEQ, StabCal).
Classification des eaux
On peut tout de suite distinguer les eaux chaudes des eaux froides, mais surtout on peut distinguer selon la chimie d'une eau son faciès hydrochimique. Pour arriver à une telle distinction de nombreuses voies nous sont offertes. La plus simple est probablement d'utiliser un simple diagramme hydrochimique. Il existe également des méthodes plus "numériques" s'accordant bien par exemple avec l'emploi de bases de données et de formules mathématiques.
Dans tous les cas le but d'une classification est de faire ressortir les concentrations principales de l'eau, dont on peut par exemple déduire l'origine "géologique" de l'eau. Comme toutes classifications ces dernières peuvent s'avérer péjorativement simplificatrices.
Représentation des analyses hydrochimiques
Des diagrammes particuliers ont été développés pour représenter les résultats d'analyses hydrochimiques et en tirer des renseignements particuliers. L'emploi de ces diagrammes s'avère précieux, car il rend simple et directe l'interprétation d'analyses riches et difficiles à interpréter de but en blanc. Ces diagrammes toutefois n'emploient pas tous les éléments analyses, nécessitent que certains éléments le soient absolument, et sont parfois utilisés pour un objectif spécifique (reconnaître le faciès d'une eau souterraine ou repérer des processus de salinisation par exemple).
 Diagramme de Schoeller
Diagramme de Schoeller Diagramme de Stiff
Diagramme de Stiff Diagramme de Collins
Diagramme de Collins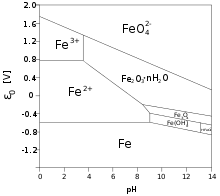 Diagramme de Pourbaix
Diagramme de Pourbaix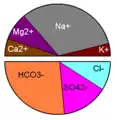 Diagramme circulaire
Diagramme circulaire
Diagramme de Piper
Le diagramme de Piper utilise les éléments majeurs pour représenter les différents faciès des eaux souterraines. Il permet également de voir l'évolution d'une eau, passant d'un faciès à un autre, grâce à des analyses espacées dans le temps ou des analyses d'échantillons pris à des endroits différents. Le diagramme de Piper est très utile pour représenter toutes autres sortes de groupes d'analyses.
Le diagramme de Piper est composé de deux triangles et un losange. Les deux triangles (un triangle portant les cations et un autre les anions) sont d'abord remplis puis le losange. Les valeurs utilisées sont exprimées en %.meq.L-1.
Diagramme de Durov
Le diagramme de Durov est fondé sur les mêmes deux triangles que le diagramme de Piper et utilise également des valeurs en %.meq.L-1. Ce diagramme remplace le losange du Piper par un carré.
Diagramme de Stiff
Le diagramme de Stiff permet de lire et de reconnaitre en un instant, les anions et cations majeurs dans une eaux.
Diagramme de Schoeller ou Berkaloff
Le diagramme de Schoeller[2] permet entre autres de reconnaître simplement le faciès d'une eau souterraine, en utilisant les concentrations des éléments majeurs et en les reportant sur un graphique en colonnes à échelles logarithmiques.
Diagramme de Collins ou Stabler
Le diagramme de Collins est utilisé pour déterminer rapidement les différents titres d'une eau (titre d'alcalimétrie, titre en sels d'acides forts et titre d'hydrotimétrie). Pour cela les concentrations en meq.L-1 des anions et des cations sont reportés sur deux barres ou colonnes distinctes de même longueur - les concentrations étant reportées en %. La détermination des différents titres est alors visuelle.
Diagramme de Richards ou Riverside ou Wilcox
Ce diagramme est essentiellement utilisé pour évaluer le risque de salinisation des sols. Il utilise pour cela la conductivité électrique (CE) ou la charge totale dissoute, toutes deux relatives à la salinité de l'eau, et l'indice d'adsorption du sodium (SAR en anglais) aussi appelé "pouvoir alcalisant" qui est une mesure du risque de la sodisation du sol du fait de l'irrigation. Le diagramme est découpé en quatre classes de salinité (axe des abscisses) et quatre classes de risques de sodisation (axe des ordonnées)
Diagramme circulaire (camembert)
Le diagramme circulaire représente comme le diagramme de Collins les valeurs en %.meq.L-1 des éléments majeurs. Les cations sont habituellement positionnés dans l'hémisphère nord et les anions dans l'hémisphère sud du camembert, et le diamètre du graphique peut être fonction de la valeur d'un autre paramètre comme la salinité.
Diagramme de Giggenbach
Ce diagramme triangulaire[3] est utilisé pour déterminer la température des réservoirs géothermie. Il utilise pour cela les thermomètres chimiques K/Mg et Na/K.
Diagramme de Pourbaix
Un article particulier détaille ce diagramme. En reportant les paramètres de l'échantillon sur le diagramme, on se rend compte des équilibres minéraux en jeu.
Voir aussi
- Loi sur l'eau
- normes physico-chimiques pour les ressources en eau potable.
Liens externes
En anglais
Intro isotope hydrology; Literature on isotope hydrology; Introduction to isotopes; Radioactivity; Overview of isotopes/tracers in hydrology University of Washington - Chemical Oceanography University of Utrecht - geochemistry courses
Modèles hydrochimiques
Représentation des données
Notes et références
- Stumm, Morgan, 1981, Aquatic Chemistry 2d Edition, John Wiley & Sons Ed.
- Schoeller H. (1962) Les eaux souterraines, Masson, Paris.
- Chandrasekharam D, Bundschuh J, Geothermal Energy Resources for Developing Countries, 2002, Swets & Zeitlinger ed.