Dicyclohexylcarbodiimide
Le N,N'-dicyclohexylcarbodiimide ou DCC est un composé organique de la famille des carbodiimides principalement utilisé comme réactif pour le couplage des acides aminés en synthèse peptidique.
| Dicyclohexylcarbodiimide | |||
  |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | N,N'-dicyclohexylméthanediimine | ||
| Synonymes |
N,N'-dicyclohexylcarbodiimide |
||
| No CAS | |||
| No ECHA | 100.007.914 | ||
| No CE | 208-704-1 | ||
| No RTECS | FF2160000 | ||
| PubChem | 10868 | ||
| ChEBI | 53090 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide incolore d'odeur caractéristique[1] | ||
| Propriétés chimiques | |||
| Formule | C13H22N2 [Isomères] |
||
| Masse molaire[2] | 206,327 2 ± 0,012 3 g/mol C 75,68 %, H 10,75 %, N 13,58 %, |
||
| Propriétés physiques | |||
| T° fusion | 34 à 35 °C[3] 34,5 à 37,0 °C[3] 35 à 36 °C[1] |
||
| T° ébullition | 122 à 124 °C[1] 122 à 124 °C à 6 mmHg[3] |
||
| Solubilité | pratiquement insoluble dans l'eau[1] CH2Cl2 0,1 g·ml-1[3] |
||
| Masse volumique | 0,95 g·cm-3 à 40 °C[1] | ||
| Point d’éclair | 113 °C[1] - [3] | ||
| Précautions | |||
| SGH[1] - [3] | |||
  |
|||
| NFPA 704 | |||
| Transport[1] - [3] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 400 mg/kg (rat, oral)[1] | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse
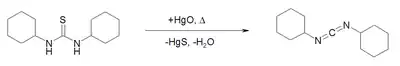
De nombreuses voies de synthèse ont été élaborées, les plus récentes via une réaction de couplage offrent de meilleurs rendements. Historiquement, le DCC fut formé par déshydratation de la dicyclohexyl-urée par le chlorure de paratoluènesulfonyle en présence de triphénylphosphine et triéthylamine comme bases[4]. De la même façon, la dicyclohexyl-thiourée réagit avec l'oxyde de mercure en formant un intermédiaire où l'atome de soufre est échangé par l'oxygène. Sa déshydratation forme alors le DCC[5] :
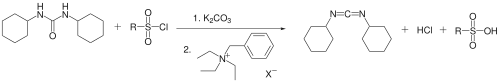
En 1987, l'utilisation de carbonate de potassium en lieu et place des triphénylphosphine et triéthylamine comme base et d'un catalyseur de transfert de phase par le groupe de Zsuzsa Jaszay leur permet d'obtenir un rendement de 50 %. La dicyclohexylurée, un chlorure d'arènesulfonyle et du carbonate de potassium réagissent dans le toluène en présence de chlorure de benzyle triéthylammonium pour donner du N,N'-dicyclohexylcarbodiimide[6] :
Ilan Pri-Bara et Jeffrey Schwartz utilisent de l'acétate de palladium, de l'iode et de l'oxygène pour coupler la cyclohexylamine et l'isocyanure de cyclohexyle[7]. Des rendements jusqu'à 67 % ont été obtenus en suivant cette voie :
- C6H11NH2 + C6H11N≡C + O2 → (C6H11N)2C + H2O.
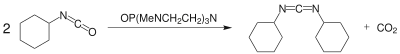
L'équipe de Jiansheng Tang condensent deux isocyanates en utilisant le catalyseur OP(MeNCH2CH2)3N avec un rendement de 92 %[8] :
Propriétés et caractérisation
Le DCC est une poudre incolore avec une odeur caractéristique lourde et sucrée. Le point de fusion peu élevé de ce composé lui permet d'être fondu pour une manipulation plus aisée. Il est très soluble dans le dichlorométhane, le tétrahydrofurane, l'acétonitrile et le diméthylformamide, mais insoluble dans l'eau.
Le cœur N=C=N des carbodiimides est linéaire et est structurellement relié aux allènes (C=C=C). Trois structures de résonance principales décrivent les carbodiimides :
- RN=C=NR ↔ RN+≡C-N−R ↔ RN−-C≡N+R.
Ce motif N=C=N a une signature caractéristique en spectroscopique IR à 2117 cm−1[8]. Le spectre RMN du 15N montre un déplacement chimique caractéristique de 275,0 ppm vers les champs forts par rapport à l'acide nitrique et le spectre RMN 13C comporte un pic à environ 139 ppm en aval du TMS[9].
Usage
Le DCC est un réactif qui peut être utilisé pour des déshydratations, des estérifications et d'autres activations dans des conditions très douces.
Déshydratation
Le DCC est un agent de déshydratation pour la préparation d'alcènes, de nitriles. Dans ces réactions, le DCC s'hydrate pour former la dicyclohexyl-urée (DCU) qui est insoluble dans l'eau.
Ainsi, la déshydratation des alcools procède en donnant d'abord l'intermédiaire O-acyl urée qui est ensuite coupé par hydrogénolyse pour produire l'alcène correspondant :
- RCHOHCH2R' + (C6H11N)2C → RCH=CHR' + (C6H11NH)2CO.
Oxydation de Moffatt
Une solution de DCC dans le diméthylsulfoxyde (DMSO) permet d'effectuer ce qui est appelé une oxydation de Pfitzner-Moffatt. Cette réaction est utilisée pour l'oxydation des alcools en aldéhydes et cétones. Contrairement aux oxydations via des ions métalliques, les conditions avec DCC sont suffisamment douces pour éviter la sur-oxydation des aldéhydes en acides carboxyliques. En général, trois équivalents de DCC pour 0,5 équivalent d'alcool dans le DMSO sont laissés une nuit à température ambiante. La réaction est arrêtée par acidification.
Estérification et amidation
DCC est principalement utilisé dans la synthèse d'esters et d'amides organiques, en particulier quand les composés à réagir sont encombrés ou peu réactifs, il permet un accroissement important des rendements[10]. En outre, il effectue, et contrairement à l'estérification de Fischer, ces estérifications et amidations dans des conditions très douces ce qui est très intéressant avec les composés peu nucléophiles comme l'alcool ter-butylique.
Par conséquent, DCC joue également un rôle important dans la synthèse de peptides in vitro et dans l'introduction de groupes protecteurs.
Inversion d'alcools secondaires
Les alcools secondaires peuvent être inversés stéréochimiquement par formation d'un ester de formyle, suivie d'une saponification. L'alcool secondaire est mélangé directement avec du DCC, de l'acide formique et une base forte telle que le méthylate de sodium.
Estérification de Steglich
Une large gamme d'alcools, y compris même certains alcools tertiaires, peuvent être estérifiés avec un acide carboxylique en présence de DCC et une quantité catalytique de 4-diméthylaminopyridine, DMAP[11] - [12].
En fait, tout groupe carboxyle (>C=O) s'ajoute rapidement sur une des doubles liaisons C=N du DCC, formant le dérivé O-acyl urée correspondant. Cet intermédiaire est très réactif, sa réactivité étant comparable à celle d'un anhydride d'acide[13], de sorte qu'il est rapidement et facilement converti en amide par réaction sur une amine. Pour son couplage avec des alcools, un agent d'acyl-transfert comme DMAP est en outre nécessaire. C'est ce qui est appelé une estérification de Steglich[14]. En somme, le résultat de ces condensations de l'acide lié au DCC avec un alcool ou une amine est un ester ou un amide respectivement, et une molécule d'eau captée par le DCC qui se transforme en N,N'-dicyclohexyl urée, (C6H11-NH)2C=O.
Couplage peptidique promu par DCC
Au cours d'une synthèse de peptide ou de protéine (par exemple par Fmoc solid-state synthesizer), l'extrémité N-terminale est souvent utilisée comme le site de fixation sur lequel les acides aminés sont ajoutés. Pour améliorer l'électrophilie du groupe carboxylate de l'acide aminé déprotoné à ajouter, l'atome d'oxygène chargé négativement doit d'abord être activé en un meilleur groupe partant. Le DCC est utilisé à cet effet. L'atome d'oxygène chargé négativement qui est donc nucléophile, attaque facilement l'atome de carbone central du DCC qui est donc temporairement attaché au groupe carboxylate et forme un intermédiaire hautement électrophile, ce qui rend l'attaque nucléophile par le groupe amino terminal du peptide en construction bien plus efficace.
Sécurité
En plus d'être toxique, le dicyclohexylcarbodiimide est aussi un allergène puissant et à effet de sensibilisation, causant souvent des éruptions cutanées.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « N,N'-Dicyclohexylcarbodiimide » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Dicyclohexylcarbodiimid » (voir la liste des auteurs).
- (en) « Dicyclohexylcarbodiimide », sur ChemIDplus
- Entrée « Dicyclohexylcarbodiimid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- N,N′-Dicyclohexylcarbodiimide ≥99.0% (GC) chez Sigma-Aldrich.
- (de)R. Appel, R. Kleinstück, K.-D. Ziehn, Über die gemeinsame Einwirkung von Phosphinen und Tetrachlorkohlenstoff auf Ammoniak (Derivate), IV Notiz über eine neue Carbodiimid-Synthese, Chem. Ber., 1971, vol. 104, p. 1335-1336. DOI 10.1002/cber.19711040438.
- (de) S. Hauptmann, J. Graefe, H. Remane, Lehrbuch der organischen Chemie', Deutscher Verlag für Grundstoffindustrie, Leipzig, 1976, p. 433.
- Zsuzsa Jaszay, Imre Petnehazy, Laszlo Toke, Bela Szajani, Preparation of Carbodiimides Using Phase-Transfer Catalysis, Synthesis, 1987, vol. 5(5), p. 520–523. DOI 10.1055/s-1987-27992.
- Ilan Pri-Bara, Jeffrey Schwartz, N,N-Dialkylcarbodiimide synthesis by palladium-catalysed coupling of amines with isonitriles, Chem. Commun., 1997, vol. 4(4), p. 347. DOI 10.1039/a606012i.
- Jiansheng Tang, Thyagarajan Mohan, John G. Verkade, Selective and Efficient Syntheses of Perhydro-1,3,5-triazine-2,4,6-triones and Carbodiimides from Isocyanates Using ZP(MeNCH2CH2)sN Catalysts. J. Org. Chem., 1994, vol. 59(17), p. 4931-4938. DOI 10.1021/jo00096a041.
- Issa Yavari, John D. Roberts, Nitrogen-15 Nuclear Magnetic Resonance Spectroscopy. Carbodiimides. J. Org. Chem., 1978, vol. 43(25), p. 4689–4690. DOI 10.1021/jo00419a001.
- H. Wiener, C. Gilon, An improved method for the catalytic preparation of t-butyl esters of carboxylic and fatty acid, J. Mol. Catal., 1986, vol. 37, p. 45-52. DOI 10.1016/0304-5102(86)85136-7.
- B. Neises, W. Steglich, Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: Tert-Butyl Ethyl Fumarate, Org. Synth., coll. « vol. 7 », , p. 93
- B. Neises, W. Steglich, Simple Method for the Esterification of Carboxylic Acids, Angew. Chem. Int. Ed., 1978, vol. 17, p. 522–524.DOI 10.1002/anie.197805221.
- R. Milcent et F. Chau, Chimie organique hétérocyclique : Structures fondamentales, chimie et biochimie des principaux composés naturels, EDP Sciences, 2003. (ISBN 9782868835833), présentation en ligne
- E. F. V. Scriven, 4-Dialkylaminopyridines: Super Acylation and Alkylation Catalysts, Chem. Soc. Rev., 1983, vol. 12, p. 129-161.