Triéthylamine
La triéthylamine (TEA) ou N,N-diéthyléthanamine est un composé chimique de formule brute N(CH2CH3)3, couramment noté Et3N ou NEt3. Au laboratoire, on l'appelle souvent "trièth" ([tʁiɛt]) mais cela reste réservé à un usage trivial et oral du nom. On la rencontre fréquemment en synthèse organique et ce parce qu'elle constitue l'amine tertiaire symétrique la plus simple liquide à température ambiante. Elle présente une forte odeur de poisson proche de celle de l'ammoniac. La triéthylamine est basique mais aussi très nucléophile. Lorsque la nucléophilie est un problème, on utilise souvent la diisopropyléthylamine (DIPEA) qui est beaucoup plus encombrée et donc moins nucléophile.
| Triéthylamine | |||
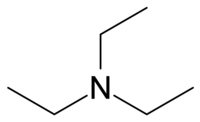
| |||
 | |||
| Structure de la triéthylamine | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | N,N-diéthyléthanamine | ||
| No CAS | |||
| No ECHA | 100.004.064 | ||
| No CE | 204-469-4 | ||
| FEMA | 4246 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide incolore, d'odeur caractéristique[1]. | ||
| Propriétés chimiques | |||
| Formule | C6H15N [Isomères] |
||
| Masse molaire[2] | 101,19 ± 0,006 1 g/mol C 71,22 %, H 14,94 %, N 13,84 %, |
||
| pKa | 10,78[3] | ||
| Moment dipolaire | 0,66 ± 0,05 D[4] | ||
| Diamètre moléculaire | 0,608 nm[5] | ||
| Propriétés physiques | |||
| T° fusion | −115 °C[1] | ||
| T° ébullition | 89 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 170 g·l-1[1] | ||
| Paramètre de solubilité δ | 15,1 MPa1/2 (25 °C)[6] | ||
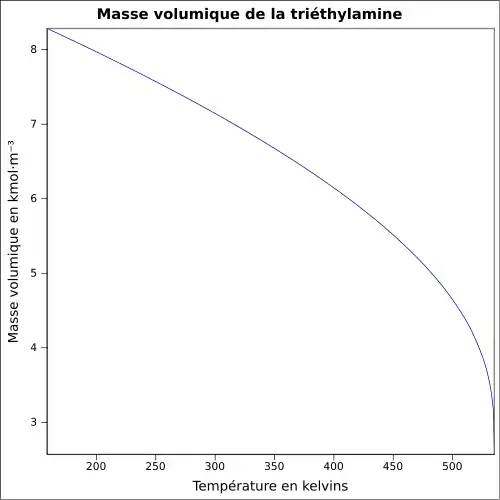
| Masse volumique | 0,749 5 g·cm-3 (0 °C)[7]
|
||
| T° d'auto-inflammation | 230 °C[1] | ||
| Point d’éclair | −17 °C (coupelle fermée)[1] | ||
| Limites d’explosivité dans l’air | 1,2–8 %vol[1] | ||
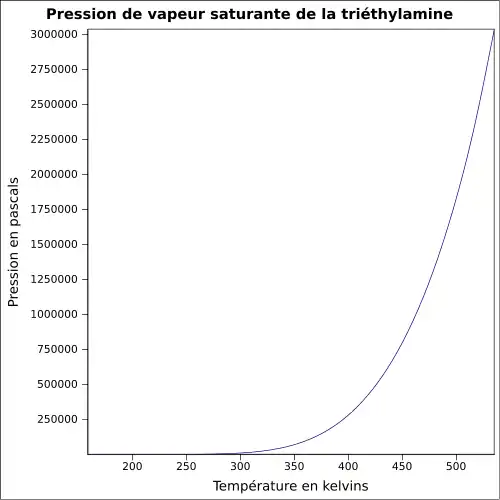
| Pression de vapeur saturante | à 20 °C : 7,2 kPa[1]
|
||
| Point critique | 30,3 bar, 261,85 °C[9] | ||
| Thermochimie | |||
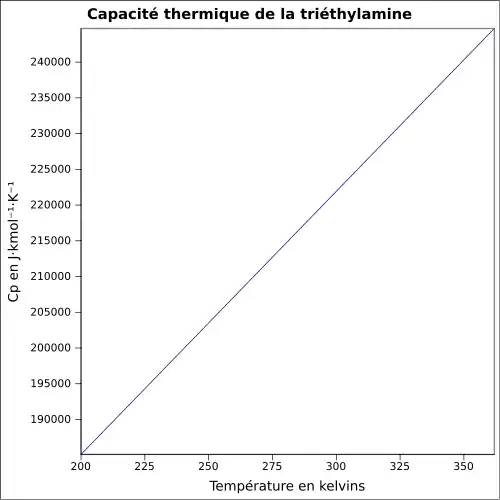
| Cp | |||
| Propriétés optiques | |||
| Indice de réfraction | 1,398[5] | ||
| Précautions | |||
| SGH[11] | |||
   Danger |
|||
| NFPA 704 | |||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 1,45[1] | ||
| Seuil de l’odorat | bas : 0,1 ppm haut : 0,65 ppm[12] |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Elle est communément employée en synthèse organique comme une base, par exemple dans la préparation des esters et amides à partir des chlorures d'acide.
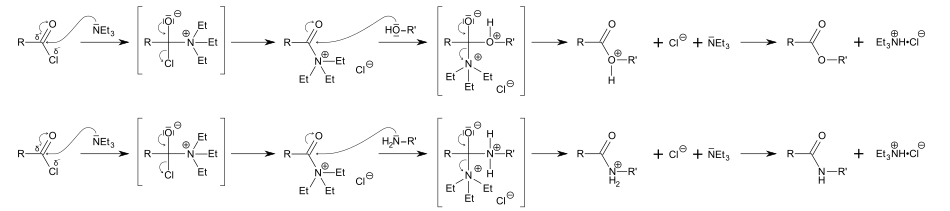
Dans ces réactions, la triéthylamine fait plus que se combiner avec l'acide chlorhydrique généré (formant un sel, le chlorhydrate de triéthylammonium) puisqu'elle intervient aussi comme activateur : étant très nucléophile, elle se combine avec le chlorure d'acide pour former un composé encore plus électrophile que le chlorure d'acide de départ et auquel un alcool ou une amine peuvent facilement s'additionner.
Comme les autres amines tertiaires, Et3N catalyse la formation des mousses polyuréthanes et des résines époxy. Elle est aussi très utile dans les réactions de ß-élimination.
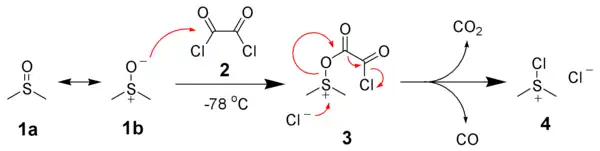
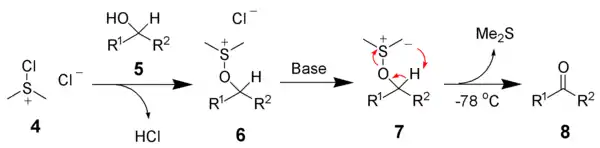
Elle est également utilisée dans les oxydations de Swern :
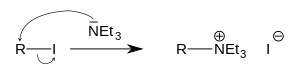
La triéthylamine s'alkyle facilement pour donner l'ammonium quaternaire correspondant :
Séchage de la triéthylamine
Pour obtenir de la triéthylamine anhydre, celle-ci est distillée à pression atmosphérique sur de l'hydroxyde de potassium (KOH) puis stockée sur du tamis moléculaire à 3 ou 4Å. La triéthylamine résultante contient environ 25 ppm d'eau.
Références
- TRIETHYLAMINE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- https://pubchem.ncbi.nlm.nih.gov/compound/triethylamine#section=Dissociation-Constants
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams : Organic Compounds C5 to C7, vol. 2, Huston, Texas, Gulf Pub. Co., , 400 p. (ISBN 0-88415-858-6)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- « Triethylamine », sur hazmap.nlm.nih.gov (consulté le )
Voir aussi
Bibliographie
- INRS (2015) Fiche toxicologique (Ref FT 115), PDF, 8p.