Chlorure de bis(cyclopentadiényl)titane(III)
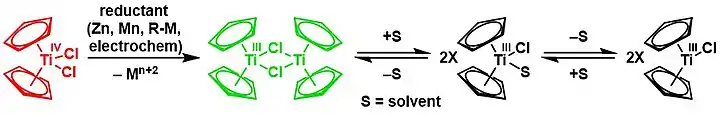
Le chlorure de bis(cyclopentadiényl)titane(III), ou réactif de Nugent-RajanBabu, est un composé organotitane de formule chimique [(η5-C5H5)2Ti(µ-Cl)]2. Il s'agit d'un solide vert qui se dégrade à l'air libre. Ce complexe est utilisé en synthèse organique pour les réductions à un électron. En présence d'un solvant convenable pouvant agir comme donneur à deux électrons, par exemple un éther comme le tétrahydrofurane[2] (THF), le dimère établit un équilibre chimique avec les formes (η5-C5H5)2TiCl et (η5-C5H5)2TiCl(solvant)[3]. Ce sont ces formes particulières qui sont responsables de l'essentiel des propriétés chimiques de ce réactif, raison pour laquelle ce dernier est parfois écrit simplement comme monomère Cp2TiCl.
| Chlorure de bis(cyclopentadiényl)titane(III) | |
| |
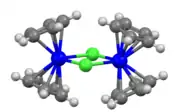
| Structure tridimensionnelle du chlorure de bis(cyclopentadiényl)titane(III) | |
| Identification | |
|---|---|
| No CAS | |
| PubChem | 101376209 (monomère) |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C20H20ClTi |
| Masse molaire[1] | 343,693 ± 0,02 g/mol C 69,89 %, H 5,87 %, Cl 10,32 %, Ti 13,93 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Il a été publié pour la première fois en 1955 en 1955 par Geoffrey Wilkinson[4]. On l'obtient couramment en réduisant du dichlorure de titanocène Cp2TiCl2 par du zinc[5], du manganèse ou du magnésium[6]. En chimie organique, il est généralement préparé in situ pour être utilisé directement[2].
Réactions
Le chlorure de bis(cyclopentadiényl)titane(III) réalise l'ouverture anti-Markovnikov des époxydes pour former un intermédiaire radicalaire en restant tolérant aux alcools et à certains groupes fonctionnels azotés basiques, mais il est sensible aux groupes fonctionnels oxydants tels que les groupes nitro[7]. La suite de la réaction est déterminée par les réactifs ajoutés et les conditions opératoires[8] :
- En présence de donneurs d'atomes d'hydrogène, tels que 1,4-cyclohexadiène[9], tert-butylthiol (en) (CH3)3CSH[10], eau[11], l'intermédiaire est protoné pour donner un alcool. Cette conversion conduit au régioisomère complémentaire de celui d'une ouverture époxyde utilisant un hydrure métallique ; on connaît en particulier l'utilisation d'aluminohydrure de lithium LiAlH4 pour former l'alcool de Markovnikov et en particulier des cyclohexanols axiaux à partir d'époxycyclohexanes (en)[12] - [13].
- La réaction de l'intermédiaire avec un deuxième équivalent de Cp2TiCl piège le radical sous la forme d'une espèce alkyl-titane(IV) qui peut subir soit une élimination de β-hydrures, soit une déshydratation par élimination des β-alcoolates ; dans les deux cas, on obtient un alcène[7] - [8] - [14].
- L'intermédiaire radicalaire peut également être piégé de manière intramoléculaire lorsqu'un fragment accepteur approprié, tel qu'un alcène, un alcyne, un carbonyle, etc., est présent dans l'époxyde. La synthèse de produits naturels avec des systèmes polycycliques a tiré parti de cette approche[14]. Le piégeage intermoléculaire des acrylates et des acrylonitriles avec des radicaux dérivés d'époxydes est possible[15], ainsi que des variantes à liaisons intra-intermoléculaires[16].
- Une autre voie intercepte l'intermédiaire radicalaire avec une catalyse au nickel et facilite le couplage croisé énantiosélectif d'époxydes ouverts avec des électrophiles de type halogénure et pseudohalogénure[17].
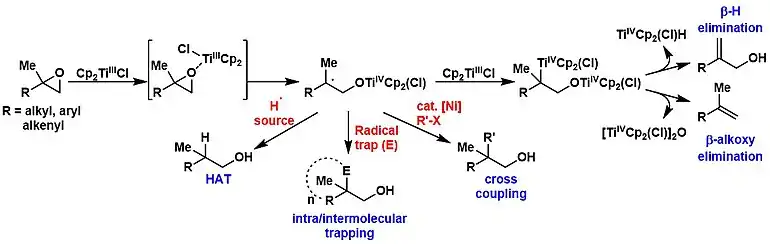
Le monomère Cp2TiCl est une espèce à 15 électrons qui agit comme acide de Lewis et se lie par conséquent aux époxydes et aux composés carbonylés[18]. Le complexe transfère un électron unique au substrat coordonné en générant un radical alkyle avec un atome d'oxygène lié au titane(IV). Cette réaction est favorisée par la force de la liaison oxygène–titane ainsi que par le relâchement de la contrainte du cycle dans le cas des époxydes[19].
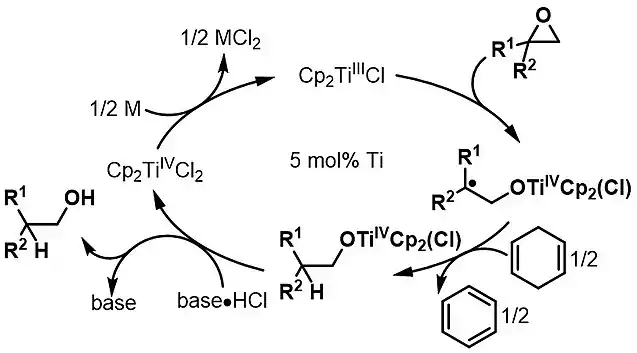 Cycle catalytique du réactif de Nugent-RajanBabu. Un sel faiblement acide de HCl favorise le clivage de la liaison TiIV–O et permet la régénération de Cp2TiIIICl à l'aide d'un réducteur stœchiométrique.
Cycle catalytique du réactif de Nugent-RajanBabu. Un sel faiblement acide de HCl favorise le clivage de la liaison TiIV–O et permet la régénération de Cp2TiIIICl à l'aide d'un réducteur stœchiométrique.
Applications
Ce réactif a permis la synthèse de plus d'une vingtaine de produits naturels[7] - [14] - [20]. Le cératopicanol est un sesquiterpène naturel dont le squelette carboné est incorporé à la structure de l'anislactone A et de la merrilactone A (en)[8] - [14]. Le noyau cératopicanol est obtenu par ouverture régiosélective de l'époxyde et cyclisation radicalaire 5-exo[14] - [21]. L'ajout d'un sel de chlorhydrate à la réaction facilite la libération de l'intermédiaire de titane(IV) lié à l'oxygène, ce qui permet de recycler le réactif[22].
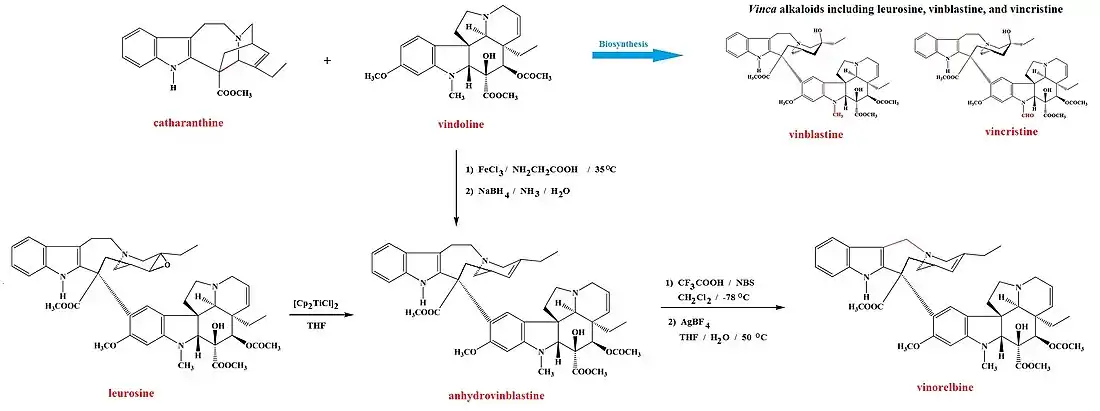
La pervenche de Madagascar Catharanthus roseus L. est la source d'un certain nombre de produits naturels importants, dont la catharanthine (en), la vindoline[23] et les vinca-alcaloïdes produits à partir de celles-ci : la leurosine, ainsi que la vinblastine et la vincristine, utilisées en chimiothérapie, qui peuvent tous être obtenus à partir de la plante[8] - [24] - [25] - [26]. La vinorelbine est ainsi obtenue par hémisynthèse pour traiter le cancer bronchique non à petites cellules[25] - [27] et n'a pas été observée dans le milieu naturel. Il est cependant possible de la préparer soit à partir de vindoline et de catharanthine[25] - [28] soit à partir de leurosine[29], en passant dans les deux cas par l'anhydrovinblastine[25]. La méthode par la leurosine utilise le réactif de Nugent-RajanBabu pour réaliser une désoxygénation de la leurosine hautement chimiosélective[14] - [29]. L'anhydrovinblastine est ensuite mise à réagir séquentiellement avec du N-bromosuccinimide et de l'acide trifluoroacétique CF3COOH suivi de tétrafluoroborate d'argent AgBF4 pour donner la vinorelbine[28].
Par ailleurs, les cétones cycliques et benzyliques sont réduites en leur alcool respectif[30].
Le chlorure de bis(cyclopentadiényl)titane(III) agit également sur le couplage pinacolique[31] - [32] et la réaction de McMurry[33] des aldéhydes et des cétones. Une réaction de Barbier est observée entre les aldéhydes ou les cétones et les électrophiles allyliques dans des conditions catalytiques[34]. Le mécanisme proposé implique la génération médiée par le titane(III) d'un radical allylique qui intercepte un carbonyle coordonné au titane(III). Une autre application implique la réduction monoélectronique d'énones pour générer des radicaux allyliques qui peuvent subir un piégeage intermoléculaire avec des acrylonitriles pour donner des adduits de Michael[35]. Les alcools benzyliques et allyliques peuvent être désoxygénés dans des conditions douces à l'aide de Cp2TiCl en excès stœchiométrique, mais l'application de ces réactions pour les alcools aliphatiques reste limitée[33].
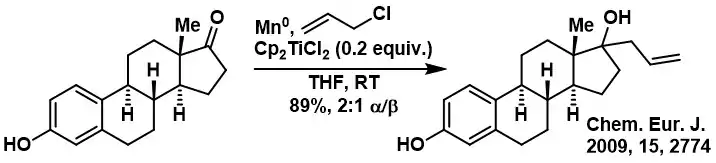 Exemple de réaction de Barbier catalysée par Cp2TiCl.
Exemple de réaction de Barbier catalysée par Cp2TiCl.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) William A. Nugent et T. V. RajanBabu, « Transition-metal-centered radicals in organic synthesis. Titanium(III)-induced cyclization of epoxy olefins », Journal of the American Chemical Society, vol. 110, no 25, , p. 8561-8562 (DOI 10.1021/ja00233a051, lire en ligne)
- (en) Rudolph Jungst, Dennis Sekutowski, Jimmy Davis, Matthew Luly et Stucky, « Structural and magnetic properties of di-µ-chloro-bis[bis(η5-cyclopentadienyl)titanium(III)] and di-µ-bromo-bis[bis(η5-methylcyclopentadienyl)titanium(III)] », Inorganic Chemistry, vol. 16, no 7, , p. 1645-1655 (DOI 10.1021/ic50173a015, lire en ligne)
- (en) J. M. Birmingham, A. K. Fischer et G. Wilkinson, « The reduction of bis-cyclopentadienyl compounds », Naturwissenschaften, vol. 42, no 4, , p. 96 (DOI 10.1007/BF00617242, Bibcode 1955NW.....42Q..96B, S2CID 44523847, lire en ligne)
- (en) L. E. Manzer, E. A. Mintz et T. J. Marks, « 18. Cyclopentadienyl Complexes of Titanium(III) and Vanadium(III) », Inorganic Syntheses, vol. 21, (DOI 10.1002/9780470132524.ch18, lire en ligne)
- (en) Yuichi Handa et Junji Inanaga, « A highly stereoselective pinacolization of aromatic and α, β-unsaturated aldehydes.dta mediated by titanium(III)-magnesium(II) complex », Tetrahedron Letters, vol. 28, no 46, , p. 5717-5718 (DOI 10.1016/S0040-4039(00)96822-9, lire en ligne)
- (en) William A. Nugent, « Bis(cyclopentadienyl)titanium(III) Chloride », Encyclopedia of Reagents for Organic Synthesis, (DOI 10.1002/047084289X.rn00294, lire en ligne)
- (en) Andreas Gansäuer, José Justicia, Chun-An Fan, Dennis Worgull et Frederik Piestert, « Reductive C–C Bond Formation after Epoxide Opening via Electron Transfer », Metal Catalyzed Reductive C–C Bond Formation, (DOI 10.1007/128_2007_130, lire en ligne)
- (en) T. V. RajanBabu, William A. Nugent et Margaret S. Beattie, « Free radical-mediated reduction and deoxygenation of epoxides », Journal of the American Chemical Society, vol. 112, no 17, , p. 6408-6409 (DOI 10.1021/ja00173a045, lire en ligne)
- (en) T. V. RajanBabu et William A. Nugent, « Selective Generation of Free Radicals from Epoxides Using a Transition-Metal Radical. A Powerful New Tool for Organic Synthesis », Journal of the American Chemical Society, vol. 116, no 3, , p. 986-997 (DOI 10.1021/ja00082a021, lire en ligne)
- (en) Alejandro F. Barrero, J. Enrique Oltra, Juan M. Cuerva et Antonio Rosales, « Effects of Solvents and Water in Ti(III)-Mediated Radical Cyclizations of Epoxygermacrolides. Straightforward Synthesis and Absolute Stereochemistry of (+)-3α-Hydroxyreynosin and Related Eudesmanolides », The Journal of Organic Chemistry, vol. 67, no 8, , p. 2566-2571 (PMID 11950302, DOI 10.1021/jo016277e, lire en ligne)
- (en) Bruce Rickborn et Joe Quartucci, « Stereochemistry and Mechanism of Lithium Aluminum Hydride and Mixed Hydride Reduction of 4-t-Butylcyclohexene Oxide », The Journal of Organic Chemistry, vol. 29, no 11, , p. 3185-3188 (DOI 10.1021/jo01034a015, lire en ligne)
- (en) Bruce Rickborn et Wallace E. Lamke II, « Reduction of epoxides. II. The lithium aluminum hydride and mixed hydride reduction of 3-methylcyclohexene oxide », The Journal of Organic Chemistry, vol. 32, no 3, , p. 537-539 (DOI 10.1021/jo01278a005, lire en ligne)
-
(en) Sara P. Morcillo, Delia Miguel, Araceli G. Campaña, Luis Álvarez de Cienfuegos, José Justicia et Juan M. Cuerva, « Recent applications of Cp2TiCl in natural product synthesis », Organic Chemistry Frontiers, vol. 1, no 1, , p. 15-33 (DOI 10.1039/C3QO00024A, lire en ligne
 )
) - (en) T. V. RajanBabu et William A. Nugent, « Intermolecular addition of epoxides to activated olefins: a new reaction », Journal of the American Chemical Society, vol. 111, no 12, , p. 4525-4527 (DOI 10.1021/ja00194a073, lire en ligne)
- (en) Andreas Gansäuer, Marianna Pierobon et Harald Bluhm, « Stereoselective Synthesis of Tri- and Tetrasubstituted Olefins by Tandem Cyclization Addition Reactions Featuring Vinyl Radicals », Angewandte Chemie International Edition, vol. 41, no 17, , p. 3206-3208 (PMID 12207390, DOI 10.1002/1521-3773(20020902)41:17<3206::AID-ANIE3206>3.0.CO;2-2, lire en ligne)
- (en) Yang Zhao et Daniel J. Weix, « Enantioselective Cross-Coupling of meso-Epoxides with Aryl Halides », Journal of the American Chemical Society, vol. 137, no 9, , p. 3237-3240 (PMID 25716775, PMCID 4415026, DOI 10.1021/jacs.5b01909, lire en ligne)
- (en) Asli Cangönül, Maike Behlendorf, Andreas Gansäuer et Maurice van Gastel, « Radical-Based Epoxide Opening by Titanocenes », Inorganic Chemistry, vol. 52, no 20, , p. 11859-11866 (PMID 24112112, DOI 10.1021/ic401403a, lire en ligne)
- (en) Andreas Gansäuer, Andriy Barchuk, Florian Keller, Martin Schmitt, Stefan Grimme, Mareike Gerenkamp, Christian Mück-Lichtenfeld, Kim Daasbjerg et Heidi Svith, « Mechanism of Titanocene-Mediated Epoxide Opening through Homolytic Substitution », Journal of the American Chemical Society, vol. 129, no 5, , p. 1359-1371 (PMID 17263420, DOI 10.1021/ja067054e, lire en ligne)
- (en) Antonio Rosales, Ignacio Rodríguez-García, Juan Muñoz-Bascón, Esther Roldan-Molina, Natalia M. Padial, Laura Pozo Morales, Marta García-Ocaña et J. Enrique Oltra, « The Nugent–RajanBabu Reagent: A Formidable Tool in Contemporary Radical and Organometallic Chemistry », European Journal of Organic Chemistry, vol. 2015, no 21, , p. 4592-4592 (DOI 10.1002/ejoc.201500761, lire en ligne)
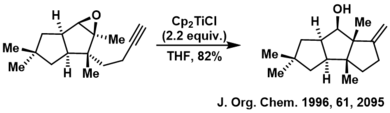
- (en) D. L. J. Clive, Steven R. Magnuson, Hartford W. Manning et Darrin L. Mayhew, « Cyclopentannulation by an Iterative Process of Sequential Claisen Rearrangement and Enyne Radical Closure: Routes to Triquinane and Propellane Systems and Use in the Synthesis of (±)-Ceratopicanol », The Journal of Organic Chemistry, vol. 61, no 6, , p. 2095-2108 (DOI 10.1021/jo951930h, lire en ligne)
- (en) Andreas Gansäuer, Marianna Pierobon et Harald Bluhm, « Catalytic, Highly Regio- and Chemoselective Generation of Radicals from Epoxides: Titanocene Dichloride as an Electron Transfer Catalyst in Transition Metal Catalyzed Radical Reactions », Angewandte Chemie International Edition, vol. 37, nos 1-2, , p. 101-103 (DOI 10.1002/(SICI)1521-3773(19980202)37:1/2<101::AID-ANIE101>3.0.CO;2-W, lire en ligne)
- (en) K. Hirata, K. Miyamoto et Y. Miura, « Catharanthus roseus L. (Periwinkle): Production of Vindoline and Catharanthine in Multiple Shoot Cultures. Medicinal and Aromatic Plants VI », Biotechnology in Agriculture and Forestry, vol. 26, , p. 46-55 (DOI 10.1007/978-3-642-57970-7_3, lire en ligne)
- (en) Raymond Cooper et Jeffrey John Deakin, « Africa's gift to the world », Botanical Miracles: Chemistry of Plants That Changed the World, CRC Press, 2016, p. 46–51. (ISBN 978-1498704304)
-
(en) Péter Keglevich, László Hazai, György Kalaus et Csaba Szántay, « Modifications on the Basic Skeletons of Vinblastine and Vincristine », Molecules, vol. 17, no 5, , p. 5893-5914 (PMID 22609781, PMCID 6268133, DOI 10.3390/molecules17055893, lire en ligne
 )
) - (en) Enrique Raviña, « Vinca alkaloids », The evolution of drug discovery: From traditional medicines to modern drugs, John Wiley & Sons, 2011, p. 157–159. (ISBN 978-3527326693)
- (en) Bryan A. Faller et Trailokya N. Pandit, « Safety and Efficacy of Vinorelbine in the Treatment of Non-Small Cell Lung Cancer », Clinical Medicine Insights: Oncology, vol. 5, , p. 131-144 (PMID 21695100, PMCID 3117629, DOI 10.4137/CMO.S5074, lire en ligne)
- (en) Quoc Anh Ngo, Fanny Roussi, Anthony Cormier, Sylviane Thoret, Marcel Knossow, Daniel Guénard et Françoise Guéritte, « Synthesis and Biological Evaluation of Vinca Alkaloids and Phomopsin Hybrids », Journal of Medicinal Chemistry, vol. 52, no 1, , p. 134-142 (PMID 19072542, DOI 10.1021/jm801064y, lire en ligne)
- (en) Christophe Hardouin, Eric Doris, Bernard Rousseau et Charles Mioskowski, « Concise Synthesis of Anhydrovinblastine from Leurosine », Organic Letters, vol. 4, no 7, , p. 1151-1153 (PMID 11922805, DOI 10.1021/ol025560c, lire en ligne)
- (en) Alejandro F. Barrero, Antonio Rosales, Juan M. Cuerva, Andreas Gansäuer et J. Enrique Oltra, « Titanocene-catalysed, selective reduction of ketones in aqueous media. A safe, mild, inexpensive procedure for the synthesis of secondary alcohols via radical chemistry », Tetrahedron Letters, vol. 44, no 5, , p. 1079-1082 (DOI 10.1016/S0040-4039(02)02703-X, lire en ligne)
- (en) Andreas Gansäuer, « Pinacol coupling of aromatic aldehydes catalysed by a titanocene complex: a transition metal catalysed radical reaction », Chemical Communications, vol. 1997, no 5, , p. 457-458 (DOI 10.1039/a608438i, lire en ligne)
- (en) Miguel Paradas, Araceli G. Campaña, Rosa E. Estévez, Luis Álvarez de Cienfuegos, Tania Jiménez, Rafael Robles, Juan M. Cuerva et J. Enrique Oltra, « Unexpected TiIII/Mn-Promoted Pinacol Coupling of Ketones », The Journal of Organic Chemistry, vol. 74, no 9, , p. 3616-3619 (PMID 19334701, DOI 10.1021/jo9005238, lire en ligne)
- (en) Horacio R. Diéguez, Armando López, Victoriano Domingo, Jesús F. Arteaga, José A. Dobado, M. Mar Herrador, José F. Quílez del Moral et Alejandro F. Barrero, « Weakening C−O Bonds: Ti(III), a New Reagent for Alcohol Deoxygenation and Carbonyl Coupling Olefination », Journal of the American Chemical Society, vol. 132, no 1, , p. 254-259 (PMID 20000601, DOI 10.1021/ja906083c, lire en ligne)
- (en) Antonio Rosales, Juan L. Oller-López, José Justicia, Andreas Gansäuer, J. Enrique Oltra et Juan M. Cuerva, « Unprecedented Barbier-type reactions catalysed by titanocene(iii) », Chemical Communications, vol. 2004, no 22, , p. 2628-2629 (PMID 15543313, DOI 10.1039/B411173G, lire en ligne)
- (en) Jan Streuff, « A Titanium(III)-Catalyzed Redox Umpolung Reaction for the Reductive Cross-Coupling of Enones with Acrylonitriles », Chemistry, vol. 17, no 20, , p. 5507-5510 (PMID 21488110, DOI 10.1002/chem.201100501, lire en ligne)