Couplage pinacolique
Le couplage pinacolique ou réaction de couplage du pinacol est une réaction organique permettant la formation d'une liaison carbone-carbone entre les groupes carbonyle d'un aldéhyde ou d'une cétone en présence d'un donneur d'électron par un procédé radicalaire, résultant en un diol vicinal[1]. La réaction tient son nom du pinacol (2,3-diméthylbutane-2,3-diol) qui est le produit de cette réaction avec pour réactif initial l'acétone, réaction décrite pour la première fois en 1859 par Rudolph Fittig. Cette réaction est généralement un homocouplage (couplage entre deux molécules identiques) mais il est également possible de faire des couplages croisés intramoléculaires.
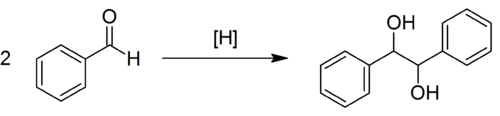
Mécanisme réactionnel
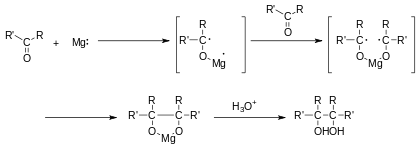
La première étape du mécanisme est une réduction monoélectronique du groupe carbonyle par un agent réducteur, comme le magnésium, en un anion radicalaire cétyle. Deux groupes cétyles réagissent ensuite par une réaction de couplage menant à un diol vicinal avec ses deux groupes hydroxyles déprotonés. L'addition d'eau ou de tout autre donneur de proton donne le diol final.
Avec le magnésium comme donneur d'électron, le produit de la première réaction est un composé pseudo-cyclique à cinq atomes où l'ion magnésium oxydé Mg2+ est coordonné à deux atomes d'oxygène. Ce complexe est brisé par l'addition d'eau avec formation d'hydroxyde de magnésium.
Remarques
Le couplage pinacolique peut être suivi par une transposition pinacolique menant à une cétone. Une réaction proche est la réaction de McMurry qui utilise du trichlorure de titane ou du tétrachlorure de titane en conjonction avec un agent réducteur pour former une complexe métal-diol qui subit une réaction de désoxygénation pour former un alcène.
Utilisation
Le couplage pinacoliquye du benzaldéhyde peut être mené dans l'eau avec du trichlorure de vanadium et de l'aluminium comme co-réducteurs afin de maintenir un cycle catalytique[2]. Cette réaction hétérogène dans l'eau à température ambiante a un rendement de 72 % après trois jours avec une composition 56:44 dl:méso. Dans un autre montage avec le benzaldéhyde utilisant le montmorillonite K-10 et le chlorure de zinc dans le THF aqueux sous ultrasons, le temps de réaction est réduit à trois heures (avec une composition de 55:45)[3]. Certains dérivés de l'acide tartrique peuvent être obtenus avec une haute diastéréosélectivité dans un montage utilisant de l'iodure de samarium(II) et de l'HMPA[4].
Le couplage pinacolique est aussi utilisé en synthèse totale, comme dans la synthèse totale du taxol (en) selon Teruaki Mukaiyama ou selon Nicolaou.
Notes et références
- (de) R. Fittig, « Ueber einige Producte der trockenen Destillation essigsaurer Salze », Liebigs Ann. Chem., vol. 110, no 1, , p. 17–23 (ISSN 0075-4617, DOI 10.1002/jlac.18591100103).
- (en) X Xu et T. Hirao, « Vanadium-Catalyzed Pinacol Coupling Reaction in Water », J. Org. Chem., vol. 70, no 21, , p. 8594–8596 (ISSN 0022-3263, DOI 10.1021/jo051213f).
- (en) Z. Hongjun, L. Jitai et al., « Pinacolization of aromatic aldehydes using Zn/montmorillonite K10-ZnCl2 in aqueous THF under ultrasound », Chemical Journal on Internet, vol. 5, no 1, , p. 8 (lire en ligne).
- (en) Y. H. Kim, S. M. Kim et al., « Asymmetric synthesis by stereocontrol », Pure Appl. Chem., vol. 73, no 2, , p. 283-286 (ISSN 0033-4545, DOI 10.1351/pac200173020283, lire en ligne).
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Pinacol coupling reaction » (voir la liste des auteurs).
Voir aussi
Liens externes
- (en) W. E. Bachmann, « Benzopinacol », Org. Synth., vol. 14, , p. 8 (ISSN 0078-6209, DOI 10.15227/orgsyn.014.0008).
- (en) R. Adams et E. W. Adams, « Pinacol hydrate », Org. Synth., vol. 5, , p. 87 (ISSN 0078-6209, DOI 10.15227/orgsyn.005.0087).