Zoopharmacognosie
La zoopharmacognosie est un comportement d'auto-médication propre à certains animaux non-humains qui se montrent capables en certaines circonstances de rechercher, trouver, sélectionner des molécules naturelles médicamenteuses ou psychotropes. Ces molécules peuvent avoir une origine animale, végétale, fongique, minérale ou microbienne. Les animaux en question ingèrent généralement ces substances ou plus rarement se les appliquent par voie topique. Ces substances peuvent alors les aider à lutter contre des parasitoses, des maladies infectieuses ou les effets nocifs de toxines alimentaires[1] - [2]. Dans quelques cas, l'animal semble rechercher les sensations que semblent lui offrir un psychotrope.

Le terme dérive du grec racines zoo (« animal »), pharma (« médicament »), et gnosy (« savoir »).
Un exemple très connu de zoopharmacognosie est le cas du chien ou du chat mangeant certaines herbes qui le font ensuite vomir, mais il existe de nombreux autres exemples de comportements diversifiés et parfois complexes.
Beaucoup d'animaux ingèrent ou s'appliquent des produits non alimentaires tels que l'argile, le charbon de bois et même parfois des produits toxiques provenant de plantes et/ou d'invertébrés, apparemment pour éloigner ou tuer des parasites ou encore pour combattre un empoisonnement[3].
L'idée que des animaux aient réellement consciemment recours à l'automédication reste controversée car les premiers indices ou preuves sont la plupart du temps circonstancielles ou anecdotiques[4]. Depuis peu des protocoles expérimentaux cherchant à valider des hypothèses sont mis en place, qui devraient confirmer ou infirmer un certain nombre d'hypothèses.
Les méthodes d'auto-médication par l'animal à son profit (ou à celui de ses petits parfois) varient, mais ils peuvent être classés selon leur fonction préventive, prophylactique (prévenant une infection ou d'intoxication) ou thérapeutique (après l'infection, pour mieux lutter contre un agent pathogène ou une intoxication)[4]. Ce type de comportement est supposé avoir une importante signification adaptative[5].
Histoire et étymologie
En 1978, Janzen a suggéré que les vertébrés herbivores pourraient tirer un bénéfice de type médicinal des métabolites secondaires issus de leur alimentation végétale[6].
En 1993, le terme zoopharmacognosy a été créé. Il dérive de la racine grecque zoo (« animal »), pharma (« médicament »), et gnosy (« savoir »")[7]. Le terme et le concept ont gagné en popularité à partir d'articles et recherches universitaires[4] puis d'un livre écrit par Cindy Engel titré Wild Health: How Animals Keep Themselves Well and What We Can Learn from Them (Santé sauvage : comment les animaux se soignent bien, et ce que nous pouvons apprendre d'eux)[8].
Mécanismes
Les effets anti-parasitaires de la zoopharmacognosie pourraient avoir au moins deux mécanismes explicatifs. Tout d'abord, la matière ingérée peut avoir des propriétés pharmacologiques anti-parasitaires (ex. : composés phytochimiques qui inhibent la capacité de vers parasites à s'attacher à la muqueuse intestinale ou une chimiotaxie qui attire des vers dans les plis de feuilles. Certaines plantes ont également des propriétés chélatrices. De nombreuses plantes ingérées durant un comportement supposé être une zoopharmacognosie présentent des propriétés physiques particulières (ex : feuilles à surface rugueuse ou hérissées de poils, qui pourraient gêner certains parasites ou les déloger de la paroi intestinale).
Un second mode d'action est l'ingestion de substances capables de déclencher une purge de l'appareil gastro-intestinal par une diarrhée réduisant considérablement le temps de transit dans l'intestin en provoquant l'expulsion de vers et en interrompant le cycle de vie de certains parasites. Un tel mécanisme pourrait expliquer la présence d'herbes et feuilles ou écorces non digérées dans les fèces de divers animaux (oiseaux, carnivores et primates)[9].
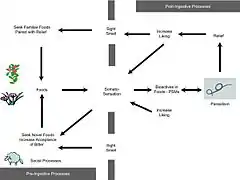
Méthodes d'auto-médication
Certains animaux ingèrent périodiquement ou parfois certaines substances (ex. : argile) ou s'appliquent certaines substances (boue, poussière, excréments) quand ils en trouvent, ce qui suggère un comportement de type préventif ou prophylactique.
Dans d'autres cas, ils ingèrent ou s'appliquent certaines substances ou aliments quand ils sont malades, ce qui suggère des comportements thérapeutiques ou curatifs.
On distingue souvent trois méthodes d'auto-médication : l'ingestion, l'absorption, ou l'application topique.
L'ingestion
De nombreux exemples de zoopharmacognosie impliquent l'ingestion par un animal d'une substance ou de plusieurs substances présentant des propriétés médicinales avérées ou probables.
Fourmis
Les fourmis infectées par le champignon Beauveria bassiana, recherchent et consomment de manière sélective des substances toxiques (espèces réactives de l'oxygène, ROS) quand elles sont exposées à cet agent pathogène fongique, mais les évitent en l'absence d'infection[10].
Mammifères

Les grands singes consomment souvent des plantes sans valeur nutritive, mais ayant des effets bénéfiques en termes de régulation de l’acidité du systèmes digestif ou contre des parasites intestinaux[1].
Les chimpanzés sélectionnent parfois des feuilles très amères qu'ils mastiquent soigneusement. Les infections parasitaires diminuent sensiblement après qu'ils ont mâché des feuilles de l'espèce Vernonia amyddalina dont on a pu confirmer les propriétés anti-parasitaires[12] contre au moins trois parasites (schistosoma, plasmodium et Leishmania). Les chimpanzés ne consomment pas cette plante de manière régulière. Ceux qui en mangent sont peu nombreux et semblent toujours affaiblis ou malades[13].
Des observations, dont celles de Jane Goodall, montrent que les chimpanzés ingurgitent le matin à jeun, sans mastication, des feuilles rugueuses entières (exemples : Aneilema aequinoctiale, Ficus exasperata), favorisant ainsi la purge de leurs intestins des parasites digestifs[12] - [14]. Le tube digestif est vidangé en six heures, alors que le transit intestinal d'un chimpanzé dure habituellement entre 24 et 48 heures[12].
Cette pratique est acquise en quelques années par les jeunes chimpanzés qui observent leur mère, et qui réalisent des essais multiples de pliage et d'ingestion des feuilles, avant de maîtriser la pratique et de devenir autonome[12].
Les chimpanzés mangent parfois aussi les feuilles de l'herbacée Desmodium gangeticum. Elles sont retrouvées non digérées, et non-mâchées dans 4 % des échantillons de matières fécales de chimpanzés sauvages. On retrouve des touffes d'herbes aux feuilles tranchantes dans 2 % des cas. Ces feuilles sont rugueuses ou présentent des bords coupants ; et le fait qu'elles n'ont pas été mâchées et ont été excrétées presque intactes laisse penser qu'elles n'ont pas été mangées à des fins nutritionnelles. Dans ces cas, les ingestions étaient limitées à la saison des pluies, période connue pour être la plus favorable à une réinfection par le parasite. De plus, des vers parasites (Oesophagostomum stephanostomum) ont aussi été trouvés avec les feuilles rejetées dans les excréments[9].
Les chimpanzés, les bonobos et les gorilles mangent les fruits d'Aframomum angustifolium. Les études en laboratoire d'extraits homogénéisés du fruit et des graines ont montré une activité anti-microbienne significative[15].
Certaines espèces de singes semblent avoir des connaissances médicinales (innées ou apprises, cela n'est pas encore clarifié ; ils ont en tous cas été observés par des éthologues en train de soigneusement sélectionner certaines parties de plantes médicinales, par exemple en ôtant les feuilles puis en cassant la tige pour en sucer la sève[16].
Chez le babouin olive (Papio anubis) et chez les babouins hamadryas (Papio hamadryas) en Éthiopie, on a observé l'utilisation des fruits et des feuilles de Balanites aegyptiaca, pour le contrôle de la schistosomiase[17]. Les fruits contiennent effectivement une molécule (diosgénine) un précurseur hormonal qui, vraisemblablement, entrave le développement des schistosomes[4].
Les éléphants d'Afrique (Loxodonta africana) pratiquent apparemment l'équivalent d'une auto-médication pour déclencher la naissance, en masticant les feuilles d'un arbre de la famille des Boraginaceae. Au Kenya les femmes infusent un thé à partir des feuilles de cet arbre, également pour induire l'accouchement[18].
Certains coatis (Nasua narica) au Panama récupèrent une résine mentholée d'écorces fraîchement grattées (écorce de Trattinnickia aspera ; Burseraceae) et la frottent vigoureusement sur leur fourrure ou celle d'autres coatis, peut-être pour tuer des ectoparasites tels que des puces, des tiques oiu des poux, ainsi que des insectes piqueurs comme les moustiques[19]. Il a été montré que cette résine contient des molécules pouvant avoir des effets insecticides ou répulsifs pour les insectes (triterpènes α - et β-amyrine, dérivés d'eudesmane β-sélinène, et sesquiterpène lactone 8β-hydroxyasterolide[15].
Les chiens et chats domestiques sélectionner et mangent souvent du matériel végétal provoquant le vomissement[20].
Des sangliers indiens fouillent sélectivement le sol à la recherche de certaines racines également utilisées par l'homme comme vermifuge. Le folklore mexicain indique que les porcs mangent des racines de grenade ; elles contiennent un alcaloïde toxique pour le ver solitaire[21].
Une étude sur le mouton domestique a montré expérimentalement que cette espèce peut choisir certaines plantes ayant des vertus médicinales correspondant aux symptômes induits par les expérimentateurs quand ils ont forcé le mouton à ingérer des plantes par exemple trop riche en tanins ou en acide oxalique. Le mouton se soigne alors en ingérant de l'argile (type bentonite), du phosphate dicalcique ou une plante contenant du polyéthylène glycol. Des phénomènes similaires ont pu être observés chez d'autres ruminants.
Les cages standardisées de laboratoire empêchent les souris privées de liberté d'assouvir plusieurs de leurs comportements naturels. En conséquence, les souris de laboratoire développent parfois des comportements anormaux indicatif de troubles émotionnels (dépression, anxiété). Pour améliorer leur bien-être, ces cages sont parfois enrichies d'éléments naturels (ex. : matériaux de nidification) ou d'abris et de roulettes. Sherwin et Olsson[22] ont testé si un tel enrichissement de leur environnement pouvait influencer la consommation de Midazolam, un médicament très utilisé contre l'anxiété chez les humains. Des souris en cages standard ou en cages améliorées pouvaient choisir entre deux boissons (enrichie et non enrichie en médicament Midazolam). Les souris en cages normés ont effectivement consommé plus de boisson enrichie en anxiolytique, sans doute parce quelles avaient connu une plus grande anxiété.
De premières études ont conclu qu'une souche de souris présentant systématiquement un problème d'autoimmunité consommait plus de solutions contenant du cyclophosphamide, un médicament immunosuppresseur empêchant les dommages inflammatoires aux organes internes. Mais d'autres études ont ensuite donné des résultats contradictoires[1].
Géophagie
De très nombreux animaux mangent de la terre ou de l'argile dont sous forme de kaolin, un comportement dénommé géophagie. Il a été proposé[23] 4 hypothèses chez les primates, (pouvant logiquement être étendues à d'autres animaux) pour expliquer comment la géophagie peut soulager les troubles gastro-intestinaux :
- les sols argileux absorbent et/ou adsorbent de nombreuses toxines tels que des composés phénoliques et des métabolites secondaires
- l'ingestion de sol a des vertus anti-acides et contribue à ajuster le pH de l'intestin
- l'argile pourrait agir comme un agent antidiarrhéique
- l'argile pourrait contrecarrer les effets de certains endoparasites.
En outre, deux hypothèses donnent à la géophagie un rôle d'apport en compléments et éléments minéraux.
Les tapirs, les éléphants de forêt, les singes colobes, les gorilles et les chimpanzés ont été observés en train de rechercher puis de manger de l'argile, qui pourrait notamment absorber certains métaux lourds, les toxines de certaines bactéries intestinales et soulager des maux d'estomac ainsi que la diarrhée[24]. Des vaches sont capables de manger l'argile enrichie par les termites sur les monticules qu'ils ont construit au-dessus du sol, matière qui tuerait ou inhiberait certains pathogènes ingérés ou protégerait de certaines toxines alimentaires[1].
Les oiseaux

De nombreuses espèces de perroquets, tant dans les Amériques, qu'en Afrique ou en Papouasie-Nouvelle-Guinée consomment très régulièrement du kaolin ou de l'argile, deux substrats minéraux pouvant absorber certains composés toxiques présents dans leur intestin[25].
Des outardes mangent des coléoptères de la famille des méloés et du genre Meloe, ce qui diminue la charge parasitaire de leur système digestif[26], non sans risque car la cantharidine (composé toxique présent dans les méloés) peut tuer une grande outarde si elle ingère trop de coléoptères[27].
Chez les invertébrés
La chenille du papillon (Grammia incorrupta) est parfois mortellement endoparasitée par des larves de mouches de la famille des tachinidae. Les chenilles ingèrent alors des toxines végétales (alcaloïdes de la pyrrolizidine) ce qui améliore ses chances de survie en lui conférant une certaine résistance face à ces mouches[6].
Le Sphynx du tabac ingère de la nicotine, ce qui inhibe la reproduction des bactéries Bacillus thuringiensis qui sécrètent une molécules insecticides. Ainsi les larves nicotinisées voient leur chance de survie améliorée[28].
Absorption et adsorption
L'ingestion de feuilles entières non mâchées par des singes, a été observé pour plus de 40 espèces de plantes.
Les chimpanzés sauvages ingèrent parfois des feuilles entières d'Aspilia. Celles-ci contiennent de la thiarubrine-a, un principe actif efficace contre les nématodes parasites de l'intestin mais cette molécule est facilement détruite par les sucs stomacaux. Les chimpanzés sont capables de ne pas mâcher la feuille, et d'en faire des rouleaux denses, dans leur bouche, ce qui leur prend jusqu'à environ 25 secondes. Ils avalent ensuite ces capsule de feuilles entières (15 à 35 feuilles à chaque épisode de ce comportement, surtout en saison des pluies, au moment de la recrudescence naturelle des larves de ce parasite, quand le risque d'infection est maximal[28].
Les bonobos avalent parfois (et sans les mâcher) des bandes arrachés à la plante Manniophyton fulvum. Bien que cette plante soit abondamment disponible toute l'année, elle n'est ingérée que à des moments précis, en petites quantités, et par une faible proportion de bonobos dans chaque groupe[29].
L'application topique
Certains animaux s'appliquent sur la peau des substances ayant des propriétés médicinales. Encore une fois, cela peut être préventif ou curatif. On parle parfois d'auto-onction.
Chez les mammifères
Une femelle de singe capucin en captivité a été observée en train de badigeonner ses blessures et celle de son petit à l'aide d'outils enduit de sirop de sucre[30] - [31].
L'ours brun nord-américain (Ursos arctos) a été observé en train de fabriquer une pâte à partir de salive et de racines d'Osha (Ligusticum porteri) qu'il s'est ensuite appliqué sur la fourrure, vraisemblablement pour éloigner les insectes ou apaiser les piqûres. Cette plante, connue localement sous le nom de « racine des ours », contient au moins 105 composés actifs, dont des coumarines pouvant repousser les insectes lorsqu'elle est appliquée localement. Les Indiens Navajo auraient ainsi appris à utiliser cette racine en médecine, mais pour traiter des maux d'estomac et certaines infections[15].
Plusieurs primates ont été surpris en train de frotter des mille-pattes sur leur fourrure et sur leur peau ; or les mille-pattes, sécrètent des benzoquinones, composés connus pour être très répulsif pour les insectes[32] - [33] - [34].
Un singe capucin (Cebus apella) frotte les différentes parties de son corps avec des fourmis charpentières (Camponotus rufipes) ou autorise les fourmis à se promoner sur eux (comportement appelé anting par les éthologues), qui est souvent combiné avec le fait d'uriner dans leurs mains en mélangeant les fourmis avec de l'urine[35].
Des dauphins ont été observés faisant la queue dans des environnements naturels pour frotter certaines parties de leur corps contre des coraux (Rumphella aggregata, Sarcophyton sp.) et des éponges (Ircinia sp.) dans le nord de la mer Rouge. Il a été émis l'hypothèse que la présence de métabolites bioactifs explique ce comportement de frottement sélectif. Les trois invertébrés auxquels les dauphins accèdent préférentiellement, collectés et analysés contiennent effectivement dix-sept métabolites actifs, fournissant la preuve d'une automédication potentielle. Des frottements répétés permettent à ces métabolites actifs d'entrer en contact avec la peau des dauphins, ce qui pourrait les aider à atteindre l'homéostasie cutanée et être utile pour la prophylaxie ou le traitement auxiliaire contre les infections microbiennes[36].
Chez les oiseaux
Plus de 200 espèces[28] d'oiseaux chanteurs écrasent des fourmis et s'en enduisent les plumes ou parfois se roulent dans les fourmilières avec des mouvements permettant aux fourmis de pénétrer leurs plumes où elles laisseront de l'acide formique.
Des tests de laboratoire montrent que cet acide est nuisible aux poux qui colonisent les plumes. Sa vapeur seule suffit à les tuer.
Certains oiseaux sélectionnent du matériel de nidification naturellement riche en agents anti-microbiens. Ceci les protège ainsi que leurs jeunes contre des infestations ou des infections (ce qui est moins possible dans les nichoirs artificiels). L'étourneau sansonnet (Sturnus vulgaris) construit préférentiellement son nid avec de la carotte sauvage (Daucus carota) ; les oisillons élevés dans les nids doublée avec cette plante présentent des niveaux plus élevés d'hémoglobine par rapport à ceux élevés dans des nids n'en contenant pas, bien qu'il n'y a pas de différence dans le poids ou la plume de développement des poussins. Les études de laboratoire montrent que la carotte sauvage réduit considérablement l'apparition des stades d'acariens[37]. Le moineau domestique (Passer domesticus) a été observé en train de garnir la bordure de son nid de feuilles de neem (Azadirachta indica), mais en adoptant une autre plante (Caesalpinia pulcherrima) dont les feuilles sont riches en quinine lors d'une épidémie de paludisme ; (la quinine contrôle les symptômes du paludisme)[15] - [38].
Zoopharmacognosie sociale

La zoopharmacognosie n'est pas toujours au profit de l'individu. La cible du « médicament » est parfois le groupe ou la colonie.
La fourmi des bois (Formica paralugubris) apporte souvent de grandes quantités de résine solidifiée de conifères dans le nid de la colonie. Des études en laboratoire ont montré que cette résine inhibe à la fois la croissance de bactéries et de champignons (dans un contexte imitant les conditions naturelles de vie des fourmis)[39] - [40]. Des travaux de laboratoire ont conclu que ce comportement est prophylactiques plutôt que thérapeutique[39] - [41].
Les abeilles incorporent aussi des résines végétales dans leur nid[39]. Quand des colonies d'abeilles sont infestées par le champignon parasite (Ascophaera api), les abeilles augmentent le temps passé à rechercher des résines (par rapport au temps passé en recherche de nourriture).
Des colonies expérimentalement enrichies en résine ont été moins infectées par le champignon[42].
Zoopharmacognosie transgénérationnelle

Plusieurs formes de zoopharmacognosies pourraient aussi être classées en fonction de la cible du principe médicinal utilisé. Certains animaux pondent leurs œufs de manière que leur future progéniture soit la cible de principes actifs bénéfiques pour elle.
Le papillon monarque pond préférentiellement sur des plantes toxiques comme l'asclépiade commune, qui limite le risque de parasitose et de maladie chez sa progéniture (chenilles)[43]. Ce qui a été décrit comme une stratégie thérapeutique transgénérationnelle [44].
Quand la mouche des fruits détecte la présence de guêpes parasitoïdes, elle pond préférentiellement dans des fruits riches en éthanol, ce qui réduit le risque d'infestation pour sa progéniture[44]. Cela a été décrit comme une stratégie trans-générationnelle prophylactique[44].
Intérêt pour l'homme
Les Batooro (bantous de langue Toro) considèrent les animaux comme capables de se soigner, et pensent que l'utilisation de plantes médicinales traditionnelles par leurs ancêtres provient de l'observation animale. Plusieurs plantes sont utilisées de la même façon chez les chimpanzés et les villageois locaux : comme les fruits dAframomum, l'écorce dAlbizia grandibracteata, les feuilles de Celtis africana et de Rubia cordifolia[12].
Des travaux, débutés en 2000 dans le parc national de Kibale en Ouganda par l'équipe de Sabrina Krief montrent que la connaissance de plus de 30 plantes médicinales est partagée par les population humaine et de grands singes[45]. Das une tribue d egrands singes, ce serait 60 plantes médicinales qui auraient été mises en évidence.
De la même manière que la biomimétique s'inspire des formes et processus naturels, la médecine et la zootechnie pourraient tirer parti des observations d'éthologues et de vétérinaires observant les animaux se soigner dans la nature. Dans un entretien avec Neil Campbell, Eloy Rodriguez décrit l'importance de la biodiversité pour la médecine :
- "Certains des composés identifiés grâce à la zoopharmacognosie peuvent tuer des vers parasites, et d'autres s'avèrent utiles contre les tumeurs. Les modèles pour la plupart des médicaments existent déjà dans le monde naturel[16]."
L'observation de chimpanzés sauvages a par exemple permis d'identifier dans les feuilles de trichilia rubescens des molécules ayant une efficacité similaire à celle de la chloroquine en tant qu'antipaludéen[46].
Dans les médias
- 2002 : un télédocumentaire britannique de la télévision de la série Weird Nature épisode 6 Peculiar Potions montre comment de nombreux animaux semblent être capable de se soigner, plus qu'on ne le pensait autrefois[47].
Voir aussi
- Effets des substances psychoactives sur les animaux
- Biomimétisme
- Liste de comportements anormaux chez les animaux
- Pica (maladie)
- Léchage de plaie
- Minéraux à lécher
Notes
- Minesh Kapadia, Hui Zhao, Donglai Ma, Rupal Hatkar, Monica Marchese et Boris Sakic, « Zoopharmacognosy in diseased laboratory mice: Conflicting evidence », PloS One, vol. 9, no 6, , e100684 (PMID 24956477, PMCID 4067353, DOI 10.1371/journal.pone.0100684).
- Attardo, C. et Sartori, F., « Pharmacologically active plant metabolites as survival strategy products », Bollettino chimico farmaceutico, vol. 142, , p. 54–65.
- Jennifer A. Biser, « Really wild remedies — medicinal plant use by animals », sur nationalzoo.si.edu, Parc zoologique national de Washington, (consulté le ).
- Lozano, G.A., « Parasitic stress and self-medication in wild animals », Advances in the Study of Behavior, vol. 27, , p. 291–317 (ISBN 9780120045273, DOI 10.1016/s0065-3454(08)60367-8).
- Raman, R et Kandula, S., « Zoopharmacognosy: Self-medication in wild animals », Resonance, vol. 13, no 3, , p. 245.
- Singer, M.S., Mace, K.C. et Bernays, E.A., « Self-medication as adaptive plasticity: increased ingestion of plant toxins by parasitized caterpillars », PLoS One, vol. 4, no 3, , e4796.
- Rodriguez, E. et Wrangham, R., « Zoopharmacognosy: The use of medicinal plants by animals », Phytochemical Potential of Tropical Plants, vol. 27, , p. 89–105 (ISBN 978-1-4899-1785-0, DOI 10.1007/978-1-4899-1783-6_4, lire en ligne, consulté le ).
- Cindy Engel, Wild Health : How Animals Keep Themselves Well and What We Can Learn from Them, Harcourt Mifflin Harcourt, New York, .
- (en) Andrew Fowler, Yianna Koutsioni et Volker Sommer, « Leaf-swallowing in Nigerian chimpanzees: evidence for assumed self-medication », Primates, vol. 48, no 1, , p. 73-76 (ISSN 0032-8332 et 1610-7365, DOI 10.1007/s10329-006-0001-6).
- Nick Bos, Liselotte Sundström, Siiri Fuchs, Dalial Freitak.
- J. J. Villalba, J. Miller, E. D. Ungar, S. Y. Landau et J. Glendinning, « Ruminant self-medication against gastrointestinal nematodes: evidence, mechanism, and origins », Parasite, vol. 21, , p. 31 (PMID 24971486, PMCID 4073621, DOI 10.1051/parasite/2014032).
- Sabrina Krief, « Automédication des chimpanzés : une "médecine" égoïste ? », dans Alain Froment et Hervé Guy (dir.), Archéologie de la santé, anthropologie du soin , Paris, Éditions La Découverte, 2019, (ISBN 978-2-348-04577-6), p. 189-200..
- Jacobs, J.Q., « Bonobo's late night tales », (consulté le ).
- (en) Vernon Reynolds, The chimpanzees of the Budongo Forest : ecology, behaviour, and conservation, Oxford, Oxford University Press, , 41–43 p. (ISBN 978-0-19-851545-6, lire en ligne).
- Costa-Neto, E.M., « Zoopharmacognosy, the self-medication behavior of animals. », Interfaces Científicas-Saúde e Ambiente, vol. 1, no 1, , p. 61–72 (lire en ligne).
- N.A. Campbell, An interview with Eloy Rodriguez, Benjamin Cummings, NY, coll. « Biology (4th edition) », , 23 p. (ISBN 0-8053-1957-3).
- R Raman et S Kandula, « Zoopharmacognosy: self-medication in wild animals », Resonance, vol. 13, no 3, , p. 245–253 (DOI 10.1007/s12045-008-0038-5).
- Eugene Linden, The Octopus and the Orangutan : More Tales of Animal Intrigue, Intelligence and Ingenuity, New York City, Plume, , 16–17, 104–105, 191 (ISBN 0-452-28411-2, OCLC 49627740, lire en ligne).
- M.A. Huffman, « Current evidence for self-medication in primates: a multidisciplinary perspective », Yearbook of Physical Anthropology, vol. 40, , p. 171–200.
- Orzeck, R., « Pondering the mysteries of our universe: Why do dogs eat grass? », (consulté le ).
- K. E. Glander et N. L. Etkin (dir.), Eating on the Wild Side : The Pharmacologic, Ecologic, and Social Implications of Using Noncultigens, The University of Arizona Press, , 227–239 p., « Nonhuman primate self-medication with wild plant foods ».
- C.M. Sherwin et I.A.S. Olsson, « Housing conditions affect self-administration of anxiolytic by laboratory mice. », Animal Welfare, vol. 13, , p. 33–38.
- Krishnamani R. et Mahaney, W.C., « Geophagy among primates: adaptive significance and ecological consequences », Animal Behaviour, vol. 59, , p. 899–915.
- K.A. Bolton, V.M. Campbell et F.D. Burton, « Chemical analysis of soil of Kowloon (Hong Kong) eaten by hybrid macaques », Journal of Chemical Ecology, vol. 24, , p. 195–205 (DOI 10.1023/a:1022521306597).
- J. Diamond, « Evolutionary biology: Dirty eating for healthy living », Nature, vol. 400, no 6740, , p. 120–121 (PMID 10408435, DOI 10.1038/22014).
- C. Bravo, L.M. Bautista, M. García-París, G. Blanco et J.C. Alonso, « Males of a Strongly Polygynous Species Consume More Poisonous Food than Females », PLoS ONE, vol. 9, no 10, , e111057 (PMID 25337911, PMCID 4206510, DOI 10.1371/journal.pone.0111057).
- I. S. Sánchez-Barbudo, P. Camarero, M. García-Montijano et R. Mateo, « Possible cantharidin poisoning of a great bustard (Otis tarda) », Toxicon, vol. 59, no 1, , p. 100–103 (PMID 22001622, DOI 10.1016/j.toxicon.2011.10.002).
- Clayton, D.H. et Wolfe, N.D., « The adaptive significance of self-medication », Trends in Ecology & Evolution, vol. 8, no 2, , p. 60–63.
- Fruth, B., Ikombe, N.B., Matshimba, G.K., Metzger, S., Muganza, D.M., Mundry, R. et Fowler, A., « New evidence for self‐medication in bonobos: Manniophyton fulvum leaf‐and stemstrip‐swallowing from LuiKotale, Salonga National Park, DR Congo », American Journal of Primatology, vol. 76, no 2, , p. 146–158.
- G. Westergaard et D. Fragaszy, « Self-treatment of wounds by a capuchin monkey (Cebus apella) », Human Evolution, Springer, vol. 2, , p. 557–56 (DOI 10.1007/bf02437429, lire en ligne).
- B.G. Ritchie et D.M. Fragaszy, « Capuchin monkey (Cebus apella) grooms her infant's wound with tools. », American Journal of Primatology, vol. 16, no 4, , p. 345–348 (DOI 10.1002/ajp.1350160407, lire en ligne).
- Weldon, P.J., Aldrich, J.R., Klun, J.A., Oliver, J. E. et Debboun, M., « Benzoquinones from millipedes deter mosquitoes and elicit self-anointing in capuchin monkeys (Cebus spp.) », Naturwissenschaften, vol. 90, no 7, , p. 301–304.
- Valderrama, X., Robinson, J.G., Attygalle, A.B. et Eisner, T., « Seasonal anointment with millipedes in a wild primate: a chemical defense against insects? », Journal of Chemical Ecology, vol. 26, no 12, , p. 2781–2790.
- Laska, M., Bauer, V. et Salazar, L.T.H., « Self-anointing behavior in free-ranging spider monkeys (Ateles geoffroyi) in Mexico », Primates, vol. 48, no 2, , p. 160–163.
- Tiago Falótico, Marcelo B. Labruna, Michele P. Verderane, Patrícia Izar et Eduardo B. Ottoni, « Repellent efficacy of formic acid and the abdominal secretion of carpenter ants (Hymenoptera: Formicidae) against Amblyomma ticks (Acari: Ixodidae) », Journal of Medical Entomology, vol. 44, no 4, , p. 718–721 (PMID 17695031, DOI 10.1093/jmedent/44.4.718, lire en ligne).
- (en) Gertrud E. Morlock, Angela Ziltener et al.,Evidence that Indo-Pacific bottlenose dolphins self-medicate with invertebrates in coral reefs, IScience, Volume 25, Numéro 6, 17 juin 2022, doi.org/10.1016/j.isci.2022.104271
- Clark, L. et Mason, J.R., « Effect of biologically active plants used as nest material and the derived benefit to starling nestlings », Oecologia, vol. 77, no 2, , p. 174–180.
- Jann Ichida, « Birds use herbs to protect their nests, BJS, Science Blog, Wed, 2004-05-26 », Proceedings of the 104th General Meeting of the American Society for Microbiology.
- Serge Morand, François Moutou, Céline Richomme et al. (préf. Jacques Blondel), Faune sauvage, biodiversité et santé, quels défis ?, Versailles, Quæ, coll. « Enjeux Sciences », , 190 p. (ISBN 978-2-7592-2202-5, lire en ligne), II. Quand les animaux prennent soin de leur santé, chap. 6 (« Les animaux sauvages se traitent-ils aux antibiotiques naturels ? »), p. 67-74, accès libre.
- Christe, P., Oppliger, A., Bancala, F., Castella, G. et Chapuisat, M., « Evidence for collective medication in ants », Ecology Letters, vol. 6, , p. 19–22.
- Castella, G., Chapuisat, M. et Christe, P., « Prophylaxis with resin in wood ants », Animal Behaviour, vol. 75, no 4, , p. 1591–1596.
- Simone-Finstrom, M.D. et Spivak, M., « Increased resin collection after parasite challenge: a case of self-medication in honey bees? », PLoS One, vol. 7, no 3, , e34601.
- Lefèvre T., Oliver, L., Hunter, M.D. et de Joode, J.C., « Evidence for trans-generational medication in nature », Ecology Letters, vol. 13, no 12, , p. 1485–1493.
- de Roode, J.C., Lefèvre, T. et Hunter, M.D., « Self-medication in animals », Science, vol. 340, no 6129, , p. 150–151.
- « Les grands singes : qui sont-ils ? Sont-ils capables d’automédication ? – Académie nationale de médecine | Une institution dans son temps » (consulté le )
- Serge Morand, François Moutou, Céline Richomme et al. (préf. Jacques Blondel), Faune sauvage, biodiversité et santé, quels défis ?, Versailles, Quæ, coll. « Enjeux Sciences », , 190 p. (ISBN 978-2-7592-2202-5, lire en ligne), II. Quand les animaux prennent soin de leur santé, chap. 7 (« Les animaux pratiquent-ils la médecine par les plantes ? »), p. 76-81, accès libre.
- BBC Weird Nature (6-6) - Peculiar Potions part 1/3