Plastome
L'ADN chloroplastique (ADNcp) ou plastome est le matériel génétique situé dans les plaste, qui sont des organites photosynthétiques situés dans les cellules de certains organismes eucaryotes tels que les chloroplastes des cellules végétales. Les chloroplastes, comme les autres types de plastides, contiennent un génome distinct de celui du noyau cellulaire. L'existence de l'ADN chloroplastique est identifiée biochimiquement en 1959[1], et confirmée par microscopie électronique en 1962[2]. Les découvertes que le chloroplaste contient des ribosomes[3] et effectue la synthèse des protéines[4] révèlent que le chloroplaste est génétiquement semi-autonome. Les premières séquences complètes du génome du chloroplaste sont publiées en 1986, Nicotiana tabacum (tabac) par Sugiura et ses collègues et Marchantia polymorpha (hépatique) par Ozeki et al[5] - [6]. Depuis lors, un grand nombre d'ADN de plastomes (en) de diverses espèces sont séquencés.
Structure moléculaire
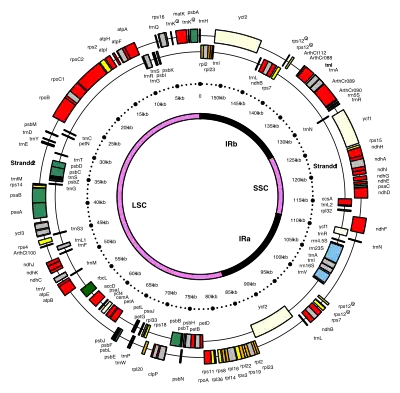
Les ADN de chloroplastes sont circulaires et ont généralement une longueur de 120 000 à 170 000 paires de bases[7] - [8]. Ils peuvent avoir une longueur de contour d'environ 30 à 60 micromètres et une masse d'environ 80 à 130 millions de daltons[9].
Chez la plupart des chloroplastes, l'ensemble de leur génome chloroplastique se combine en un seul anneau, bien que ceux des algues dinophytes soient une exception notable - leur génome est divisé en une quarantaine de petits plasmides, chacun de 2 000 à 10 000 paires de bases de long. Chaque anneau contient un à trois gènes, mais des plasmides vierges, sans ADN codant, peuvent aussi être trouvés[10].
On a longtemps pensé que l'ADN des chloroplastes formait une structure circulaire, mais certaines preuves suggèrent que l'ADN des chloroplastes prend plus souvent une forme linéaire[11]. Plus de 95% de l'ADN chloroplastique dans les chloroplastes de maïs est observé sous forme linéaire ramifiée plutôt que sous forme de cercles individuels[10].
Répétitions inversées
De nombreux ADN de chloroplastes contiennent deux répétitions inversées, qui séparent une longue section à copie unique (LSC) d'une courte section à copie unique (SSC)[7].
Les répétitions inversées varient énormément en longueur, allant de 4 000 à 25 000 paires de bases chacune[10]. Les répétitions inversées chez les plantes ont tendance à se situer à l'extrémité supérieure de cette plage, chacune ayant une longueur de 20 000 à 25 000 paires de bases[7] - [12]. Les régions répétées inversées contiennent généralement trois gènes d'ARN ribosomal et deux gènes d'ARNt, mais elles peuvent être étendues ou réduites pour contenir aussi peu que quatre ou jusqu'à plus de 150 gènes[10]. Alors qu'une paire donnée de répétitions inversées est rarement complètement identique, elles sont toujours très similaires les unes aux autres, résultant apparemment d'une évolution concertée (en)[10].
Les régions répétées inversées sont hautement conservées parmi les plantes terrestres et accumulent peu de mutations[7] - [12]. Des répétitions inversées similaires existent dans les génomes des cyanobactéries et des deux autres lignées de chloroplastes (glaucophyta et rhodophyceæ), suggérant qu'elles sont antérieures au chloroplaste[10], bien que certains ADN de chloroplastes comme ceux des pois et quelques algues rouges[10] aient depuis perdu les répétitions inversées[12] - [13]. D'autres, comme l'algue rouge Porphyra, inversent l'une de ses répétitions inversées (ce qui en fait des répétitions directes)[10]. Il est possible que les répétitions inversées aident à stabiliser le reste du génome du chloroplaste, car les ADN de chloroplaste qui perdent certains des segments répétés inversés ont tendance à se réorganiser davantage[13].
Nucléoïdes
Chaque chloroplaste contient environ 100 copies de son ADN dans les jeunes feuilles, diminuant à 15–20 copies dans les feuilles plus âgées[14]. Ils sont généralement emballés dans des nucléoïdes qui peuvent contenir plusieurs anneaux d'ADN chloroplastiques identiques. De nombreux nucléoïdes peuvent être trouvés dans chaque chloroplaste[9].
Bien que l'ADN du chloroplaste ne soit pas associé à de véritables histones[15], dans les algues rouges, une protéine chloroplastique de type histone (HC) codée par l'ADN du chloroplaste qui emballe étroitement chaque anneau d'ADN du chloroplaste dans un nucléoïde est trouvée[16].
Dans les algues rouges primitives, les nucléoïdes d'ADN du chloroplaste sont regroupés au centre d'un chloroplaste, tandis que dans les plantes vertes et les algues vertes, les nucléoïdes sont dispersés dans tout le stroma[16].
Contenu génétique et expression des gènes plastidiaux
Plus de 5000 génomes de chloroplastes sont séquencés et sont accessibles via la base de données du génome des organelles du NCBI[17]. Les premiers génomes de chloroplastes sont séquencés en 1986, à partir de tabac (Nicotiana tabacum)[18] et d'hépatique (Marchantia polymorpha)[19]. La comparaison des séquences génétiques de la cyanobactérie Synechocystis à celles du génome chloroplastique d'Arabidopsis permet de confirmer l'origine endosymbiotique du chloroplaste. Il démontre l'étendue significative du transfert de gènes de l'ancêtre cyanobactérien vers le génome nucléaire.
Chez la plupart des espèces végétales, le génome du chloroplaste code environ 120 gènes[20] - [8]. Les gènes codent principalement des composants essentiels de la machinerie photosynthétique et des facteurs impliqués dans leur expression et leur assemblage[21]. À travers les espèces de plantes terrestres, l'ensemble des gènes codés par le génome du chloroplaste est assez conservé. Cela comprend quatre ARN ribosomiques, environ 30 ARNt, 21 protéines ribosomiques et 4 sous-unités du complexe ARN polymérase codé par les plastes qui sont impliquées dans l'expression des gènes des plastes[21]. La grande sous-unité Rubisco et 28 protéines thylakoïdes photosynthétiques sont codées dans le génome du chloroplaste[21].
Réduction du génome des chloroplastes et transfert de gènes
Au fil du temps, de nombreuses parties du génome du chloroplaste sont transférées au génome nucléaire de l'hôte[22], un processus appelé transfert de gène endosymbiotique. En conséquence, le génome du chloroplaste est fortement réduit par rapport à celui des cyanobactéries libres. Les chloroplastes peuvent contenir 60 à 100 gènes alors que les cyanobactéries ont souvent plus de 1500 gènes dans leur génome[23]. Au contraire, il n'y a que quelques cas connus où des gènes sont transférés au chloroplaste à partir de divers donneurs, y compris des bactéries[24] - [25] - [26].
Le transfert de gène endosymbiotique est la façon dont nous connaissons les chloroplastes perdus dans de nombreuses lignées de chromalvéolés. Même si un chloroplaste est finalement perdu, les gènes qu'il donne au noyau de l'ancien hôte persistent, fournissant la preuve de l'existence du chloroplaste perdu. Par exemple, alors que les diatomées (un hétérokontophyte) ont maintenant un chloroplaste dérivé d'algues rouges, la présence de nombreux gènes d'algues vertes dans le noyau de la diatomée prouve que l'ancêtre des diatomées (probablement l'ancêtre de tous les chromalvéolates également) a un chloroplaste dérivé d'algues vertes à un certain point, qui est remplacé par le chloroplaste rouge[27].
Chez les plantes terrestres, environ 11 à 14 % de l'ADN de leurs noyaux remontent au chloroplaste[28], jusqu'à 18 % chez Arabidopsis, correspondant à environ 4 500 gènes codant pour des protéines[29]. Il y a quelques transferts récents de gènes de l'ADN du chloroplaste au génome nucléaire chez les plantes terrestres.
Protéines codées par le chloroplaste
Sur les quelque trois mille protéines présentes dans les chloroplastes, environ 95 % d'entre elles sont codées par des gènes nucléaires. De nombreux complexes protéiques du chloroplaste sont constitués de sous-unités du génome du chloroplaste et du génome nucléaire de l'hôte. En conséquence, la synthèse des protéines doit être coordonnée entre le chloroplaste et le noyau. Le chloroplaste est principalement sous contrôle nucléaire, bien que les chloroplastes puissent également émettre des signaux régulant l'expression des gènes dans le noyau, appelés signalisation rétrograde[30].
Synthèse des protéines
La synthèse des protéines dans les chloroplastes repose sur une ARN polymérase codée par le propre génome du chloroplaste, qui est liée aux ARN polymérases trouvées dans les bactéries. Les chloroplastes contiennent également une mystérieuse seconde ARN polymérase codée par le génome nucléaire de la plante. Les deux ARN polymérases peuvent reconnaître et se lier à différents types de promoteurs dans le génome du chloroplaste[31]. Les ribosomes des chloroplastes sont similaires aux ribosomes bactériens[32].
Édition d'ARN dans les plastes
L'édition d'ARN est l'insertion, la suppression et la substitution de nucléotides dans un transcrit d'ARNm avant la traduction en protéine. L'environnement hautement oxydant à l'intérieur des chloroplastes augmente le taux de mutation, de sorte que des réparations post-transcription sont nécessaires pour conserver les séquences fonctionnelles. L'éditosome du chloroplaste remplace C -> U et U -> C à des endroits très spécifiques du transcrit. Cela peut changer le codon d'un acide aminé ou restaurer un pseudogène non fonctionnel en ajoutant un codon d'initiation AUG ou en supprimant un codon d'arrêt UAA prématuré[33].
L'éditosome reconnaît et se lie à la séquence cis en amont du site d'édition. La distance entre le site de liaison et le site d'édition varie selon le gène et les protéines impliquées dans l'éditosome. Des centaines de protéines PPR différentes du génome nucléaire sont impliquées dans le processus d'édition de l'ARN. Ces protéines sont constituées d'acides aminés répétés 35-mères, dont la séquence détermine le site de liaison cis pour le transcrit édité[33].
Les plantes terrestres basales telles que les hépatiques, les mousses et les fougères ont des centaines de sites d'édition différents, tandis que les plantes à fleurs en ont généralement entre trente et quarante. Les plantes parasites telles que Epifagus virginiana montrent une perte d'édition d'ARN entraînant une perte de fonction pour les gènes de la photosynthèse[34].
Réplication de l'ADN
Modèle leader de la réplication de l'ADNc
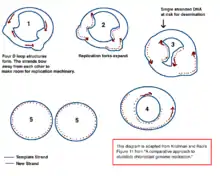
Le mécanisme de réplication de l'ADN chloroplastique (ADNcp) n'a pas été déterminé de manière concluante, mais deux modèles principaux sont proposés. Les scientifiques tentent d'observer la réplication des chloroplastes par microscopie électronique depuis les années 1970[35] - [36]. Les résultats des expériences de microscopie conduisent à l'idée que l'ADN du chloroplaste se réplique à l'aide d'une boucle à double déplacement (boucle D). Au fur et à mesure que la boucle D (en) se déplace dans l'ADN circulaire, elle adopte une forme intermédiaire thêta, également connue sous le nom d'intermédiaire de réplication de Cairns, et complète la réplication avec un mécanisme de cercle roulant[35] - [11]. La réplication commence à des points d'origine spécifiques. Plusieurs fourches de réplication s'ouvrent, permettant aux machines de réplication de répliquer l'ADN. Au fur et à mesure que la réplication se poursuit, les fourches grandissent et finissent par converger. Les nouvelles structures d'ADNcp se séparent, créant des chromosomes filles d'ADNcp.
En plus des premières expériences de microscopie, ce modèle est également soutenu par les quantités de désamination observées dans l'ADNcp[35]. La désamination se produit lorsqu'un groupe amino est perdu et est une mutation qui entraîne souvent des changements de base. Lorsque l'adénine est désaminée, elle devient de l'hypoxanthine (H). L'hypoxanthine peut se lier à la cytosine, et lorsque la paire de bases HC est répliquée, elle devient un GC (donc, un changement de base A → G)[37].
Dans l'ADNc, il existe plusieurs gradients de désamination A → G. L'ADN devient sensible aux événements de désamination lorsqu'il est simple brin. Lorsque des fourches de réplication se forment, le brin non copié est simple brin, et donc à risque de désamination A → G. Par conséquent, les gradients de désamination indiquent que les fourches de réplication sont très probablement présentes et la direction dans laquelle elles s'ouvraient initialement (le gradient le plus élevé est probablement le plus proche du site de départ car il est à simple brin pendant la plus longue période)[35]. Ce mécanisme est toujours la principale théorie aujourd'hui; cependant, une deuxième théorie suggère que la plupart des ADNcp sont en fait linéaires et se répliquent par recombinaison homologue. Il soutient en outre que seule une minorité du matériel génétique est conservée dans des chromosomes circulaires tandis que le reste se trouve dans des structures ramifiées, linéaires ou autres structures complexes[35] - [11].
Modèle alternatif de réplication
L'un des principaux modèles concurrents pour l'ADNcp affirme que la plupart des ADNcp sont linéaires et participent à des structures de recombinaison homologues similaires au bactériophage T4[11]. Il est établi que certaines plantes possèdent un ADNcp linéaire, comme le maïs, et que d'autres contiennent encore des structures complexes que les scientifiques ne comprennent pas encore [11]; Cependant, l'opinion prédominante aujourd'hui est que la plupart des ADNcp sont circulaires. Lorsque les expériences originales sur l'ADNcp sont réalisées, les scientifiques remarquent des structures linéaires ; cependant, ils attribuaient ces formes linéaires à des cercles brisés[11]. Si les structures ramifiées et complexes observées dans les expériences d'ADNcp sont réelles et non des artefacts d'ADN circulaire concaténé ou de cercles brisés, alors un mécanisme de réplication en boucle D est insuffisant pour expliquer comment ces structures se répliqueraient[11]. Dans le même temps, la recombinaison homologue n'explique pas les multiples gradients A → G observés dans les plastomes[35].
Ciblage et importation de protéines
Le mouvement de tant de gènes chloroplastiques vers le noyau signifie que de nombreuses protéines chloroplastiques qui sont censées être traduites dans le chloroplaste sont maintenant synthétisées dans le cytoplasme. Cela signifie que ces protéines doivent être redirigées vers le chloroplaste et importées à travers au moins deux membranes chloroplastiques[38].
Curieusement, environ la moitié des produits protéiques des gènes transférés ne sont même pas dirigés vers le chloroplaste. Beaucoup sont devenus des exaptations, assumant de nouvelles fonctions comme participer à la division cellulaire, au routage des protéines et même à la résistance aux maladies (en). Quelques gènes de chloroplastes trouvent de nouveaux foyers dans le génome mitochondrial - la plupart sont devenus des pseudogènes non fonctionnels, bien que quelques gènes d'ARNt fonctionnent encore dans la mitochondrie[23]. Certains produits protéiques d'ADN de chloroplaste transférés sont dirigés vers la voie de sécrétion [23] (bien que de nombreux plastes secondaires soient délimités par une membrane la plus externe dérivée de la membrane cellulaire de l'hôte, et donc topologiquement à l'extérieur de la cellule, car pour atteindre le chloroplaste à partir du cytosol, vous devez traverser la membrane cellulaire, comme si vous vous dirigiez vers l'espace extracellulaire (en). Dans ces cas, les protéines ciblées sur les chloroplastes voyagent initialement le long de la voie de sécrétion)[39].
Parce que la cellule acquérant un chloroplaste a déjà des mitochondries (et des peroxysomes et une membrane cellulaire pour la sécrétion), le nouvel hôte chloroplaste doit développer un système unique de ciblage des protéines pour éviter que les protéines du chloroplaste ne soient envoyées au mauvais organite[38].
Traduction cytoplasmique et séquences de transit N-terminales
Les polypeptides, précurseurs des protéines, sont des chaînes d'acides aminés. Les deux extrémités d'un polypeptide sont appelées l'extrémité N-terminale ou extrémité amino et l'extrémité C-terminale ou extrémité carboxyle[40]. Pour de nombreuses protéines de chloroplaste (mais pas toutes) [41] codées par des gènes nucléaires, des peptides de transit clivables sont ajoutés aux extrémités N-terminales des polypeptides, qui sont utilisés pour aider à diriger le polypeptide vers le chloroplaste pour l'importation [38] - [42]. (Les peptides de transit N-terminaux sont également utilisés pour diriger les polypeptides vers les mitochondries des plantes)[43]. Les séquences de transit N-terminales sont également appelées préséquences [38] car elles sont situées à l'extrémité "avant" d'un polypeptide - les ribosomes synthétisent les polypeptides de l'extrémité N-terminale à l'extrémité C-terminale[40].
Les peptides de transit des chloroplastes présentent d'énormes variations de longueur et de séquence d'acides aminés[42]. Ils peuvent être longs de 20 à 150 acides aminés [38] - une longueur inhabituellement longue, suggérant que les peptides de transit sont en fait des collections de domaines avec des fonctions différentes[42]. Les peptides de transit ont tendance à être chargés positivement [38], riches en acides aminés hydroxylés tels que la sérine, la thréonine et la proline, et pauvres en acides aminés acides comme l'acide aspartique et l'acide glutamique[42]. Dans une solution aqueuse, la séquence de transit forme une bobine aléatoire[38].
Cependant, toutes les protéines chloroplastiques n'incluent pas un peptide de transit clivable N-terminal[38]. Certains incluent la séquence de transit dans la partie fonctionnelle de la protéine elle-même[38]. Quelques-uns ont leur séquence de transit ajoutée à leur extrémité C-terminale à la place[44]. La plupart des polypeptides dépourvus de séquences de ciblage N-terminales sont ceux qui sont envoyés à la membrane externe des chloroplastes (en), et au moins un envoyé à la membrane interne du chloroplaste (en)[38].
Phosphorylation, chaperons et transport
Après la synthèse d'un polypeptide chloroplastique sur un ribosome dans le cytosol, l'énergie ATP peut être utilisée pour phosphoryler ou ajouter un groupe phosphate à plusieurs (mais pas à tous) d'entre eux dans leurs séquences de transit[38]. La sérine et la thréonine (toutes deux très courantes dans les séquences de transit du chloroplaste - constituant 20 à 30 % de la séquence) [45] sont souvent les acides aminés qui acceptent le groupe phosphate[43] - [45]. L'enzyme qui effectue la phosphorylation est spécifique des polypeptides chloroplastiques et ignore ceux destinés aux mitochondries ou aux peroxysomes[45].
La phosphorylation modifie la forme du polypeptide [45], ce qui facilite la fixation des protéines 14-3-3 (en) au polypeptide[38] - [46]. Chez les plantes, les protéines 14-3-3 ne se lient qu'aux préprotéines des chloroplastes[43]. Il est également lié par la protéine de choc thermique Hsp70 qui empêche le polypeptide de se replier prématurément[38]. Ceci est important car cela empêche les protéines chloroplastiques de prendre leur forme active et d'exercer leurs fonctions chloroplastiques au mauvais endroit, le cytosol[43] - [46]. En même temps, ils doivent conserver juste assez de forme pour pouvoir être reconnus et importés dans le chloroplaste[43].
La protéine de choc thermique et les protéines 14-3-3 forment ensemble un complexe de guidage cytosolique qui facilite l'importation du polypeptide chloroplastique dans le chloroplaste[38].
Alternativement, si le peptide de transit d'une préprotéine de chloroplaste n'est pas phosphorylé, une préprotéine de chloroplaste peut toujours se fixer à une protéine de choc thermique ou Toc159. Ces complexes peuvent se lier au complexe TOC (en) sur la membrane externe du chloroplaste en utilisant l'énergie GTP[38].
Le translocon sur la membrane chloroplastique externe (TOC)
Le complexe TOC, ou translocon sur la membrane externe du chloroplaste, est un ensemble de protéines qui importent des préprotéines à travers l'enveloppe externe du chloroplaste. Cinq sous-unités du complexe TOC sont identifiées : deux protéines de liaison au GTP Toc34 et Toc159, le tunnel d'importation de protéines Toc75, ainsi que les protéines Toc64 [38] et Toc12[41].
Les trois premières protéines forment un complexe central composé d'un Toc159, de quatre à cinq Toc34 et de quatre Toc75 qui forment quatre trous dans un disque de 13 nanomètres de diamètre. L'ensemble du complexe central pèse environ 500 kilodaltons. Les deux autres protéines, Toc64 et Toc12, sont associées au complexe central mais n'en font pas partie[41].
Toc34 et 33
Toc34 est une protéine intégrale de la membrane externe du chloroplaste qui y est ancrée par sa queue hydrophobe [47] C-terminale[38] - [46]. Cependant, la majeure partie de la protéine, y compris son grand domaine de liaison au guanosine triphosphate (GTP), se projette dans le stroma[46].
Le travail de Toc34 consiste à attraper certaines préprotéines chloroplastiques dans le cytosol et à les transmettre au reste du complexe TOC[38]. Lorsque le GTP, une molécule énergétique similaire à l'ATP, se fixe à Toc34, la protéine devient beaucoup plus capable de se lier à de nombreuses préprotéines chloroplastiques dans le cytosol[38]. La présence de la préprotéine du chloroplaste amène Toc34 à décomposer le GTP en guanosine diphosphate (GDP) et en phosphate inorganique. Cette perte de GTP oblige la protéine Toc34 à libérer la préprotéine du chloroplaste, la transmettant à la prochaine protéine TOC[38]. Toc34 libère alors la molécule de GDP appauvrie, probablement à l'aide d'un facteur d'échange GDP (en) inconnu. Un domaine de Toc159 pourrait être le facteur d'échange qui effectue la suppression du GDP. La protéine Toc34 peut alors capter une autre molécule de GTP et recommencer le cycle[38].
Toc34 peut être désactivé par phosphorylation. Une protéine kinase dérivant sur la membrane externe du chloroplaste peut utiliser l'ATP pour ajouter un groupe phosphate à la protéine Toc34, l'empêchant de pouvoir recevoir une autre molécule de GTP, inhibant l'activité de la protéine. Cela pourrait fournir un moyen de réguler l'importation de protéines dans les chloroplastes[38] - [46].
Arabidopsis thaliana possède deux protéines homologues, AtToc33 et AtToc34 (At signifie Arabidopsis thaliana)[38] - [46], qui sont chacune identiques à environ 60 % dans la séquence d'acides aminés à Toc34 dans les pois (appelé ps Toc34)[46]. AtToc33 est le plus courant chez Arabidopsis[46], et c'est l'analogue fonctionnel de Toc34 car il peut être désactivé par phosphorylation. AtToc34, en revanche, ne peut pas être phosphorylé[38] - [46].
Toc159
Toc159 est une autre sous-unité TOC de liaison GTP, comme Toc34. Toc159 a trois domaines. À l'extrémité N-terminale se trouve le domaine A, qui est riche en acides aminés acides et occupe environ la moitié de la longueur de la protéine[38] - [47]. Le domaine A est souvent clivé, laissant un fragment de 86 kilodaltons appelé Toc86[47]. Au milieu se trouve son domaine de liaison au GTP, qui est très similaire au domaine de liaison au GTP homologue dans Toc34[38] - [47]. À l'extrémité C-terminale se trouve le domaine M hydrophile[38], qui ancre la protéine à la membrane externe du chloroplaste[47].
Toc159 fonctionne probablement beaucoup comme Toc34, reconnaissant les protéines dans le cytosol à l'aide de GTP. Elle peut être régulée par phosphorylation, mais par une protéine kinase différente de celle qui phosphoryle Toc34[41]. Son domaine M fait partie du tunnel que traversent les préprotéines chloroplastiques et semble fournir la force qui pousse les préprotéines à travers, en utilisant l'énergie du GTP[38].
Toc159 ne fait pas toujours partie du complexe TOC - il est trouvé dissous dans le cytosol. Cela suggère qu'il pourrait agir comme une navette qui trouve les préprotéines chloroplastiques dans le cytosol et les ramène au complexe TOC. Il n'y a cependant pas beaucoup de preuves directes de ce comportement[38].
Une famille de protéines Toc159, Toc159, Toc132, Toc120 et Toc90 est trouvée chez Arabidopsis thaliana. Ils varient dans la longueur de leurs domaines A, qui disparait complètement dans Toc90. Toc132, Toc120 et Toc90 semblent avoir des fonctions spécialisées dans l'importation de choses comme les préprotéines non photosynthétiques, et ne peuvent pas remplacer Toc159[38].
Toc75
Toc75 est la protéine la plus abondante sur l'enveloppe externe du chloroplaste. C'est un tube transmembranaire qui forme la majeure partie du pore TOC lui-même. Toc75 est un canal en tonneau β tapissé de 16 nappes plissées β[38]. Le trou qu'il forme mesure environ 2,5 nanomètres de large aux extrémités et se rétrécit à environ 1,4 à 1,6 nanomètre de diamètre à son point le plus étroit - suffisamment large pour permettre le passage des préprotéines chloroplastiques partiellement repliées[38].
Toc75 peut également se lier aux préprotéines des chloroplastes, mais est bien pire que Toc34 ou Toc159[38].
Arabidopsis thaliana a plusieurs isoformes de Toc75 qui sont nommées par les positions chromosomiques des gènes qui les codent. AtToc75 III est le plus abondant d'entre eux[38].
Le translocon sur la membrane interne du chloroplaste (TIC)
Le complexe TIC/TOC (en) , ou translocon sur le translocon de la membrane interne du chloroplaste [38] est un autre complexe protéique qui importe des protéines à travers l'enveloppe interne du chloroplaste. Les chaînes polypeptidiques des chloroplastes voyagent probablement souvent à travers les deux complexes en même temps, mais le complexe TIC peut également récupérer des préprotéines perdues dans l'espace intermembranaire[38].
Comme le translocon TOC, le translocon TIC a un grand complexe central entouré de certaines protéines périphériques faiblement associées comme Tic110, Tic40 et Tic21[48]. Le complexe central pèse environ un million de daltons et contient Tic214, Tic100, Tic56 et Tic20 I, peut-être trois de chaque[48].
Tic20
Tic20 est une protéine intégrale dont on pense qu'elle possède quatre hélices α transmembranaires[38]. On le trouve dans le complexe TIC de 1 million de daltons[48]. Parce qu'il est similaire aux transporteurs d'acides aminés bactériens et à la protéine d'importation mitochondriale Tim17 [38] (translocase sur la membrane mitochondriale interne)[49], il est proposé de faire partie du canal d'importation des TIC[38]. Il n'y a cependant aucune preuve in vitro de cela[38]. Chez Arabidopsis thaliana, on sait que pour environ cinq protéines Toc75 dans la membrane externe du chloroplaste, il existe deux protéines Tic20 I (la forme principale de Tic20 chez Arabidopsis) dans la membrane interne du chloroplaste[48].
Contrairement à Tic214, Tic100 ou Tic56, Tic20 a des parents homologues dans les cyanobactéries et presque toutes les lignées de chloroplastes, ce qui suggère qu'il évolue avant la première endosymbiose des chloroplastes. Tic214, Tic100 et Tic56 sont uniques aux chloroplastes de chloroplastidane, ce qui suggère qu'ils évoluent plus tard[48].
Tic214
Tic214 est une autre protéine du complexe central TIC, nommée parce qu'elle pèse un peu moins de 214 kilodaltons. Il a une longueur de 1786 acides aminés et on pense qu'il a six domaines transmembranaires sur son extrémité N-terminale. Tic214 est remarquable pour être codé par l'ADN du chloroplaste, plus spécifiquement le premier cadre de lecture ouvert ycf1. Tic214 et Tic20 constituent probablement ensemble la partie du complexe TIC d'un million de daltons qui s'étend sur toute la membrane. Le Tic20 est enfoui à l'intérieur du complexe tandis que le Tic214 est exposé des deux côtés de la membrane interne du chloroplaste[48].
Tic100
Tic100 est une protéine codée au niveau nucléaire qui compte 871 acides aminés. Les 871 acides aminés pèsent collectivement un peu moins de 100 000 daltons, et comme la protéine mature ne perd probablement aucun acide aminé lorsqu'elle est elle-même importée dans le chloroplaste (elle n'a pas de peptide de transit clivable), elle est nommée Tic100. Tic100 se trouve sur les bords du complexe de 1 million de daltons du côté qui fait face à l'espace intermembranaire du chloroplaste[48].
Tic56
Tic56 est également une protéine codée nucléaire. La préprotéine que code son gène a une longueur de 527 acides aminés et pèse près de 62 000 daltons ; la forme mature subit probablement un traitement qui la réduit à quelque chose qui pèse 56 000 daltons lorsqu'elle est importée dans le chloroplaste. Tic56 est largement intégré à l'intérieur du complexe de 1 million de daltons[48].
Tic56 et Tic100 sont hautement conservés parmi les plantes terrestres, mais ils ne ressemblent à aucune protéine dont la fonction est connue. Ni l'un ni l'autre n'a de domaines transmembranaires[48].
Articles connexes
Notes et références
- (en) C. R. Stocking et E. M. Gifford, « Incorporation of thymidine into chloroplasts of Spirogyra », Biochemical and Biophysical Research Communications, vol. 1, no 3, , p. 159–164 (ISSN 0006-291X, DOI 10.1016/0006-291X(59)90010-5, lire en ligne, consulté le )
- Hans Ris et Walter Plaut, « ULTRASTRUCTURE OF DNA-CONTAINING AREAS IN THE CHLOROPLAST OF CHLAMYDOMONAS », Journal of Cell Biology, vol. 13, no 3, , p. 383–391 (ISSN 1540-8140 et 0021-9525, PMID 14492436, PMCID PMC2106071, DOI 10.1083/jcb.13.3.383, lire en ligne, consulté le )
- (en) J. W. Lyttleton, « Isolation of ribosomes from spinach chloroplasts », Experimental Cell Research, vol. 26, no 2, , p. 312–317 (ISSN 0014-4827, DOI 10.1016/0014-4827(62)90183-0, lire en ligne, consulté le )
- (en) U. Heber, « Protein Synthesis in Chloroplasts during Photosynthesis », Nature, vol. 195, no 4836, , p. 91–92 (ISSN 1476-4687, DOI 10.1038/195091a0, lire en ligne, consulté le )
- Shinozaki, Ohme, Tanaka et Wakasugi, « The complete nucleotide sequence of the tobacco chloroplast genome: its gene organization and expression », The EMBO Journal, vol. 5, no 9, , p. 2043–2049 (ISSN 0261-4189, PMID 16453699, PMCID 1167080, DOI 10.1002/j.1460-2075.1986.tb04464.x)
- (en) Ohyama, Fukuzawa, Kohchi et Shirai, « Chloroplast gene organization deduced from complete sequence of liverwort Marchantia polymorpha chloroplast DNA », Nature, vol. 322, no 6079, , p. 572–574 (ISSN 1476-4687, DOI 10.1038/322572a0, Bibcode 1986Natur.322..572O, S2CID 4311952, lire en ligne)
- « Comparison of whole chloroplast genome sequences to choose noncoding regions for phylogenetic studies in angiosperms: the tortoise and the hare III », American Journal of Botany, vol. 94, no 3, , p. 275–88 (PMID 21636401, DOI 10.3732/ajb.94.3.275, S2CID 30501148)
- (en) M T Clegg, B S Gaut, G H Learn et B R Morton, « Rates and patterns of chloroplast DNA evolution. », Proceedings of the National Academy of Sciences, vol. 91, no 15, , p. 6795–6801 (ISSN 0027-8424 et 1091-6490, PMID 8041699, PMCID PMC44285, DOI 10.1073/pnas.91.15.6795, lire en ligne, consulté le )
- Jeremy Burgess, An introduction to plant cell development, Cambridge, Cambridge university press, (ISBN 978-0-521-31611-8, lire en ligne), p. 62
- Anna Stina Sandelius et Henrik Aronsson, The chloroplast : interactions with the environment, Springer, (ISBN 978-3-540-68696-5, 3-540-68696-7 et 3-540-68692-4, OCLC 314183729, lire en ligne)
- « Circular chloroplast chromosomes: the grand illusion », The Plant Cell, vol. 16, no 7, , p. 1661–6 (PMID 15235123, PMCID 514151, DOI 10.1105/tpc.160771)
- « Inverted repeats in chloroplast DNA from higher plants », Proceedings of the National Academy of Sciences of the United States of America, vol. 76, no 1, , p. 41–5 (PMID 16592612, PMCID 382872, DOI 10.1073/pnas.76.1.41, Bibcode 1979PNAS...76...41K)
- « Chloroplast DNA rearrangements are more frequent when a large inverted repeat sequence is lost », Cell, vol. 29, no 2, , p. 537–50 (PMID 6288261, DOI 10.1016/0092-8674(82)90170-2, S2CID 11571695)
- Plant Biochemistry, Academic Press, (ISBN 9780120883912, lire en ligne
 ), 517 :
), 517 :« number of copies of ctDNA per chloroplast. »
- Biology 8th Edition Campbell & Reece, Benjamin Cummings (Pearson), , p. 516
- « Detection and localization of a chloroplast-encoded HU-like protein that organizes chloroplast nucleoids », The Plant Cell, vol. 14, no 7, , p. 1579–89 (PMID 12119376, PMCID 150708, DOI 10.1105/tpc.002717)
- « Organelle Genome Resources », sur www.ncbi.nlm.nih.gov (consulté le )
- (en) K. Shinozaki, M. Ohme, M. Tanaka et T. Wakasugi, « The complete nucleotide sequence of the tobacco chloroplast genome: its gene organization and expression », The EMBO Journal, vol. 5, no 9, , p. 2043–2049 (PMID 16453699, PMCID PMC1167080, DOI 10.1002/j.1460-2075.1986.tb04464.x, lire en ligne, consulté le )
- (en) Kanji Ohyama, Hideya Fukuzawa, Takayuki Kohchi et Hiromasa Shirai, « Chloroplast gene organization deduced from complete sequence of liverwort Marchantia polymorpha chloroplast DNA », Nature, vol. 322, no 6079, , p. 572–574 (ISSN 1476-4687, DOI 10.1038/322572a0, lire en ligne, consulté le )
- Henry Daniell, Choun-Sea Lin, Ming Yu et Wan-Jung Chang, « Chloroplast genomes: diversity, evolution, and applications in genetic engineering », Genome Biology, vol. 17, no 1, , p. 134 (ISSN 1474-760X, PMID 27339192, PMCID PMC4918201, DOI 10.1186/s13059-016-1004-2, lire en ligne, consulté le )
- (en) James O. Berry, Pradeep Yerramsetty, Amy M. Zielinski et Christopher M. Mure, « Photosynthetic gene expression in higher plants », Photosynthesis Research, vol. 117, no 1, , p. 91–120 (ISSN 1573-5079, DOI 10.1007/s11120-013-9880-8, lire en ligne, consulté le )
- « Direct measurement of the transfer rate of chloroplast DNA into the nucleus », Nature, vol. 422, no 6927, , p. 72–6 (PMID 12594458, DOI 10.1038/nature01435, Bibcode 2003Natur.422...72H, S2CID 4319507)
- « Evolutionary analysis of Arabidopsis, cyanobacterial, and chloroplast genomes reveals plastid phylogeny and thousands of cyanobacterial genes in the nucleus », Proceedings of the National Academy of Sciences of the United States of America, vol. 99, no 19, , p. 12246–51 (PMID 12218172, PMCID 129430, DOI 10.1073/pnas.182432999, Bibcode 2002PNAS...9912246M)
- « The case of horizontal gene transfer from bacteria to the peculiar dinoflagellate plastid genome », Mobile Genetic Elements, vol. 3, no 4, , e25845 (PMID 24195014, PMCID 3812789, DOI 10.4161/mge.25845)
- « The chloroplast genomes of Bryopsis plumosa and Tydemania expeditiones (Bryopsidales, Chlorophyta): compact genomes and genes of bacterial origin », BMC Genomics, vol. 16, no 1, , p. 204 (PMID 25879186, PMCID 4487195, DOI 10.1186/s12864-015-1418-3)
- « Mobile Elements Shape Plastome Evolution in Ferns », Genome Biology and Evolution, vol. 10, no 10, , p. 2669–2571 (PMID 30165616, PMCID 6166771, DOI 10.1093/gbe/evy189)
- « Genomic footprints of a cryptic plastid endosymbiosis in diatoms », Science, vol. 324, no 5935, , p. 1724–6 (PMID 19556510, DOI 10.1126/science.1172983, Bibcode 2009Sci...324.1724M, S2CID 11408339, lire en ligne)
- « Endosymbiotic gene transfer and transcriptional regulation of transferred genes in Paulinella chromatophora », Molecular Biology and Evolution, vol. 28, no 1, , p. 407–22 (PMID 20702568, DOI 10.1093/molbev/msq209)
- « Algal genomics: exploring the imprint of endosymbiosis », Current Biology, vol. 16, no 24, , R1033-5 (PMID 17174910, DOI 10.1016/j.cub.2006.11.008, S2CID 17830745)
- « Signals from chloroplasts converge to regulate nuclear gene expression », Science, vol. 316, no 5825, , p. 715–9 (PMID 17395793, DOI 10.1126/science.1140516, Bibcode 2007Sci...316..715K, lire en ligne)
- « Mitochondrial and chloroplast phage-type RNA polymerases in Arabidopsis », Science, vol. 277, no 5327, , p. 809–11 (PMID 9242608, DOI 10.1126/science.277.5327.809)
- « Chloroplast ribosomes and protein synthesis », Microbiological Reviews, vol. 58, no 4, , p. 700–54 (PMID 7854253, PMCID 372988, DOI 10.1128/MMBR.58.4.700-754.1994)
- « RNA editing in plants and its evolution », Annual Review of Genetics, vol. 47, no 1, , p. 335–52 (PMID 24274753, DOI 10.1146/annurev-genet-111212-133519)
- « The ins and outs of editing and splicing of plastid RNAs: lessons from parasitic plants », New Biotechnology, special Issue: Biotechnology Annual Review 2010RNA Basics and Biotechnology Applications, vol. 27, no 3, , p. 256–66 (PMID 20206308, DOI 10.1016/j.nbt.2010.02.020)
- « A comparative approach to elucidate chloroplast genome replication », BMC Genomics, vol. 10, no 237, , p. 237 (PMID 19457260, PMCID 2695485, DOI 10.1186/1471-2164-10-237)
- Heinhorst, Gordon C. Cannon, « DNA replication in chloroplasts », Journal of Cell Science, vol. 104, , p. 1–9 (DOI 10.1242/jcs.104.1.1, lire en ligne)
- « Effect of chemical mutagens on nucleotide sequence », Biocyclopedia (consulté le )
- « Protein import into chloroplasts », Nature Reviews. Molecular Cell Biology, vol. 5, no 3, , p. 198–208 (PMID 14991000, DOI 10.1038/nrm1333, S2CID 32453554)
- « The endosymbiotic origin, diversification and fate of plastids », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 365, no 1541, , p. 729–48 (PMID 20124341, PMCID 2817223, DOI 10.1098/rstb.2009.0103)
- Biology 8th edition—Campbell & Reece, Benjamin Cummings, (ISBN 978-0-321-54325-7), p. 340
- Robert R. Wise et J. Kenneth Hoober, Structure and function of plastids, Berlin, Springer, , 53–74 p. (ISBN 978-1-4020-6570-5, lire en ligne)
- « Functional characterization of sequence motifs in the transit peptide of Arabidopsis small subunit of rubisco », Plant Physiology, vol. 140, no 2, , p. 466–83 (PMID 16384899, PMCID 1361317, DOI 10.1104/pp.105.074575)
- « 14-3-3 proteins form a guidance complex with chloroplast precursor proteins in plants », The Plant Cell, vol. 12, no 1, , p. 53–64 (PMID 10634907, PMCID 140214, DOI 10.1105/tpc.12.1.53)
- « A transit peptide-like sorting signal at the C terminus directs the Bienertia sinuspersici preprotein receptor Toc159 to the chloroplast outer membrane », The Plant Cell, vol. 24, no 4, , p. 1560–78 (PMID 22517318, PMCID 3398564, DOI 10.1105/tpc.112.096248)
- « Phosphorylation of the transit sequence of chloroplast precursor proteins », The Journal of Biological Chemistry, vol. 271, no 11, , p. 6545–54 (PMID 8626459, DOI 10.1074/jbc.271.11.6545, S2CID 26014578)
- « Toc, Tic, and chloroplast protein import », Biochimica et Biophysica Acta (BBA) - Molecular Cell Research, vol. 1541, nos 1–2, , p. 64–79 (PMID 11750663, DOI 10.1016/S0167-4889(01)00147-1)
- « The acidic A-domain of Arabidopsis TOC159 occurs as a hyperphosphorylated protein », Plant Physiology, vol. 153, no 3, , p. 1016–30 (PMID 20457805, PMCID 2899928, DOI 10.1104/pp.110.158048)
- « Uncovering the protein translocon at the chloroplast inner envelope membrane », Science, vol. 339, no 6119, , p. 571–4 (PMID 23372012, DOI 10.1126/science.1229262, Bibcode 2013Sci...339..571K, S2CID 5062593)
- Sean P Curran et Carla M Koehler, Mitochondrial Function and Biogenesis, Springer, (ISBN 9783540214892, lire en ligne), p. 59