Translocon
Le translocon, aussi appelé complexe de translocation, est un complexe de protéines responsable de la translocation de polypeptides au travers des membranes biologiques[1].
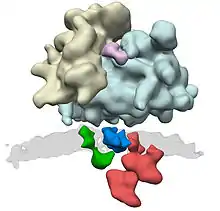
Chez les eucaryotes, le terme translocon désigne en général le nesrine qui transporte les polypeptides naissants porteurs d'une séquence signal depuis le cytosol vers l'intérieur (cisterna ou lumière) du réticulum endoplasmique (RE). Ce transport requiert que la protéine traverse une bicouche lipidique hydrophobe. Le même complexe permet d'inclure des protéines membranaires naissantes dans la membrane elle-même.
Chez les procaryotes, il existe un complexe protéique similaire accomplissant les mêmes fonctions[2]. Il existe des bactéries pathogènes capables d'assembler des translocons dans les membranes de leurs hôtes, afin d'y introduire des facteurs de virulence[3].
Chez les procaryotes
Le canal de translocation présent chez les bactéries est formé d'un complexe protéique trimérique appelé SecYEG. Il consiste en trois unités SecY, SecE et SecG. La structure de l'homologue de ce complexe chez les archaeas a été déterminée par cristallographie[4]. Après un long débat concernant la formation d'oligomères de ce complexe, la plupart des chercheurs considèrent aujourd'hui qu'un monomère SecYEG suffit à remplir sa fonction[5].
Le translocon du RE
Les protéines formant le translocon sont appelées protéines Sec[6]. Ce complexe est lui-même formé de plusieurs grands complexes protéiques. L'élément central est le canal de translocation, l'hétérotrimère Sec61. Parmi les autres composants, on connaît le complexe oligosaccharyl transférase, le complexe TRAP, et la protéine membranaire TRAM. Il n'est pas certain que d'autres constituants comme la signal peptidase et le récepteur SRP fassent partie intégrante du complexe et ne s'y associent pas transitoirement.
Les protéines devant être transloquées dans le réticulum endoplasmique comportent la séquence SRP (signal-recognition particle), qui entraîne l'arrêt de la traduction par le ribosome. Le complexe ribosome-ARNm-peptide en cours de traduction s'accroche alors au récepteur du SRP à la surface du réticulum endoplasmique. Cette reconnaissance est basée sur une séquence de signal spécifique se trouvant parmi les premiers codons du polypeptide. La traduction de la protéine se poursuit au travers du canal du translocon. Une fois cela terminé, une enzyme appelée signal peptidase clive la séquence signal, laissant la protéine libre à l'intérieur du réticulum endoplasmique.
Le translocon peut aussi intégrer les protéines de membrane avec la bonne orientation. Le mécanisme permettant cela n'est pas entièrement compris, mais il semblerait que le translocon soit capable de reconnaître des étendues hydrophobes dans la protéine d'en faire des hélices transmembranaires.
Le rétrotranslocon du RE
Les translocons peuvent aussi transporter des polypeptides, par exemple des protéines endommagées destinées à être dégradées, depuis l'espace cisternal vers le cytosol. Les protéines du réticulum endoplasmique sont ainsi dégradée dans le cytosol par le protéasome 26S, ce qui nécessite leur évacuation. Ce processus, appelé dégradation des protéines associée au réticulum endoplasmique, est encore énigmatique pour les chercheurs.
Initialement, le canal Sec61 était tenu pour responsable de ce transport rétrograde[7]. Cependant, la structure de Sec61 ne confirme pas cette hypothèse et différentes protéines ont été suggérées pour assurer le transport rétrograde de la lumière du RE vers le cytosol[8].
Références
- (en) A.E. Johnson et M.A. van Waes, « The translocon: a dynamic gateway at the ER membrane », Annu. Rev. Cell Dev. Biol., (DOI 10.1146/annurev.cellbio.15.1.799)
- Gold VA, Duong F, Collinson I, « Structure and function of the bacterial Sec translocon », Mol. Membr. Biol., vol. 24, nos 5–6, , p. 387–94 (PMID 17710643, DOI 10.1080/09687680701416570)
- (en) CA Mueller, P Broz et GR Cornelis, « The type III secretion system tip complex and translocon », Mol. Microbiol., vol. 68, no 5, , p. 1085–95 (PMID 18430138, DOI 10.1111/j.1365-2958.2008.06237.x)
- (en) « X-ray structure of a protein-conducting channel », Nautre, vol. 427, no 6969, , p. 36–44 (PMID 14661030, DOI 10.1038/nature02218)
- (en) Alexej Kedrov, Ilja Kusters, Victor V Krasnikov et Arnold J M Driessen, « A single copy of SecYEG is sufficient for preprotein translocation », The EMBO Journal, vol. 30, no 21, , p. 4387-4391 (DOI 10.1038/emboj.2011.314)
- Deshaies RJ, Sanders SL, Feldheim DA, Schekman R., « Assembly of yeast Sec proteins involved in translocation into the endoplasmic reticulum into a membrane-bound multisubunit complex », Nature, vol. 349, no 6312, , p. 806–8 (PMID 2000150, DOI 10.1038/349806a0)
- Römisch K, « Surfing the Sec61 channel: bidirectional protein translocation across the ER membrane », J. Cell. Sci., vol. 112, no 23, , p. 4185–91 (PMID 10564637, lire en ligne)
- R. Y. Hampton et T. Sommer, « Finding the will and the way of ERAD substrate retrotranslocation », Current opinion in cell biology, vol. 24, no 4, , p. 460–466 (DOI 10.1016/j.ceb.2012.05.010)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « translocon » (voir la liste des auteurs).
Liens externes
- (en) « The structure of a protein conducting channel », sur RCSB Protein Data Bank