Hexafluorure de neptunium
L’hexafluorure de neptunium est un composé chimique de formule NpF6. Il s'agit d'un solide cristallisé orangé, volatil, fortement corrosif et radioactif. Il reste stable à l'air sec, mais réagit violemment avec l'eau. Dans des conditions de pression normales, il fond à 54,4 °C et s'évapore à 55,18 °C. C'est le seul composé du neptunium facilement obtenu sous forme gazeuse. On le produit généralement en faisant réagir du tétrafluorure de neptunium NpF4 avec du fluor F2.
| Hexafluorure de neptunium | |
 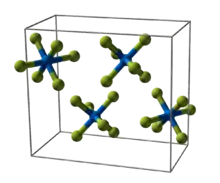 |
|
| __ Np6+ __ F− Molécule et structure cristalline de l'hexafluorure de neptunium |
|
| Identification | |
|---|---|
| No CAS | |
| Apparence | solide cristallisé orangé[1] |
| Propriétés chimiques | |
| Formule | NpF6 |
| Masse molaire[2] | 256 g/mol F 7,42 %, Np 92,6 %, |
| Propriétés physiques | |
| T° fusion | 54,4 °C[1] |
| T° ébullition | 55,18 °C[1] |
| Point triple | 55,10 °C sous 101 kPa[1] |
| Cristallographie | |
| Système cristallin | orthorhombique[3] |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | Pnma (no 62) [3] |
| Notation Schönflies | Oh |
| Paramètres de maille | a = 990,9 pm, b = 899,7 pm, c = 520,2 pm, Z = 4[3] |
| Précautions | |
 Composé radioactif |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Ses propriétés physiques le rendent intéressant pour séparer le neptunium des déchets nucléaires. Il est cependant assez difficile à manipuler en raison de sa nature corrosive.
Production
On prépare l'hexafluorure de neptunium NpF6 par fluoration de tétrafluorure de neptunium NpF4 sous l'effet de fluor F2 à 500 °C[4] :
En comparaison, l'hexafluorure d'uranium UF6 se forme assez rapidement à partir de tétrafluorure d'uranium UF4 à 300 °C tandis que l'hexafluorure de plutonium PuF6 ne se forme à partir de tétrafluorure de plutonium NpF4 qu'à 750 °C[4] : ces différences permettent de séparer efficacement l'uranium, le neptunium et le plutonium.
Il est également possible de procéder à partir du trifluorure de neptunium NpF3 et de l'oxyde de neptunium(IV) NpO2[5] :
Il est également possible d'employer des réactifs de fluoration plus énergiques tels que le trifluorure de brome BrF3 et le pentafluorure de brome BrF5. Ces réactions peuvent permettre de séparer le plutonium car le tétrafluorure de plutonium PuF4 ne réagit pas de la même manière[6] - [7].
Le NpF4 et le NpO2 sont presque entièrement convertis en NpF6 par le difluorure de dioxygène O2F2. Ces réactions font intervenir des solides dans un gaz à température modérée ou dans le fluorure d'hydrogène liquide anhydre à −78 °C[8] :
Ces températures de réaction sont sensiblement différentes des températures élevées de plus de 200 °C précédemment requises pour synthétiser l'hexafluorure de neptunium avec du fluor ou des fluorures d'halogène[8]. Le fluorure de neptunyle NpO2F2 a été détecté par spectroscopie Raman comme intermédiaire dominant dans la réaction avec NpO2. La réaction directe du NpF4 avec l'O2F2 liquide a conduit en revanche à une décomposition vigoureuse de l'O2F2 sans donner de NpF6.
Propriétés
L'hexafluorure de neptunium cristallise dans le système orthorhombique en formant un solide orangé qui fond à 54,4 °C et s'évapore à 55,18 °C à pression atmosphérique ; son point triple est à 55,10 °C sous 101 kPa[1]. Sa structure cristalline appartient au groupe d'espace Pnma (no 62) avec pour paramètres cristallins a = 990,9 pm, b = 899,7 pm, c = 520,2 pm et Z = 4[3]. À l'état gazeux, la molécule NpF6 adopte une géométrie octaédrique de symétrie Oh avec des longueurs de liaisons Np–F uniformes de 198,1 pm[9]. La volatilité du NpF6 est semblable à celle de l'UF6 et du PuF6. L'hexafluorure de neptunium est paramagnétique, avec une susceptibilité magnétique de 165 × 10−6 cm3/mol[10] - [11].
L'hexafluorure de neptunium est stable au contact de l'air sec mais réagit vigoureusement au contact de l'eau, y compris de l'humidité atmosphérique, pour former du fluorure de neptunyle NpO2F2 soluble et de l'acide fluorhydrique HF :
Il peut être stocké à température ambiante dans une ampoule en verre de quartz ou en pyrex du moment qu'on en a éliminé toute trace d'humidité, toute inclusion de gaz dans le verre et tout résidu de fluorure d'hydrogène[4]. Le PuF6 et le NpF6 sont tous deux photosensibles et se décomposent en F2 et respectivement en PuF4 et NpF4[4].
L'hexafluorure de neptunium forme des complexes avec les fluorures de métaux alcalins : il forme du CsNpF6 à 25 °C avec le fluorure de césium CsF[12] et réversiblement du Na3NpF8 avec le fluorure de sodium NaF[13]. Dans les deux cas, le neptunium est réduit en Np(V) :
En présence de trifluorure de chlore ClF3 comme solvant et à basse température, des indications suggèrent l'existence d'un complexe instable de Np(IV)[12].
Applications
L'irradiation du combustible nucléaire à l'intérieur des réacteurs produit à la fois des produits de fission et des transuraniens, dont le neptunium et le plutonium. La sépération de ces éléments est une étape essentielle du traitement du combustible nucléaire usé et l'hexafluorure de neptunium NpF6 intervient dans la séparation du neptunium d'avec l'uranium et le plutonium.
L'extraction de l'uranium, qui représente 95 % de la masse du combustible nucléaire usé, implique que ce dernier soit préalablement réduit en poudre afin de permettre la fluoration directe en présence de fluor F2. Les fluorures volatils qui en résultent — essentiellement de l'UF6 avec de petites quantités de NpF6 — sont facilement extraits des fluorures non volatils des autres produits de fission, comme le tétrafluorure de plutonium PuF4, le fluorure d'américium(III) (en) AmF3 et le fluorure de curium(III) (en) CmF3[14]. le mélange d'UF6 et de NpF6 est ensuite réduit sélectivement par du fluorure de cobalt(II) CoF2 granulé, qui convertit NpF6 en NpF4 mais ne réagit pas avec l'UF6, en employant des températures de 93 à 204 °C[15].
Une autre méthode consiste à utiliser du fluorure de magnésium MgF2, sur lequel le fluorure de neptunium est sorbé à 60-70 % mais pas le fluorure d'uranium[16].
Notes et références
- (de) C. Keller, « Die Chemie des Neptuniums », Fortschritte der Chemischen Forschung, 1969/70, 13/1, p. 1–124, section p. 71–75, DOI 10.1007/BFb0051170.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Manuel Gmelin de chimie minérale, Système no 71, Transuraniens, partie C, p. 108–114.
- (en) John G. Malm, Bernard Weinstock et E. Eugene Weaver, « The Preparation and Properties of NpF5; a Comparison with PuF5 », The Journal of Physical Chemistry, vol. 62, no 12, , p. 1506-1508 (DOI 10.1021/j150570a009, lire en ligne)
- (en) Sherman Fried et Norman Davidson, « The Preparation of Solid Neptunium Compounds », Journal of the American Chemical Society, vol. 70, no 11, , p. 3539-3547 (PMID 18102891, DOI 10.1021/ja01191a003, lire en ligne)
- (en) L. E. Trevorrow, T. J. Gerding et M. J. Steindler, Laboratory Investigations in Support of Fluid-bed Fluoride Volatility Processes. Part XVII. The Fluorination of Neptunium(IV) fluoride and Neptunium(IV) oxide, Argonne National Laboratory Report ANL-7385, janvier 1968, DOI 10.2172/4492135.
- (en) L. E. Trevorrow, T. J. Gerding et M. J. Steindler, « The fluorination of neptunium(IV) fluoride and neptunium(IV) oxide », Journal of Inorganic and Nuclear Chemistry, vol. 30, no 10, , p. 2671-2677 (DOI 10.1016/0022-1902(68)80394-X, lire en ligne)
- (en) P. Gary Eller, Larned B. Asprey, Scott A. Kinkead, Basil I. Swanson et Richard J. Kissane, « Reactions of dioxygen difluoride with neptunium oxides and fluorides », Journal of Alloys and Compounds, vol. 269, nos 1-2, , p. 63-66 (DOI 10.1016/S0925-8388(98)00005-X, lire en ligne)
- (en) Masao Kimura, Verner Schomaker et Darwin W. Smith, « Electron‐Diffraction Investigation of the Hexafluorides of Tungsten, Osmium, Iridium, Uranium, Neptunium, and Plutonium », The Journal of Chemical Physics, vol. 48, no 9, , p. 4001-4012 (DOI 10.1063/1.1669727, Bibcode 1968JChPh..48.4001K, lire en ligne)
- (en) Clyde A. Hutchison Jr. et Bernard Weinstock, « Paramagnetic Resonance Absorption in Neptunium Hexafluoride », The Journal of Chemical Physics, vol. 32, no 1, , p. 56-61 (DOI 10.1063/1.1700947, Bibcode 1960JChPh..32...56H, lire en ligne)
- (en) Clyde A. Hutchison Jr., Tung Tsang et Bernard Weinstock, « Magnetic Susceptibility of Neptunium Hexafluoride in Uranium Hexafluoride », The Journal of Chemical Physics, vol. 37, no 3, , p. 555-562 (DOI 10.1063/1.1701373, Bibcode 1962JChPh..37..555H, lire en ligne)
- (en) R. D. Peacock et Norman Edelstein, « Some reactions of neptunium hexafluoride », Journal of Inorganic and Nuclear Chemistry, vol. 38, no 4, , p. 771-773 (DOI 10.1016/0022-1902(76)80353-3, lire en ligne)
- (en) LeVerne E. Trevorrow, T. J. Gerding et Martin J. Steindler, « Reaction of neptunium hexafluoride with sodium fluoride », Inorganic Chemistry, vol. 7, no 11, , p. 2226-2229 (DOI 10.1021/ic50069a010, lire en ligne)
- (en) Jan Uhlíř et Martin Mareček, « Fluoride volatility method for reprocessing of LWR and FR fuels », Journal of Fluorine Chemistry, vol. 130, no 1, , p. 89-93 (DOI 10.1016/j.jfluchem.2008.07.002, lire en ligne)
- (en) Waldo R. Golliher, Robert L. Harris et Reynold A. Ledoux pour US Atomic Energy Commission (AEC), Brevet U.S. 3615267A : Separation of neptunium from uranium hexafluoride containing the same, déposé le 11 mars 1969, publié le 26 octobre 1971, sur Google Patents.
- (en) Tsuyoshi Nakajima et Henri Groult, Fluorinated Materials for Energy Conversion, Elsevier, 2005, p. 559. (ISBN 978-0080444727)



