Fluorure de cobalt(II)
Le fluorure de cobalt(II) est un composé chimique de formule CoF2. Il se présente sous la forme d'une poudre cristallisée de couleur rose. Il en existe plusieurs hydrates, notamment le tétrahydrate CoF2·4H2O. Le CoF2 est utilisé industriellement dans les processus sensibles à l'oxygène O2, à savoir la production de métaux. C'est un acide de Lewis faible, peu soluble dans l'eau et qui se décompose dans l'eau bouillante, mais qui peut être dissous dans les acides minéraux chauds ; les hydrates, qui se décomposent également à la chaleur, sont cependant solubles dans l'eau, notamment le dihydrate CoF2·2H2O et le trihydrate CoF2·3H2O.
| Fluorure de cobalt(II) | |||
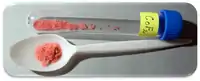 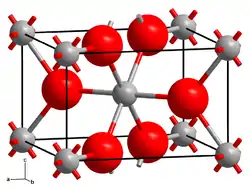 __ Co2+ __ F− Apparence et maille cristalline du fluorure de cobalt(II) |
|||
| Identification | |||
|---|---|---|---|
| Nom UICPA | difluorocobalt | ||
| Synonymes |
difluorure de cobalt |
||
| No CAS | (anhydre) (dihydrate) (trihydrate) (tétrahydrate) |
||
| No ECHA | 100.030.044 | ||
| No CE | 233-061-9 (anhydre) | ||
| PubChem | 24820 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | CoF2 [Isomères] |
||
| Masse molaire[1] | 96,930 001 ± 6,0E−6 g/mol Co 60,8 %, F 39,2 %, |
||
| Propriétés physiques | |||
| Masse volumique | 4,43 g·cm-3[2] à 25 °C | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Production
Le fluorure de cobalt(II) CoF2 peut être préparé à partir de chlorure de cobalt(II) ou d'oxyde de cobalt(II) CoO anhydres dans un courant de fluorure d'hydrogène HF :
Du fluorure de cobalt(II) est également dégagé lors de la réaction du fluorure de cobalt(III) CoF3 avec l'eau H2O.
Du tétrahydrate de fluorure de cobalt(II) CoF2·4H2O se forme lors de la dissolution de cobalt(II) Co2+ dans de l'acide fluorhydrique HF (aq), dont on peut extraire le fluorure anhydre CoF2 par déshydratation.
D'autres synthèses peuvent être réalisées à haute température. Il a ainsi été démontré qu'à 500 °C, le fluor F2 se combine avec le cobalt pour donner un mélange de fluorures de cobalt(II) CoF2 et de cobalt(III) CoF3.
Applications
Le fluorure de cobalt(II) CoF2 peut être utilisé comme catalyseur pour réaliser des alliages métalliques. Il est également utilisé pour réaliser des dépôts optiques, dont il améliore considérablement la qualité optique. Il est disponible commercialement en quantité à très haute pureté, la pureté améliorant les qualités optiques et son utilisation en tant que standard.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Fluorure de cobalt(II), consultée le 3 février 2013.
