Fluorure de cobalt(III)
Le fluorure de cobalt(III), ou trifluorure de cobalt, est un composé chimique de formule CoF3. Il s'agit d'un solide brun cristallisé hygroscopique — il s'hydrate en formant un dihydrate CoF3·2H2O — et très réactif, utilisé dans des réactions de fluoration[3], le produit étant le fluorure de cobalt(II) CoF2.
| Fluorure de cobalt(III) | |||
-fluoride-3D-balls.png.webp) 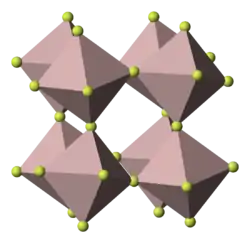 Structure et maille cristalline du fluorure de cobalt(III) |
|||
| Identification | |||
|---|---|---|---|
| Synonymes |
trifluorure de cobalt |
||
| No CAS | (anhydre) (dihydrate) |
||
| No ECHA | 100.030.045 | ||
| No CE | 233-062-4 (anhydre) | ||
| PubChem | 6431878 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | CoF3 [Isomères] |
||
| Masse molaire[1] | 115,928 405 ± 7,0E−6 g/mol Co 50,84 %, F 49,16 %, |
||
| Propriétés physiques | |||
| Masse volumique | 3,88 g·cm-3[2] | ||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Obtention
Le fluorure de cobalt(III) est préparé en laboratoire en traitant du chlorure de cobalt(II) CoF2 avec du fluor F2 à 250 °C[4] :
Il s'agit d'une réaction d'oxydoréduction dans laquelle Co2+ est converti en Co3+ et le chlorure Cl− en chlore Cl tandis que le fluor F est converti en fluorure F−. l'oxyde de cobalt(II) CoO et le fluorure de cobalt(II) CoF2 peuvent également être convertis en fluorure de cobalt(III) en utilisant du fluor F2.
Réactivité
Le fluorure de cobalt(III) se décompose au contact de l'eau H2O en libérant de l'oxygène O2 :
À 200 K, la réaction entre le fluorure de cobalt(III) et le pentaoxyde de diazote donne du nitrate de cobalt(III) (Co(NO3)3)[5].
Structure cristalline
Le fluorure de cobalt(III) est isostructural du fluorure de fer(III)[5].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Fluorure de cobalt(III), consultée le 2 février 2013.
- (en) Paul L. Coe, « Cobalt(III) Fluoride », Encyclopedia of Reagents for Organic Synthesis, (lire en ligne) DOI 10.1002/047084289X.rc185
- (en) Ludwig F. Audrieth, Homer F. Priest, Carl F. Swinehert, « Anhydrous Metal Fluorides », Inorganic Syntheses, vol. 3, , p. 171-183 (lire en ligne) DOI 10.1002/9780470132340.ch47
- Catherine Housecroft et Alan Sharpe (trad. de l'anglais par André Pousse), Chimie inorganique, Bruxelles/Paris, De Boeck, , 1097 p. (ISBN 978-2-8041-6218-4, lire en ligne), p. 722
