Chlorure de cobalt(II)
Le chlorure de cobalt(II) est un composé inorganique constitué de cobalt et de chlore, de formule CoCl2. On le trouve usuellement sous la forme d'hexahydrate CoCl2•6H2O, qui est le composé du cobalt le plus commun en laboratoire[8]. Cette forme hexahydrate est violette, alors que la forme anhydre est bleu ciel.
| Chlorure de cobalt(II) | |
  Chlorure de cobalt anhydre et hexahydrate 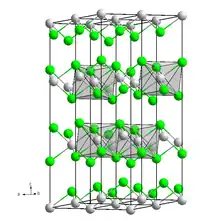 __ Co2+ __ Cl− Structure cristalline du chlorure de cobalt |
|
| Identification | |
|---|---|
| Nom UICPA | chlorure de cobalt(II) |
| Synonymes |
chlorure cobalteux |
| No CAS | (anhydre) (dihydrate) (hexahydrate) |
| No ECHA | 100.028.718 |
| No CE | 231-589-4 |
| No RTECS | GF9800000 |
| PubChem | 3032536 |
| SMILES | |
| InChI | |
| Apparence | cristaux bleus (anhydre), violets (hexahydrate), bleu-violet (monohydrate), bleu-violet foncé (mono hémihydrate), rose-violet (dihydrate), fleur de pêcher rouge (tétrahydrate)[1] |
| Propriétés chimiques | |
| Formule | CoCl2 |
| Masse molaire[2] | 129,839 ± 0,004 g/mol Cl 54,61 %, Co 45,39 %, |
| Propriétés physiques | |
| T° fusion | 735 °C[1] |
| T° ébullition | 1 049 °C[1] |
| Solubilité | 529 g·l-1 (eau, 20 °C)[1] |
| Masse volumique | 3,356 g·cm-3[1] |
| Pression de vapeur saturante | 100 hPa (818 °C)[3] 53 hPa (770 °C)[3] |
| Précautions | |
| SGH[3] | |
   |
|
| NFPA 704[3] | |
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 55 mg/kg (cochon d'inde oral)[4] 49 mg/kg (souris, intrapéritonéal)[5] |
| CL50 | 0,33 mg/l - 96 h (carpe)[3] |
| LogP | 0,85[3] |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriété

À l'état solide, le CoCl2•6H2O consiste en une molécule de trans-[CoCl2(H2O)4] et de deux molécules d'eau de cristallisation[9]. La structure cristalline de l'anhydre est identique à celle du chlorure de cadmium. Anhydre et hexahydrate se dissolvent facilement dans l'eau et dans l'éthanol. Les solutions aqueuses de CoCl2 et de son hydrate contiennent l'espèce [Co(H2O)6]2+, ainsi que des ions chlorure. Ces solutions concentrées sont rouges à température ambiante et deviennent bleues lorsqu'elles sont chauffées[10].
CoCl2•6H2O est déliquescent le sel anhydre CoCl2 est hygroscopique, se convertissant rapidement en hydrate. Le chlorure de cobalt(II) donne une flamme bleu-vert.
Synthèse
Les formes hydratées de chlorure de cobalt sont préparées à partir d'hydroxyde de cobalt(II) ou de carbonate de cobalt(II) et d'acide chlorhydrique :
- Co(OH)2 + 2 HCl → Co(H2O)6Cl2
- CoCO3 + 2 HCl → CoCl2 + H2O + CO2
Lorsqu'il est chauffé, l'hexahydrate se déshydrate par étapes[11].
Réactions
4.png.webp)
En général, les solutions aqueuses de chlorure de cobalt(II) se comportent comme les autres solutions de sel de cobalt(II) puisque ces solutions contiennent des ions [Co(H2O)6]2+ indifféremment du contre-ion. De telles solutions donnent un précipité de sulfure de colbalt (CoS) lorsque traitées avec du sulfure d'hydrogène (H2S). CoCl2•6H2O et CoCl2 sont des acides de Lewis faibles qui réagissent pour donner un adduit, en général octaédrique ou tétraédrique. Avec la pyridine (C5H5N), on obtient un complexe octaédrique :
- CoCl2•6H2O + 4 C5H5N → CoCl2(C5H5N)4 + 6 H2O
Avec le ligand encombré triphénylphosphine (P(C6H5)3), on obtient des complexes tétraédriques :
- CoCl2•6H2O + 2 P(C6H5)3 → CoCl2{P(C6H5)3}2 + 6 H2O
La réaction entre le composé anhydre et le cyclopentadiénure de sodium donne le cobaltocène. Ce composé à 19 électrons est un bon agent réducteur, car il est facilement oxydé en cation cobaltacénium jaune à 18 électrons.
La réaction du1-norbonyllithium avec le CoCl2•THF dans le pentane produit le tétralkyle de cobalt(IV), un composé marron, stable thermiquement[12] - [13], un rare exemple de composé métal/alcane saturé stable[8], d'autres produits étant obtenus dans d'autres solvants[14].
Dérivés Co(III)
En présence d'ammoniac ou d'amines, le cobalt(II) est facilement oxydé par le dioxygène de l'atmosphère pour former divers complexes de cobalt(III). Par exemple, la présence d'ammoniac déclenche l'oxydation du chlorure de cobalt(II) en chlorure d'hexamminecobalt(III) :
- 4 CoCl2•6H2O + 4 NH4Cl + 20 NH3 + O2 → 4 [Co(NH3)6]Cl3 + 26 H2O
Cette réaction est souvent réalisée en présence de charbon comme catalyseur et parfois le peroxyde d'hydrogène est utilisé à la place de l'air. La présence d'autres ligands fortement basiques, tels que le carbonate, l'acétylacétonate ou l'oxalate provoque la formation de dérivés Co(III), alors que la présence de carboxylates ou d'halogénures ne le permet pas.
Contrairement aux complexes de Co(II), les complexes de Co(III) sont très lents pour échanger leurs ligands, et on les considère souvent comme « cinétiquement inertes ».
Instabilité de CoCl3
L'existence du chlorure de cobalt(III) chloride, CoCl3 est mise en doute, même si ce composé est listé dans certains recueils[15]. Selon Greenwood and Earnshaw, le seul composant binaire stable du cobalt et d'halogènes, si l'on exclut CoF3, sont des dihalogénures[8]. La stabilité de Co(III) en solution est considérablement accrue en présence de ligands dont la basicité de Lewis est plus grande que celle du chlorure, tels que les amines.
Utilisation
En laboratoire, le chlorure de cobalt(II) sert de précurseur à d'autres composés du cobalt
En raison de la facilité de la réaction hydration/déshydration et du changement de couleur qu'elle induit, le chlorure de cobalt est utilisé comme indicateur d'humidité dans les dessicants.
Il peut être (rarement) utilisé en synthèse organique et pour la galvanoplastie d'objets par le cobalt métallique.
Il est parfois utilisé comme « encre invisible », car la solution aqueuse du composé hexahydraté est à peine visible sur le papier, et une fois chauffé (par exemple avec une bougie), apparait une encre d'un bleu profond.
Le chlorure de cobalt(II) peut être utilisé comme additif à l'électrolyte utilisé dans les accumulateurs au plomb (en général l'acide sulfurique), afin d'augmenter les performances et la durée de vie de la batterie.
On peut également utiliser ce dernier comme catalyseur pour une réaction de l'eau oxygénée avec du tartrate de sodium-potassium[16].
Notes et références
- Entrée « Cobalt dichloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 23 septembre 2012 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Cobalt(II) chloride, consultée le 23 septembre 2012.
- Hygiene and Sanitation Vol. 36(1-3), Pg. 277, 1971
- Naunyn-Schmiedeberg's Archiv fuer Experimentelle Pathologie und Pharmakologie. Vol. 244, Pg. 17, 1962 PubMed
- Indian Journal of Pharmacology. Vol. 23, Pg. 153, 1991
- Journal of the American Pharmaceutical Association, Scientific Edition. Vol. 48, Pg. 143, 1959
- Greenwood, Norman N.; Earnshaw, Alan (1997). Chemistry of the Elements (2nd ed.). Butterworth–Heinemann. (ISBN 0080379419).
- Wells, A. F. (1984), Structural Inorganic Chemistry (5th ed.), Oxford: Clarendon Press, (ISBN 0-19-855370-6)
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- John Dallas Donaldson, Detmar Beyersmann, "Cobalt and Cobalt Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2005. DOI 10.1002/14356007.a07_281.pub2
- (en) Barton K. Bower and Howard G. Tennent, « Transition metal bicyclo[2.2.1]hept-1-yls », J. Am. Chem. Soc., vol. 94, no 7, , p. 2512–2514 (DOI 10.1021/ja00762a056)
- (en) Erin K. Byrne, Darrin S. Richeson and Klaus H. Theopold, « Tetrakis(1-norbornyl)cobalt, a low spin tetrahedral complex of a first row transition metal », J. Chem. Soc., Chem. Commun., no 19, , p. 1491–1492 (DOI 10.1039/C39860001491)
- (en) Erin K. Byrne, Klaus H. Theopold, « Synthesis, characterization, and electron-transfer reactivity of norbornyl complexes of cobalt in unusually high oxidation states », J. Am. Chem. Soc., vol. 111, no 11, , p. 3887–3896 (DOI 10.1021/ja00193a021)
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- Contrôler l’évolution d’un système chimique par la catalyse : Cours de TS chimie
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Cobalt(II) chloride » (voir la liste des auteurs).