Trifluorure de chlore
Le trifluorure de chlore est un interhalogène de formule ClF3. C'est un gaz incolore, très oxydant et extrêmement réactif, corrosif et toxique, qui se condense en un liquide jaune verdâtre. C'est sous sa forme liquide pressurisée à température ambiante qu'on le trouve le plus souvent sur le marché. On s'en sert surtout dans les phases de nettoyage et pour les gravures chimiques dans l'industrie des semiconducteurs[5] - [6], et dans quelques autres processus industriels[7]. Il est notamment utilisé dans le cycle du combustible nucléaire[8], où il permet la conversion des composés fluorés d'uranium non volatils en hexafluorure d'uranium UF6, composé aux propriétés physiques intéressantes du point de vue des procédés d'enrichissement de l'uranium :
| Trifluorure de chlore | |
 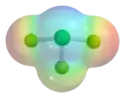  |
|
| Structure du trifluorure de chlore. | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.301 |
| No CE | 232-230-4 |
| No RTECS | FO2800000 |
| PubChem | 24637 |
| ChEBI | 30123 |
| SMILES | |
| InChI | |
| Apparence | Gaz ou liquide jaunâtre |
| Propriétés chimiques | |
| Formule | ClF3 |
| Masse molaire[1] | 92,448 ± 0,002 g/mol Cl 38,35 %, F 61,65 %, |
| Moment dipolaire | 0,6 ± 0,1 D[2] |
| Propriétés physiques | |
| T° fusion | −76,31 °C[3] |
| T° ébullition | 11,8 °C[3] |
| Masse volumique | 3,57 kg·m-3[3] à 0 °C et 101,3 kPa |
| Pression de vapeur saturante | 141,9 kPa[3] à 20 °C |
| Point critique | 174,0 °C ; 5,78 MPa ; 0,548 g·cm-3[3] |
| Point triple | −76,3 °C[3] |
| Thermochimie | |
| ΔvapH° | 27,53 kJ·mol-1 (1 atm, 11,75 °C)[4] |
| Précautions | |
| SGH[3] | |
    Danger |
|
| Transport[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Son utilisation comme comburant pour la propulsion spatiale est aujourd'hui abandonnée compte tenu des risques réels pour le matériel et pour les équipages ; c'est en revanche la matière première pour la synthèse du pentafluorure de chlore ClF5, un ergol parfois employé, le plus souvent avec l'hydrazine, pour la propulsion de certains missiles[9].
Préparation et propriétés
Le trifluorure de chlore a été préparé pour la première fois en 1931 par deux chimistes allemands, O. Ruff et H. Kug, par réaction du fluor F2 sur le chlore Cl2, ce qui produisit également du monofluorure de chlore ClF, séparé du trifluorure par distillation[10] :
La molécule ClF3 a une forme en T, que la théorie VSEPR permet bien d'expliquer :
- l'atome de chlore est au centre de la molécule
- l'une des trois positions équatoriales est occupée par un atome de fluor lié au chlore par une liaison covalente
- les deux autres positions équatoriales sont occupées chacune par un doublet non liant
- les deux positions axiales sont occupées chacune par un atome de fluor formant, avec l'atome de chlore central, une liaison à trois centres et quatre électrons, normalement rectiligne mais ici un peu repliée sous l'effet des deux doublets non liants.
Les trois atomes de fluor sont donc liés au chlore par des liaisons de type différent, ce qui se traduit par des longueurs de liaison différentes :
- ~ 159,8 pm pour la liaison Cl-F équatoriale (covalente)
- ~ 169,8 pm pour les liaisons Cl-F axiales (qui participent à la liaison 3c-4e)
Le trifluorure de chlore pur est stable jusqu'à 180 °C, mais se décompose en F2 et Cl2 au-dessus de cette température.
C'est un oxydant très énergique ainsi qu'un agent fluorant. Très réactif avec la plupart des matières organiques et minérales, il est susceptible d'en déclencher la combustion spontanément, parfois de façon explosive. Les métaux donnent généralement des chlorures et des fluorures, le phosphore donne du trichlorure de phosphore PCl3 et du pentafluorure de phosphore PF5, tandis que le soufre donne du dichlorure de soufre SCl2 ainsi que du tétrafluorure de soufre SF4. À température ambiante, le sulfure d'hydrogène H2S explose au contact du trifluorure de chlore, lequel s'hydrolyse également violemment au contact de l'eau H2O en dégageant un ensemble de composés dangereux, à commencer par le fluorure d'hydrogène HF.
Risques
Le trifluorure de chlore étant plus oxydant que l'oxygène lui-même, il est susceptible de corroder des céramiques ainsi que divers matériaux à base d'oxydes minéraux qu'on imagine souvent être incombustibles, y compris le béton. Tout ce qui est amené à entrer en contact avec du ClF3 doit être soigneusement sélectionné et nettoyé de toute impureté qui pourrait déclencher une combustion explosive.
Au contact de la peau, le trifluorure de chlore peut déclencher la combustion des tissus vivants s'il est en quantité suffisante. Il s'hydrolyse en attaquant les cellules, en une réaction très exothermique qui provoque des brûlures à la fois thermiques et chimiques, notamment par l'acide fluorhydrique libéré dans les tissus par cette hydrolyse. Cet acide est, de surcroît, toxique, de sorte que l'empoisonnement métabolique s'ajoute aux dégradations physiologiques causées par sa nature acide.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50.
- Entrée « Chlorotrifluoride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 mai 2018 (JavaScript nécessaire)
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0).
- (en) Hitoshi Habuka, Takahiro Sukenobu, Hideyuki Koda, Takashi Takeuchi, and Masahiko Aihara, « Silicon Etch Rate Using Chlorine Trifluoride », Journal of the Electrochemical Society, vol. 151, no 11, , G783–G787 (DOI 10.1149/1.1806391).
- United States Patent 5849092 "Process for chlorine trifluoride chamber cleaning".
- United States Patent 6034016 "Method for regenerating halogenated Lewis acid catalysts".
- (en) (BEST) Board on Environmental Studies and Toxicology, Acute Exposure Guideline Levels for Selected Airborne Chemicals : Volume 5 http : //books.nap.edu/catalog.php?record_id=11774 (citation at the National Academies Press), Washington, National Academies Press, , 267 p., poche (ISBN 978-0-309-10358-9, LCCN 2002275572), p. 40.
- notamment certains missiles balistiques intercontinentaux, qui utilisent généralement des propergols liquides à quelques exceptions près, telles que, semble-t-il, le nouveau Jéricho-3 israélien.
- (en) Otto Ruff, H. Krug, « Über ein neues Chlorfluorid-CIF3 », Zeitschrift für anorganische und allgemeine Chemie, vol. 190, no 1, , p. 602–608 (DOI 10.1002/zaac.19301900127).


