Tétrafluorure de soufre
Le tétrafluorure de soufre est le composé chimique de formule SF4. C'est un gaz corrosif qui produit de l'acide fluorhydrique HF en présence d'eau ou d'humidité, mais qui est également très utilisé comme réactif dans la préparation de composés organofluorés[6] dont certains sont importants en chimie de spécialité et dans l'industrie pharmaceutique.
| Tétrafluorure de soufre | |
   Structure du tétrafluorure de soufre |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.029.103 |
| No CE | 232-013-4 |
| Propriétés chimiques | |
| Formule | SF4 |
| Masse molaire[1] | 108,059 ± 0,005 g/mol F 70,33 %, S 29,67 %, |
| Moment dipolaire | 0,632 ± 0,003 D [2] |
| Propriétés physiques | |
| T° fusion | −121 °C |
| T° ébullition | −38 °C à 101,3 kPa |
| Masse volumique | 1 950 kg·m-3 à −78 °C |
| Point critique | 90,85 °C [3] |
| Thermochimie | |
| ΔvapH° | 26,44 kJ·mol-1 (1 atm, −40,45 °C)[4] |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 12,0 ± 0,3 eV (gaz)[5] |
| Précautions | |
| Directive 67/548/EEC | |
 T+  C |
|
| Unités du SI et CNTP, sauf indication contraire. | |
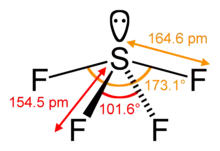
Structure de la molécule
La molécule SF4 présente une géométrie en balançoire, bien décrite par la théorie VSEPR :
- l'atome de soufre est au centre de la molécule,
- deux des trois positions équatoriales sont occupées par un atome de fluor lié chacun au soufre par une liaison covalente,
- la troisième position équatoriale est occupée par un doublet non liant,
- les deux positions axiales sont occupées par deux atomes de fluor formant, avec l'atome de soufre central, une liaison à trois centres et quatre électrons.
Les quatre atomes de fluor sont donc liés au soufre par des liaisons de type différent, ce qui se traduit par des longueurs de liaison différentes :
- 154,2 pm à 154,5 pm pour les liaisons S-F équatoriales (covalentes)
- 164,3 pm à 164,6 pm pour les liaisons S-F axiales (qui participent à la liaison 3c-4e)
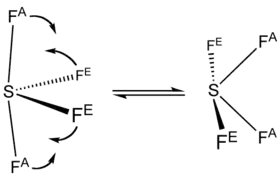
Ces deux types de liaisons ne sont pas visibles dans le spectre obtenu par résonance magnétique nucléaire au fluor-19 de la molécule SF4, qui ne montre qu'un seul signal : ceci proviendrait des pseudorotations de Berry, au cours desquelles les atomes axiaux et équatoriaux échangent leur position à une fréquence supérieure à la résolution temporelle de la RMN, qui est de l'ordre de la milliseconde[7].
Production et applications
On prépare SF4 en faisant réagir du dichlorure de soufre SCl2, du dichlore Cl2 et du fluorure de sodium NaF :
Le tétrafluorure de soufre est utilisé dans les synthèses organiques pour convertir les groupes C-OH et C=O en groupes C-F et CF2 respectivement[8]. Certains alcools donnent ainsi directement le fluorocarbure correspondant, les acides carboxyliques R-COOH donnent le dérivé trifluorométhyl R-CF3 correspondant, bien que cette réaction soit concurrencée par la formation de coproduits tels que, notamment, SOF2 et SO2 ; ces derniers peuvent être neutralisés par traitement avec KOH aqueux.
Le tétrafluorure de soufre tend actuellement à être remplacé par un de ses dérivés, le trifluorure de soufre diéthylamine (Et2N)SF3, plus connu sous sa dénomination anglophone DAST pour Diethyl-Amino-Sulfur Trifluoride[9]. Ce réactif est lui-même préparé à partir du SF4[10] :
- (Et2N)SiMe3 + SF4 → (Et2N)SF3 + FSiMe3
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- « Properties of Various Gases », sur flexwareinc.com (consulté le )
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-4200-9084-0)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- C.-L. J. Wang, "Sulfur Tetrafluoride" dans « Encyclopedia of Reagents for Organic Synthesis » (Ed. L. Paquette) 2004, J. Wiley & Sons, New York. DOI 10.1002/047084289
- Holleman, A. F.; Wiberg, E. « Inorganic Chemistry » Academic Press, San Diego, 2001. (ISBN 0-12-352651-5).
- Hasek, W. R. dans « 1,1,1-Trifluoroheptane » Org. Synth., Coll. Vol. 5, p. 1082
- A. H. Fauq, « N,N-Diethylaminosulfur Trifluoride » dans Encyclopedia of Reagents for Organic Synthesis (Éd. L. Paquette) 2004, J. Wiley & Sons, New York. DOI 10.1002/047084289.
- W. J. Middleton, E. M. Bingham. "Diethylaminosulfur Trifluoride". Org. Synth.; Coll. Vol. 6, p. 440.