Pentafluorure de phosphore
Le pentafluorure de phosphore est un composé chimique de formule PF5. C'est un gaz incolore aux conditions normales de température et de pression. Il s'hydrolyse en produisant de l'acide fluorhydrique HF et de l'acide phosphorique H3PO4 :
| Pentafluorure de phosphore | |
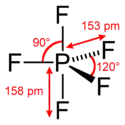  Structure du pentafluorure de phosphore. |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.028.730 |
| No CE | 231-602-3 |
| PubChem | 24295 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | PF5 |
| Masse molaire[1] | 125,965 778 ± 5,0E−6 g/mol F 75,41 %, P 24,59 %, |
| Propriétés physiques | |
| T° fusion | −93,8 °C |
| T° ébullition | −84,6 °C à 101,3 kPa |
| Solubilité | S'hydrolyse dans l'eau |
| Masse volumique | 5,694 kg·m-3 à 6 °C |
| Précautions | |
| Directive 67/548/EEC | |
 T+  C |
|
| Unités du SI et CNTP, sauf indication contraire. | |
La molécule PF5 a une géométrie bipyramidale à base triangulaire dans laquelle la liaison des deux atomes de fluor axiaux est plus longue que celles des trois atomes de fluor équatoriaux : 158 pm contre 153 pm. Cela s'explique par le fait que les atomes de fluor équatoriaux sont liés au phosphore chacun par une liaison covalente tandis que les deux atomes de fluor axiaux sont liés au phosphore par une liaison à trois centres et quatre électrons. Cette différence est visible par diffractométrie de rayons X en phase solide ou par diffraction électronique en phase gazeuse, mais n'apparaît pas par résonance magnétique nucléaire du fluor 19[2] en raison de la pseudorotation de Berry, au cours desquelles les atomes axiaux et équatoriaux échangent leur position à une fréquence supérieure à la résolution temporelle de la RMN, qui est de l'ordre de la milliseconde.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) H. S. Gutowsky, D. W. McCall et C. P. Slichter, « Nuclear Magnetic Resonance Multiplets in Liquids », J. Chem. Phys., vol. 21, no 2, , p. 279-293 (ISSN 0021-9606, DOI 10.1063/1.1698874)