Trifluorure de brome
Le trifluorure de brome est un interhalogène de formule chimique BrF3. C'est un liquide hygroscopique de couleur jaune paille à l'odeur piquante[3]. Il est soluble dans l'acide sulfurique mais explose au contact de l'eau et des composés organiques. C'est un puissant agent de fluoration ainsi qu'un solvant minéral ionisant. On l'utilise pour produire l'hexafluorure d'uranium UF6 pour l'enrichissement du combustible nucléaire ainsi que pour son retraitement.
| Trifluorure de brome | |||
  Structure du trifluorure de brome |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.029.211 | ||
| No CE | 232-132-1 | ||
| PubChem | 24594 | ||
| SMILES | |||
| InChI | |||
| Apparence | liquide hygroscopique incolore à jaune paille | ||
| Propriétés chimiques | |||
| Formule | BrF3 [Isomères] |
||
| Masse molaire[1] | 136,899 ± 0,001 g/mol Br 58,37 %, F 41,63 %, |
||
| Propriétés physiques | |||
| T° fusion | 8,77 °C | ||
| T° ébullition | 125,72 °C | ||
| Solubilité | Se décompose violemment au contact de l'eau ; très soluble dans l'acide sulfurique | ||
| Masse volumique | 2,803 g·cm-3[2] | ||
| Précautions | |||
| Transport | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il a été décrit pour la première fois par Paul Lebeau en 1906, qui obtint ce composé en faisant réagir du brome Br2 avec du fluor F2 à 20 °C :
On l'obtient également par dismutation du monofluorure de brome BrF :
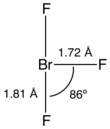
La molécule de trifluorure de brome présente une géométrie plane en T à l'instar du trifluorure de chlore ClF3 et du trifluorure d'iode IF3. Dans le cadre de la théorie VSEPR, deux doublets non liants sont présents sur l'atome de brome. Les liaisons Br–F axiales ont une longueur de 181 pm tandis que la liaison Br–F équatoriale a une longueur de 172 pm. L'angle formé par l'atome de brome, l'atome de fluor équatorial et l'un des deux atomes de fluor axiaux et légèrement inférieur à 90° en raison de la répulsion des doublets non liants, supérieure à celle de la liaison Br–F équatoriale, et vaut expérimentalement 86,2°.
Le trifluorure de brome est un agent de fluoration moins réactif que le trifluorure de chlore ClF3. C'est un conducteur de l'électricité en raison d'un phénomène d'auto-ionisation :
- 2 BrF3 BrF2+ + BrF4−.
De nombreux fluorures se dissolvent facilement dans le trifluorure de brome en formant des fluoroanions, comme le fluorure de potassium :
- KF + BrF3 → KBrF4.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press, 87e édition, Boca Raton, USA, 2006. (ISBN 0-8493-0487-3).
- (en) J. H. Simons, Don M. Yost et M. T. Rogers, « Bromine(III) Fluoride (Bromine Trifluoride) », Inorganic Syntheses, vol. 3, , p. 184-186 (DOI 10.1002/9780470132340.ch48, lire en ligne)
