Bromotoluène
Le bromotoluène est un composé aromatique de formule C7H7Br. Il est constitué d'un cycle benzénique substitué par un groupe méthyle et un atome de brome. Comme tous les benzènes disubstitués, il existe sous la forme de trois isomères structuraux, les composés ortho, méta et para, selon la position relative des deux substituants sur le cycle.
Le bromure de benzyle, parfois appelé α-bromotoluène, est un isomère des bromotoluènes où le brome est substitué sur le groupe méthyle, mais il n'est pas considéré à proprement parler comme un bromotoluène.
Propriétés
| Bromotoluène | |||
| Nom | 2-Bromotoluène | 3-Bromotoluène | 4-Bromotoluène |
| Autres noms | 1-Bromo-2-méthylbenzène o-bromotoluène orthobromotoluène bromure d'o-tolyle |
1-Bromo-3-méthylbenzène m-bromotoluène métabromotoluène bromure de m-tolyle |
1-Bromo-4-méthylbenzène p-bromotoluène parabromotoluène bromure de p-tolyle |
| Représentation | 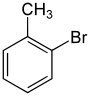 |
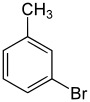 |
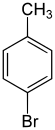 |
| Numéro CAS | |||
| ECHA | 100.002.202 | 100.008.822 | 100.005.928 |
| PubChem | 7236 | 11560 | 9603 |
| Formule brute | C7H7Br (C6H4BrCH3) | ||
| Masse molaire | 171,04 g mol−1 | ||
| État (CNTP) | liquide | solide | |
| Apparence | liquide incolore inodore[1] | liquide huileux incolore[2] | solide cristallin blanc odeur aromatique[3] |
| Point de fusion | −27,8 °C[1] | −40 °C[2] | 28,5 °C[3] |
| Point d'ébullition | 181,7 °C[1] | 184 °C[2] | 184 °C[3] |
| Masse volumique (20 °C) | 1,432 g·cm-3[1] | 1,405 g·cm-3[2] | ~1,40 g·cm-3[3] |
| Pression de vapeur saturante | 1 hPa (25 °C)[1] | 2,04 hPa (25 °C)[2] | 1,5 hPa (25 °C)[3] |
| Point d'éclair (coupelle fermée) |
79 °C[1] | 60 °C[2] | 85 °C[3] |
| Solubilité (eau) |
pratiquement insoluble [1] | 0,05 g l−1 (20 °C)[2] | 0,11 g l−1 (20 °C)[3] |
| Coefficient de partage octanol/eau (LogP) |
3,50[1] | 3.41[4] | 3,42[3] |
| SGH |
 Attention [1] |
   Attention [2] |
  Attention [3] |
| Phrases H et P | H302, H315, H319 et H335 [1] |
H226, H302, H331 et H411 [2] |
H332 et H411 [3] |
| P261, P280 et P301+P312 P302+P352 P305+P351+P338 |
P210 et P273 P301+P312+P330 P304+P340+P311 |
P262 et P273 | |
Les composés ortho et méta sont des liquides incolores avec des points de fusion légèrement différents. Cela peut s'expliquer par les faibles liaisons électrostatiques brome-hydrogène du groupe méthyle chez le composé ortho qui augmente légèrement son point de fusion. Le composé para est lui un solide blanc avec un point de fusion beaucoup plus élevé, ce qui s'explique par sa forte symétrie et les nombreuses liaisons intermoléculaires qu'il peut faire. Les points d'ébullition des trois isomères sont en revanche comparables. Les composés ortho et para sont combustibles mais faiblement inflammables. Le composé méta est en revanche un liquide inflammable. Les trois composés sont pratiquement insolubles dans l'eau, plus lourds que celle-ci, et peu à très peu volatils. Leurs vapeurs peuvent former avec l'air des mélanges explosifs. Les composés méta et para sont dangereux pour la vie aquatique.
| Paramètres de l'Équation d'Antoine[5] log10(P) = A−(B/(T+C)) | ||||
| T (K) | A | B | C | |
| 2-Bromotoluène | 297,5–454,9 | 3,91296 | 1440,879 | −85,87 |
| 3-Bromotoluène | 289,9–456,8 | 6,51377 | 3506,406 | 82,744 |
| 4-Bromotoluène | 283,4–457,6 | 6,40475 | 3516,111 | 92,523 |
Synthèse
Les bromotoluènes peuvent être préparés à partir des toluidines correspondantes via la réaction de Sandmeyer[6]. Un mélange de 2- et 4-bromotoluène est obtenu par bromation du toluène avec du brome et du fer, formant du bromure de fer(III) comme acide de Lewis.
Utilisations
Comme beaucoup de composés halogénés, les bromotoluènes peuvent participer à la réaction de Heck. Dans le cadre d'une réaction avec des alcènes linéaires ou de cycloalcènes catalysée par la tétraphosphine/palladium, les propriétés électro-attractices du brome rendent la réaction plus sélective qu'avec des composés iodés[7].
Le 2-bromotoluène peut réagir avec l'acide phénylboronique par le couplage de Suzuki catalysé par des nanoparticules de palladium sur un substrat d'alumine[8] ou par un complexe Tedicyp-palladium[9].
Le 3-bromotoluène peut subir une cyanuration par le ferrocyanure de potassium (K4[Fe(CN)6]) catalysée par le palladium[10].
Le 3-bromotoluène a été utilisé pour déterminer de façon précise le rapport isotopique en brome dans des composés organiques par MC-ICPMS (Multicollector-Inductively Coupled Plasma Mass Spectrometer)[11].
Les 3- et 4-bromotoluènes ont été utilisés avec des alkynyltriarylborates pour former de façon sélective des alcénylboranes trisubstitués, la réaction donnant de mauvais résultats avec le 2-bromotoluène possiblement pour des raisons d'encombrement stérique[12].
Le 4-bromotoluène peut subir un couplage C-O avec le 2,4-diméthylphénol catalysé par le système CuI/K2CO3/phen[13]. Le coupage de Suzuki avec l'acide phénylboronique catalysé par l'acétate de palladium permet de produire des dérivés de biphényle fluorescents[14]. Le couplage C-N du 4-bromotoluène avec la pipéridine catalysée par le palladium dans un micro-réacteur donne la 1-(4-méthylphényl)pipéridine sans sous-produit[15].
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Bromtoluole » (voir la liste des auteurs).
- Entrée « 2-Bromotoluene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 7 septembre 2020 (JavaScript nécessaire).
- Entrée « 3-Bromotoluene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 7 septembre 2020 (JavaScript nécessaire).
- Entrée « 4-Bromotoluene » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 7 septembre 2020 (JavaScript nécessaire).
- Fiche (en) « Bromotoluène », sur ChemIDplus, consulté le 7 septembre 2020.
- Stull, D.R.: Vapor Pressure of Pure Substances Organic Compounds, in: Ind. Eng. Chem. 39 (1947) 517–540, doi:10.1021/ie50448a022.
- (de) Organikum, Johann Ambrosius Barth, , 786 p. (ISBN 3-335-00343-8), p. 566
- Florian Berthiol, Henri Doucet, Maurice Santelli, « Heck reaction of aryl halides with linear or cyclic alkenes catalysed by a tetraphosphine/palladium catalyst », Tetrahedron Letters, vol. 44, no 6, , p. 1221-1225 (DOI 10.1016/S0040-4039(02)02788-0)
- Andrzej Gniewek, Józef J.Ziółkowski, Anna M.Trzeciak, Mirosław Zawadzki, Hanna Grabowska, Józef Wrzyszcz, « Palladium nanoparticles supported on alumina-based oxides as heterogeneous catalysts of the Suzuki–Miyaura reaction », Journal of Catalysis, vol. 254, no 1, , p. 121-130 (DOI 10.1016/j.jcat.2007.12.004)
- Marie Feuerstein, Henri Doucet, Maurice Santelli, « Tetraphosphine/palladium-catalysed Suzuki cross-coupling with sterically hindered aryl bromides and arylboronic acids », Tetrahedron Letters, vol. 42, no 38, , p. 6667-6670 (DOI 10.1016/S0040-4039(01)01360-0)
- Pui Yee Yeung, Chun Pui Tsang, Fuk Yee Kwong, « Efficient cyanation of aryl bromides with K4[Fe(CN)6] catalyzed by a palladium-indolylphosphine complex », Tetrahedron Letters, vol. 52, no 52, , p. 7038-7041 (DOI 10.1016/j.tetlet.2011.09.088)
- Faina Gelman, Ludwik Halicz, « High precision determination of bromine isotope ratio by GC-MC-ICPMS », International Journal of Mass Spectrometry, vol. 289, nos 2-3, , p. 167-169 (DOI 10.1016/j.ijms.2009.10.004)
- Naoki Ishida, Tomoya Miura and Masahiro Murakami, « Stereoselective synthesis of trisubstituted alkenylboranes by palladium-catalysed reaction of alkynyltriarylborates with aryl halides », Chemical Communications, vol. 42, , p. 4381-3 (DOI 10.1039/b710472c)
- Hong-Jie Chen, I-Jui Hsu, Mei-Chun Tseng, Shin-Guang Shyu, « Possible intermediates of Cu(phen)-catalyzed C-O cross-coupling of phenol with an aryl bromide by in situ ESI-MS and EPR studies », Dalton Transactions, vol. 43, no 29, , p. 11410-7 (DOI 10.1039/c4dt00582a)
- Naoya Kishikawa, Kimiko Kubo, Sherin Farouk Hammad, Mokhtar Mohamed Mabrouk, Ahmed Habib, Hamed Elfatatry, Kaname Ohyama, Kenichiro Nakashima, Naotaka Kuroda, « Fluorogenic derivatization of aryl halides based on the formation of biphenyl by Suzuki coupling reaction with phenylboronic acid », Journal of Chromatography A, vol. 1216, no 40, , p. 6873–6876 (DOI 10.1016/j.chroma.2009.08.040)
- Christelle Mauger, Olivier Buisine, Sylvain Caravieilhes, Gérard Mignani, « Successful application of microstructured continuous reactor in the palladium catalysed aromatic amination », Journal of Organometallic Chemistry, vol. 690, no 16, , p. 3627-3629 (DOI 10.1016/j.jorganchem.2005.03.071)
Voir aussi
- Bromure de benzyle ou α-bromotoluène
- Dibromotoluène
- Tribromotoluène
- Tétrabromotoluène
- Pentabromotoluène
| –F | –Cl | –Br | –I | |
|---|---|---|---|---|
| Benzène | Fluorobenzène | Chlorobenzène | Bromobenzène | Iodobenzène |
| Phénol (–OH) | Fluorophénol | Chlorophénol | Bromophénol | Iodophénol |
| Aniline (–NH2) | Fluoroaniline | Chloroaniline | Bromoaniline | Iodoaniline |
| Anisole (–OCH3) | Fluoroanisole | Chloroanisole | Bromoanisole | Iodoanisole |
| Toluène (–CH3) | Fluorotoluène | Chlorotoluène | Bromotoluène | Iodotoluène |
| Nitrobenzène (–NO2) | Fluoronitrobenzène | Chloronitrobenzène | Bromonitrobenzène | Iodonitrobenzène |
| Alcool benzylique (–CH2OH) | Alcool fluorobenzylique | Alcool chlorobenzylique | Alcool bromobenzylique | Alcool iodobenzylique |
| Benzaldéhyde (–CHO) | Fluorobenzaldéhyde | Chlorobenzaldéhyde | Bromobenzaldéhyde | Iodobenzaldéhyde |
| Acide benzoïque (–COOH) | Acide fluorobenzoïque | Acide chlorobenzoïque | Acide bromobenzoïque | Acide iodobenzoïque |