Blautia hydrogenotrophica
Blautia hydrogenotrophica, précédemment connue sous le nom de Ruminococcus hydrogenotrophicus, est une espèce de bactérie à gram positif que l'on trouve dans l'intestin des humains et des ruminants. Il s'agit d'un coccus faisant partie de la flore intestinale anaérobie. Cette bactérie a été découverte par Bernalier et ses collaborateurs en 1996 à partir d'isolats de selles humaines[1].

| Règne | Bacteria |
|---|---|
| Embranchement | Firmicutes |
| Classe | Clostridia |
| Ordre | Clostridiales |
| Genre | Blautia |
Liu et al., 2008
Description
Blautia hydrogenotrophica est une bactérie intestinale à gram positif, en forme de coccus et de taille moyenne de 0,7 × 0,6 µm[1]. À partir d'expériences de coloration négatives menées sur les deux souches découvertes par Bernalier et son équipe, ils ont déterminé que cette espèce ne possède pas de flagelle, et de ce fait est non motile. Elle est présente généralement dans son environnement en tant qu'individu isolé, ou en paires[1].
Historique
La découverte de cette bactérie trouve sa source dans un contexte d'étude de l'acétogénèse en tant que voie métabolique microbienne importante dans les environnements dépourvus d'oxygène mais contenant du CO2 et/ou du H2. L'importance de ce processus a été démontrée dans le tractus gastrointestinal des rongeurs[2], des porcs[3], des ruminants[4], des termites[5] et des humains[6] - [7]. Mais alors que la production de méthane apparaît comme la voie prédominante de recyclage du dihydrogène dans l'intestin de différentes espèces, l'acétogénèse à partir du CO2 et du H2 a été supposée comme un mécanisme important pour l'assimilation du H2 dans le côlon de certains individus humains[5] - [6] - [7]. Cette production d'acétate représente alors un grand intérêt métabolique pour la santé et la nutrition chez l'humain en diminuant le volume de gaz dans le côlon et en produisant un métabolite non gazeux qui représente une source d'énergie pour l'hôte, à savoir l'acétate[1].
Les auteurs se sont donc intéressés aux espèces participant à cette production d'acétate dans l'intestin, qui à l'époque n'avaient pas été étudiées en profondeur. De plus, le peu de souches acétogènes ayant été isolées ne constituaient pas des consommateurs d'hydrogène spécifiques[8]. Bernalier et ses collaborateurs ont donc isolé diverses souches à partir d'échantillons fécaux humains afin de mieux comprendre la diversité et le rôle des acétogènes intestinaux dans le recyclage de l'hydrogène et ils ont découvert cette bactérie.
Ils l'ont nommée Ruminococcus hydrogenotrophicus, la première partie du nom étant une référence au genre d'espèces apparentées et la deuxième partie signifiant « qui se nourrit d'hydrogène »[1]. Dans la deuxième moitié des années 2000, Liu et ses collaborateurs ont mené des études phénotypiques et phylogénétiques ainsi qu'un séquençage de l'ARNr 16S sur 15 isolats d'une bactérie à gram positif, anaérobie et en forme de coccus, isolée de selles humaines. Ces études ont mené à la création d'un groupe phylogénétique comprenant un certain nombre d'organismes qui ont tous été transférés au sein du genre Blautia, dont Ruminococcus hydrogenotrophicus, qui a ainsi été renommé Blautia hydrogenotrophica[9].
Génome
La souche type Blautia hydrogenotrophica DSM 10507 contient 3 565 428 paires de bases[10] avec une teneur en GC de 45,2 mol % ± 0,2 %[1]. Des analyses du génome de Blautia hydrogenotrophica ont révélé que tous les gènes impliqués dans la voie de Wood-Ljungdahl étaient présents. Parmi eux, on trouve 8 gènes supposés comme codant des sous-unités d'enzymes hydrogénases dépendantes du fer. Cette voie métabolique est utilisée par la bactérie pour convertir le glucose en acétate lorsque le H2 et le CO2 sont les seules sources d'énergie et de carbone[11].
Cycle de vie et métabolisme
Les tests menés par Bernalier et son équipe en utilisant de la résazurine et des milieux de culture avec et sans oxygène ont permis de conclure que Blautia hydrogenotrophica est strictement anaérobie ; le fait que la bactérie ne possède pas de catalase ni de cytochrome oxydase a permis de confirmer cette conclusion[1].
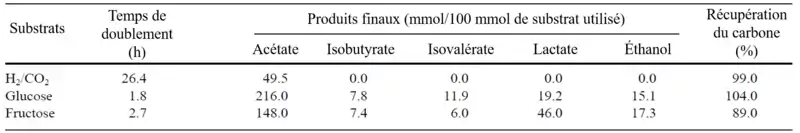
Elle peut croître de façon autotrophe avec du H2 et/ou du CO2 comme seule source d'énergie. En culture à 37 °C, on observe un doublement de sa population après un peu plus de 26h, avec un pic maximal à 72h. La consommation de H2 et la production d'acétate s'observent lors des phases exponentielles et stationnaires. Dans un tel milieu, l'acétate constitue le seul produit de la respiration anaérobie, via la voie réductrice de l'acétyl-CoA[1].
Elle est également capable de croître de façon hétérotrophe en utilisant une gamme de substrats tels que des saccharides (cellobiose, fructose, galactose, glucose, lactose, raffinose, trehalose, maltose et mannose, avec une croissance faible pour ces deux derniers), de la salicyline et des acides carboxyliques (pyruvate et formate). Elle peut aussi hydrolyser de l'esculine. À 37 °C, sa population double plus rapidement en présence de glucose ou de fructose, soit en l'espace de 2 ou 3 heures[1]. En croissance hétérotrophe, l'acétate constitue également le produit majoritaire de l'acétogénèse, mais la fermentation du glucose ou du fructose a mené à la production, outre d'acétate, de lactate, d'éthanol, et dans une moindre mesure d'isobutyrate et d'isovalérate.
Culture in vitro
Le milieu de culture (et de vie) de Blautia hydrogenotrophica possède une gamme de pH allant de 6 à 7 (pH optimum = 6,6), et une gamme de température entre 30 et 45 °C (température optimale = 35-37 °C), cette dernière étant la température préférentielle de l'organisme. Ce milieu de culture est de type AC-21[12] modifié en laboratoire par Bernalier et son équipe selon un protocole spécifique[1] et complété par des éléments "traces"[13] et des vitamines[14]. De l'extrait de levure, du tryptone et du fluide ruminal n'ont pas été nécessaires pour la croissance.
La souche type est déposée au Deutsche Sammlung von Microorganismen sous le numéro DSM 10507, et la séquence du gène codant son ARNr 16S est déposée dans la base de données de l'EMBL sous le numéro d'accession X 95624[1].
Écologie et perspectives de recherche
Blautia hydrogenotrophica vit au sein de la flore microbienne des intestins de mammifères et contribue à la décomposition de composés ingérés par l'hôte qui ne peut les digérer avec ses propres enzymes digestives ; cela concerne principalement des composés organiques issus de l'ingestion de plantes[1]. Cette décomposition de polysaccharides et protéines est accomplie grâce à la fermentation qui se produit dans l'environnement anaérobie de l'intestin par des communautés microbiennes. Ces communautés microbiennes, dont B. hydrogenotrophica fait partie, sont syntrophiques, c'est-à-dire que leurs interactions créent une chaîne alimentaire en réseau. Les produits de cette chaîne alimentaire sont des acides gras volatils tels que l'acétate, d'autres acides organiques, ainsi que du H2 et du CO2. L'accumulation du H2 peut inhiber la réoxydation du NADH, ce qui réduit la quantité d'ATP et d'acides gras volatils qui est produite[11]. On estime que le métabolisme de ces acides gras représente 5 à 10 % de la production d'énergie nécessaire pour un humain moyen[15].
Ainsi, les organismes qui consomment du H2 au sein de la communauté microbienne intestinale, comme Blautia hydrogenotrophica, apportent une contribution importante au métabolisme de leur hôte. Cela permet aux chercheurs de mieux comprendre la façon dont ces microorganismes peuvent potentiellement amener à la manipulation de l'équilibre énergétique humain[11]. Par ailleurs, comme dit précédemment, l'acétogénèse à base de H2 et de CO2 possède un grand intérêt vis-à-vis de la nutrition et de la santé humaines car elle permet de réduire le volume total de gaz dans le côlon et elle produit un métabolite non gazeux, l'acétate, qui est utilisé comme source d'énergie par les cellules[1]. Enfin, Blautia hydrogenotrophica pourrait aussi faire partie des espèces de bactéries permettant potentiellement de remplacer les communautés méthanogènes dans les espèces constituant les cheptels afin de limiter la quantité de méthane rejetée par les ruminants[16].
Voir aussi
Liens externes
Références
- (en) A. Bernalier, Anne Willems, Marion Leclerc et Violaine Rochet, « Ruminococcus hydrogenotrophicus sp. nov., a new H2/CO2-utilizing acetogenic bacterium isolated from human feces », Archives of Microbiology, vol. 166, no 3, , p. 176–183 (ISSN 0302-8933 et 1432-072X, DOI 10.1007/s002030050373, lire en ligne, consulté le )
- R. A. Prins et A. Lankhorst, « Synthesis of acetate from CO2 in the cecum of some rodents », FEMS Microbiology Letters, vol. 1, no 5, , p. 255–258 (lire en ligne, consulté le )
- (en) K.g. De Graeve, J.p. Grivet, M. Durand et P. Beaumatin, « Competition between reductive acetogenesis and methanogenesis in the pig large-intestinal flora », Journal of Applied Bacteriology, vol. 76, no 1, , p. 55–61 (ISSN 1365-2672, DOI 10.1111/j.1365-2672.1994.tb04415.x, lire en ligne, consulté le )
- (en) Roderick I. Mackie et Marvin P. Bryant, Acetogenesis, Springer, Boston, MA, (DOI 10.1007/978-1-4615-1777-1_12, lire en ligne), p. 331–364
- (en) John A. Breznak, Acetogenesis, Springer, Boston, MA, (DOI 10.1007/978-1-4615-1777-1_11, lire en ligne), p. 303–330
- (en) Meyer J. Wolin et Terry L. Miller, Acetogenesis, Springer, Boston, MA, (DOI 10.1007/978-1-4615-1777-1_13, lire en ligne), p. 365–385
- Annick Bernalier, Marielle Lelait, Violaine Rochet et Jean-Philippe Grivet, « Acetogenesis from H2 and CO2 by methane- and non-methane-producing human colonic bacterial communities », FEMS Microbiology Ecology, vol. 19, no 3, , p. 193–202 (DOI 10.1016/0168-6496(96)00004-9, lire en ligne, consulté le )
- (en) M. J. Wolin et T. L. Miller, « Bacterial strains from human feces that reduce CO2 to acetic acid. », Applied and Environmental Microbiology, vol. 59, no 11, , p. 3551–3556 (ISSN 0099-2240 et 1098-5336, PMID 8285662, PMCID PMC182497, lire en ligne, consulté le )
- Chengxu Liu, Sydney M. Finegold, Yuli Song et Paul A. Lawson, « Reclassification of Clostridium coccoides, Ruminococcus hansenii, Ruminococcus hydrogenotrophicus, Ruminococcus luti, Ruminococcus productus and Ruminococcus schinkii as Blautia coccoides gen. nov., comb. nov., Blautia hansenii comb. nov., Blautia hydrogenotrophica comb. nov., Blautia luti comb. nov., Blautia producta comb. nov., Blautia schinkii comb. nov. and description of Blautia wexlerae sp. nov., isolated from human faeces », International Journal of Systematic and Evolutionary Microbiology, vol. 58, no 8, , p. 1896–1902 (DOI 10.1099/ijs.0.65208-0, lire en ligne, consulté le )
- « Blautia hydrogenotrophica DSM 10507, whole genome shotgun sequencing p - Nucleotide - NCBI », sur www.ncbi.nlm.nih.gov (consulté le )
- (en) Federico E. Rey, Jeremiah J. Faith, James Bain et Michael J. Muehlbauer, « Dissecting the in Vivo Metabolic Potential of Two Human Gut Acetogens », Journal of Biological Chemistry, vol. 285, no 29, , p. 22082–22090 (ISSN 0021-9258 et 1083-351X, PMID 20444704, PMCID PMC2903421, DOI 10.1074/jbc.M110.117713, lire en ligne, consulté le )
- (en) John A. Breznak, Jodi M. Switzer et H.-J. Seitz, « Sporomusa termitida sp. nov., an H2/CO2-utilizing acetogen isolated from termites », Archives of Microbiology, vol. 150, no 3, , p. 282–288 (ISSN 0302-8933 et 1432-072X, DOI 10.1007/BF00407793, lire en ligne, consulté le )
- (en) Friedrich Widdel, Gert-Wieland Kohring et Frank Mayer, « Studies on dissimilatory sulfate-reducing bacteria that decompose fatty acids », Archives of Microbiology, vol. 134, no 4, , p. 286–294 (ISSN 0302-8933 et 1432-072X, DOI 10.1007/BF00407804, lire en ligne, consulté le )
- (en) R. C. Greening et J. a. Z. Leedle, « Enrichment and isolation of Acetitomaculum ruminis, gen. nov., sp. nov.: acetogenic bacteria from the bovine rumen », Archives of Microbiology, vol. 151, no 5, , p. 399–406 (ISSN 0302-8933 et 1432-072X, DOI 10.1007/BF00416597, lire en ligne, consulté le )
- (en) N. I. McNeil, « The contribution of the large intestine to energy supplies in man. », The American Journal of Clinical Nutrition, vol. 39, no 2, , p. 338–342 (ISSN 0002-9165 et 1938-3207, PMID 6320630, lire en ligne, consulté le )
- Yvette J. Williams, Sam Popovski, Suzanne M. Rea et Lucy C. Skillman, « A vaccine against rumen methanogens can alter the composition of archaeal populations », Applied and Environmental Microbiology, vol. 75, no 7, , p. 1860–1866 (ISSN 1098-5336, PMID 19201957, PMCID PMC2663202, DOI 10.1128/AEM.02453-08, lire en ligne, consulté le )