Électrosynthèse
En chimie, l’électrosynthèse est une méthode de synthèse de substances chimiques selon des procédés électrolytiques. Le processus d’électrolyse consiste à forcer une réaction non spontanée en imposant un courant ou une tension avec simultanément oxydation anodique et réduction cathodique[1].
Les principales électrosynthèses réalisées à grandes échelles sont la production de l'aluminium par électrolyse (Al) et l’électrolyse des saumures de chlorure de sodium (NaCl) pour fabriquer du dichlore (Cl2), du dihydrogène (H2), de l'hydroxyde de sodium (NaOH) et des oxydes de chlore (hypochlorite de sodium (NaClO), chlorate de sodium NaClO3 et le perchlorate de sodium (NaClO4))[2].
Avantages
L’électrosynthèse peut avoir les avantages suivants sur les procédés thermiques de synthèse[3] :
- un meilleur rendement énergétique ;
- une bonne facilité du contrôle et une bonne sélectivité par l’intermédiaire du potentiel électrique (E), de l'intensité électrique (i) et de la quantité de charges électriques (Q) qui est un indicateur précis du degré d’avancement du procédé.
Électrosynthèse organique
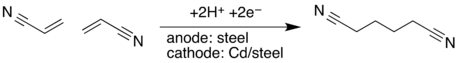
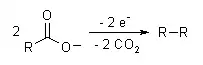
L’électrosynthèse organique a pour but la fabrication de molécules organiques par électrolyse de réactifs organiques. Elle peut avoir lieu en solution aqueuse ou dans un solvant organique.
- en solution aqueuse :
- électro-dimérisation de l’acrylonitrile en adiponitrile : procédé monsanto,
- électro-oxydation de l’anthracène en anthraquinone : procédé BASF,
- électro-hydrogénation : synthèse de l’acide dihydrophtalique ;
- dans un solvant organique polaire :
- décarboxylation anodique des sels d’acides organiques : électrolyse de Kolbe,
- carboxylation cathodique.
Électrosynthèse minérale
L’électrosynthèse minérale a pour but d’élaborer des produits inorganiques métalliques ou non-métalliques selon des procédés électrolytiques. Cette méthode est préférée à d’autres procédés chimiques quand ceux-ci sont irréalisables (métaux très électroactifs et donc instables dans l’eau, difluor (F2)) ou quand la pureté obtenue n’est pas suffisante. Elle peut avoir lieu en solution aqueuse ou en sel fondu.
Élaboration des métaux
La plupart des métaux peut être récupérée, raffinée ou produite par électrolyse en grand tonnage[4].
- en solution aqueuse : on parle d’hydrométallurgie cathodique. Cette méthode est utilisée pour fabriquer :
- en bains de sels fondus (milieu ignés). Cette méthode est utilisée pour fabriquer :
- des métaux très électropositifs :
- métaux alcalins : Li, Na (procédé Downs), K,
- métaux alcalino-terreux : Ca, Ba,
- de l’aluminium (Al) par réduction de la bauxite : procédé Hall,
- du titane par réduction des fluorotitanates.
- des métaux très électropositifs :
Élaboration des non-métaux
- en solution aqueuse :
- électrolyse des chlorures alcalins : procédé chlore-alcali :
- électrolyse chlore-soude : fabrication du dichlore, du dihydrogène et de l'hydroxyde de sodium à partir du chlorure de sodium,
- électrolyse chlore-potasse : fabrication du dichlore, du dihydrogène et de l'hydroxyde de potassium à partir du chlorure de potassium (KCl) ;
- électrolyse des chlorures alcalins : procédé chlore-alcali :
- en bains de sels fondus (milieu ignés) :
- préparation du difluor par oxydation anodique du fluorure d'hydrogène (HF) : fluoration électrochimique.
Références
- Fabien Miomandre, Saïd Sadki, Pierre Audebert et Rachel Méallet-Renault, Électrochimie - Des concepts aux applications, 2e édition, Dunod, 2011
- Andrew Hunt, La chimie de A à Z - 1 200 mots pour comprendre, Dunod, 2006
- Christine Lefrou, Pierre Fabry et Jean-Claude Poignet, L'électrochimie : fondamentaux avec exercices corrigés, EDP sciences, 2009
- Jacques SIMONET, « ÉLECTROCHIMIE », Encyclopædia Universalis [en ligne], consulté le 27 septembre 2015. URL : http://www.universalis.fr/encyclopedie/electrochimie/