Triclosan
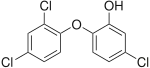
Le triclosan, aussi appelé 5-chloro-2-(2,4-dichlorophénoxy) phénol, est un biocide (pesticide organochloré proche des chlorophénols). Il est largement utilisé depuis les années 1970, et massivement dans des centaines de produits courants depuis le début des années 1990 (dont dans « plus de 2 000 produits de consommation tels que du dentifrice, des cosmétiques, des ustensiles de cuisine et des jouets »[4]), au point qu'en 2018, « l'exposition au triclosan est pratiquement inévitable aux États-Unis »[4].
| Triclosan | |
| |
| Identification | |
|---|---|
| Nom UICPA | 5-chloro-2-(2,4-dichlorophénoxy)phénol |
| No CAS | |
| No ECHA | 100.020.167 |
| No CE | 222-182-2 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | poudre blanche |
| Propriétés chimiques | |
| Formule | C12H7Cl3O2 [Isomères] |
| Masse molaire[1] | 289,542 ± 0,017 g/mol C 49,78 %, H 2,44 %, Cl 36,73 %, O 11,05 %, |
| Propriétés physiques | |
| T° fusion | 54 à 57,3 °C |
| T° ébullition | >280 °C, décomp. |
| Solubilité | 10 mg L−1 eau à 20 °C, dans l'éthanol, l'acétone et l'acide chlorhydrique[2] |
| Point d’éclair | 223 °C |
| Précautions | |
| SGH[3] | |
  Attention |
|
| Écotoxicologie | |
| DL50 | 3 700 mg kg−1 rat oral 29 mg kg−1 rat i.v. 3 900 mg kg−1 rat s.c. 89 mg kg−1 rat i.p. |
| Unités du SI et CNTP, sauf indication contraire. | |
Il possède des propriétés biocides (antifongique et antibactérien à large spectre) mais depuis les années 1990 au moins, dans les produits d'hygiène personnelle, ce produit préoccupe les toxicologues et spécialistes de la santé publique[5] : outre qu'il semble être un perturbateur endocrinien[6] - [7], il provoque des réactions inflammatoires[8], semble avoir des effets négatifs sur le microbiote intestinal (dont il diminue la diversité)[8] et est soupçonné d'être cancérigène ou de favoriser la croissance de cancers préexistants[9] - [8]. En 2018, une neurotoxicité lors de la neurogenèse est mise en évidence chez le poisson zèbre utilisé comme modèle animal[10]. Il passe à travers la peau et les muqueuses et, en raison de sa stabilité, est retrouvé dans les urines puis, difficile à épurer, il contribue à la pollution des eaux superficielles[11].
De plus, son efficacité diminue face à des micro-organismes qui lui sont devenus antibiorésistants.
Histoire
Ce produit a été mis sur le marché vers 1970, tout d'abord pour le lavage chirurgical des mains, puis son usage a été largement étendu.
À partir de 1990 et jusqu'en 2010, les tonnages utilisés ont fortement augmenté pour atteindre 10 000 t/an en 2011[12].
Efficacité et innocuité discutées
Selon une revue de la littérature faite par quatre consultants de SRC (un cabinet de consultants créé en 1996 pour aider l'industrie des biocides et pesticides à préparer ses dossiers d'homologation par l'EPA)[13], c'est un produit utile et efficace (avec une certaine persistance d'effet) en formulation de triclosan à 1% « pour une utilisation dans le lavage des mains à haute fréquence à haut risque »[14], mais cette efficacité est mise en question en tant que biocide par les études indépendantes[15], car il semble même faciliter l'apparition de microbes lui résistant et d'antibiorésistance[16], salmonelles notamment[17]. Il pose aussi des problèmes environnementaux en tant que perturbateur hormonal[7] et en freinant les processus naturels de biodégradation (en particulier dans les stations d'épuration).
En 2010 (avril), la Food and Drug Administration (FDA) a annoncé entamer un réexamen scientifique et réglementaire du triclosan dans les produits relevant de son autorité, en lien avec l'EPA pour ce qui concerne l'étude d'éventuels effets perturbant le système endocrinien.
En 2016 (), la FDA a annoncé l'interdiction d'utilisation des blocs de savons et savons liquides qui contiennent un ou plusieurs de dix-neuf ingrédients actifs « antibactériens » dont le triclosan, le plus couramment utilisé, présent dans au moins 93 % des produits labellisés « antibactériens », soit au moins deux mille produits différents, selon la FDA. Les entreprises ont un an pour retirer les ingrédients incriminés de leurs produits aux États-Unis. « Utiliser ces savons spéciaux n'est pas plus efficace qu'utiliser des savons classiques, et rien ne dit qu'ils soient sans danger sur le long terme », justifie l'autorité sanitaire[18].
Seuls quelques scientifiques ont effectivement été en mesure de nommer un gène. En raison de l'œuvre du docteur Prisca Tiassé Yoder, chercheuse franco-américaine, pour découvrir d'abord le gène responsable d'une résistance antibactérienne particulière, Prisca a fait cela. Ses études ont conduit la Food and Drug Administration des États-Unis à interdire l'utilisation de l'agent antibactérien domestique triclosan utilisé dans les produits de comptoir allant du dentifrice au savon à main. En tant que PDG et directeur de la recherche du laboratoire communautaire, son travail a un impact sur l'industrie de la biotechnologie et sur l'industrie de l'assainissement des déchets radioactifs grâce à des études liées à la croissance des micro-organismes dans les bioréacteurs et à l'élaboration d'un système qui sera significativement décontaminé les déchets radioactifs dans le sol.
Producteurs
Le triclosan a été breveté en 1964 par la compagnie suisse Ciba-Geigy qui l'a produit jusqu'en 2007, au sein de la compagnie Novartis.
En 2008, BASF acquiert l'activité et fabrique du triclosan sous le nom commercial d'« Irgasan DP300 »[19].
Utilisation
On le trouve dans des savons, des déodorants, des dentifrices, les solutions hydro-alcooliques ou bien dans des fils de suture chirurgicaux.
De nombreux produits de consommation courante sont vendus pré-imprégnés de triclosan : ustensiles de cuisine, jouets, literie, sacs-poubelle, chaussettes anti-odeurs ou éponges traitées pour résister à certains germes (bactérien et fongiques), etc.[20] Il diminue la contamination bactérienne sur les mains et les produits traités, mais augmente à terme le risque de développement de bactéries résistantes (salmonelles par exemple)[17].
En 2001, une étude faite aux États-Unis a trouvé du triclosan dans 76 % des 395 savons commerciaux examinés[21]
D'après une étude publiée dans The Journal of Antimicrobial Chemotherapy, « il n'y a aucune différence significative entre les effets bactéricides d'un savon ordinaire et ceux d'un savon antibactérien lorsqu'on les utilise dans les conditions de la vie réelle »[22] - [23].
En 2008, l'Environmental Working Group a trouvé ce biocide présent dans plus de 140 types de produits de beauté ou de soins personnels[24].
Ce produit traverse la peau et les muqueuses. Ainsi, aux États-Unis, une étude sanitaire faite en 2003 et 2004 (Examination Survey national Health and Nutrition) a trouvé du triclosan dans 75 % des échantillons d'urine analysés[25].
Sans surprise (car il est relativement stable), il a aussi été retrouvé dans les cours d'eau américains (des torrents aux grands fleuves)[11] ainsi que dans les boues d'épuration utilisées comme amendements agricoles (épandues sur les champs)[26] - [27], d'où il peut polluer les sols (en dégradant leur activité microbienne et auto-épuratrice[28]) et l'environnement (il se dégrade lentement, et notamment en méthyl-triclosan[26]). En présence de triclosan dans le sol à raison de 4 mg/kg de sol, les populations microbiennes cultivables recherchées en laboratoire étaient 22 fois plus faibles, et ces échantillons se trouvaient fortement enrichis en souches de pseudomonas devenues résistantes au triclosan (les pseudomonas sont des microbes pouvant être sources de maladies et maladies émergentes pour l'homme et les plantes[29] ainsi que de maladies nosocomiales). Le fait de le trouver dans les boues prouve que le traitement biologique ou les traitements chimiques complémentaires ne suffisent pas à le détruire dans les stations d'épuration. En réalité, il inhibe même le bon fonctionnement des stations à boue activée.
Toxicologie
Cancérigène potentiel
La réaction du triclosan avec le chlore libre contenu dans l'eau du robinet est susceptible de produire du chloroforme, classé cancérigène potentiel 2B par l'IARC[9].
Le triclosan est aussi suspecté d’être contaminé par des dioxines. Des dioxines se forment quand le triclosan se dégrade avec le chlore contenu dans l'eau du robinet et la lumière[30]. Cette dégradation forme des intermédiaires, tels le 2,4-dichlorophénol, qui se transforment ensuite en dioxines par exposition aux rayons ultraviolets. Bien que de petites quantités de dioxines soient produites, elles sont extrêmement toxiques et deviennent des perturbateurs endocriniens. Elles sont stables dans le corps donc peuvent ainsi s'accumuler (bioaccumulation) et atteindre des taux dangereux pour la santé.
Perturbateur endocrinien
En 2018, le triclosan est reconnu comme faisant partie des perturbateurs endocriniens[7] pouvant affecter l'homéostasie des hormones thyroïdiennes et affecter le neurodéveloppement de l'enfant (affectant notamment le quotient intellectuel si l'embryon ou le jeune enfant a été exposé à une certaine période de son développement ; au moment de l'accouchement et vers l'âge de deux ans ; lors d'un test de QI passé à l'âge de huit ans, on enregistre alors une baisse significative des scores de l'Indice de raisonnement perceptuel)[31].
Il est suspecté, à partir d'une concentration encore méconnue, de bloquer la fabrication d'œstrogène, ce qui peut s'avérer particulièrement dangereux pour la femme enceinte, le développement cérébral et l'oxygénation du fœtus[32].
Ses effets ont aussi été observés chez les amphibiens (Rana catesbeiana, Xenopus laevis). Il a montré une toxicité chronique et aiguë chez les espèces aquatiques. En outre, le triclosan est bioaccumulatif[33].
Ce produit interfère négativement avec la thyroxine chez le rat de laboratoire ayant été exposé au triclosan in utero[34] et on suspecte qu'il en est de même chez l'homme[35] ; une hypothèse est que le triclosan bloquerait le métabolisme hormonal de la thyroïde parce qu'il mime ces hormones et prendrait leur place sur les récepteurs hormonaux, les hormones thyroïdiennes ne pouvant plus s'y fixer[35]. Une étude faite de 2003 à 2006 a démontré que le triclosan (en tant que perturbateur endocrinien) affecte le système immunitaire[7] et entraîne une aggravation des allergies et rhinites allergiques[36]. Une autre étude de 2000 montre que de petites doses peuvent être absorbées par la peau et passer dans le sang[37].
Altération de l'activité du récepteur cellulaire RyR1 et des courants calciques
Les antiseptiques de type carbanilide, dont le triclosan, avaient déjà montré une action in vitro sur le récepteur 1 de la ryanodine (RyR1) et la mobilisation des ions calciques[38]. L'inhibition des courants calciques est confirmée in vivo dans les cellules musculaires striées et myocardiques des souris de laboratoire[39]. Ces études annoncent la réévaluation de la balance bénéfice-risque du triclosan chez l'être humain[40]. Différents polychlorobiphényles (PCB) similaires au triclosan ont montré une interaction avec RyR1 et RyR2 ; les récepteurs de ryanodine qui sont responsables du mécanisme de relâche des ions Ca2+ depuis le réticulum sarcoplasmique dans les tissus musculaires (muscle lisse et muscle strié)[41]. Le triclosan perturbe le système de réponse musculaire lors de l'envoi d'impulsions nerveuses dans les muscles cardiaques et striés chez la souris[42]. Une analyse approfondie de l’université du Michigan de la santé publique indique que de simples savons sans triclosan sont aussi efficaces contre les bactéries et pour prévenir de maladies potentielles quand on se lave les mains[43].
Substance allergénisante
Son usage a été associé à un risque plus élevé d'allergie alimentaire[44], peut-être simplement en raison du fait que l'exposition à une grande diversité de bactéries réduit les allergies, comme le prédit l'hypothèse d'hygiène, et non pas en raison d'une allergénicité intrinsèque (Un effet similaire est observé pour le gluconate de chlorhexidine et le PCMX, parmi d'autres agents antibactériens[45] - [46]
D'autres études ont cependant lié le triclosan à des dermatite de contact allergique[47] - [48].
En 2013, à certaines concentrations, il a été associé à un risque de sensibilisation allergique (aux allergènes inhalés et saisonniers notamment, et plutôt qu'aux allergènes alimentaires[49]).
Effet pro-inflammatoire et perturbateur du microbiote intestinal
Selon une étude sino-américaine récente ()[8] - [50] effectuée sur des souris, le triclosan pourrait également perturber le microbiote intestinal et avoir un effet pro-inflammatoire. Chez la souris exposée à des doses faibles (mais similaires à celles auxquelles les humains sont exposés), il aggrave les maladies inflammatoires de l’intestin chez les individus sensibles, et accroit la vitesse de prolifération cellulaire de cellules cancéreuses, pouvant ainsi favoriser le cancer du côlon[8] - [4].
Après des études sur le modèle murin, la communauté scientifique veut à partir de 2018 ré-évaluer les effets du triclosan chez l'humain, dont chez les personnes souffrant de maladies inflammatoires intestinales, et chez celles déjà touchées par un cancer du côlon.
Écotoxicologie
Évacué dans les urines puis largement dispersé avec les eaux usées, le triclosan est retrouvé dans l'environnement où il contamine le réseau trophique (chaîne alimentaire).
Les eaux marines et les mammifères marins ne sont pas épargnées ; le triclosan est par exemple retrouvé dans l'organisme de dauphins vivant au large de la Caroline du Sud et de la Floride en concentration suffisante pour perturber le système endocrinien, la croissance et le développement de ces animaux[51].
Au début du XXIe siècle, il est notamment retrouvé en Suède dans la bile de poissons vivant en aval d'effluents d'usines, tout comme dans le lait humain[52]. Les effets nocifs du triclosan sur l'environnement et la remise en question de sa présence dans les dentifrices[53] ont conduit l'organisme suédois Naturskyddsföreningen[54] à recommander de ne pas utiliser les dentifrices contenant du triclosan[55].
Le lait maternel humain en contient fréquemment (62 échantillons de lait humain pris au hasard dans des banques de lait maternel de Californie et du Texas en contenaient de 0 à 2 100 μg/kg de lipides[56]).
En 2009, on démontre que l'exposition au triclosan affecte significativement la concentration hormonale thyroïdienne chez de jeunes rats mâles[57].
En 2018, il est démontré être un perturbateur endocrinien chez des juvéniles de carpes communes mâles Cyprinus carpio[58], de même chez les femelles[59]).
Cette même année, Catherine Baron montre aussi expérimentalement qu'il inhibe le développement embryonnaire d'oursins (Arbacia punctulata) exposés à des taux de 0 %, 0,01 %, 0,1 %, 1 %, 1,7 % d'Irgasan[60]. Après dix-sept heures d'exposition les embryons, surtout aux concentrations les plus élevées, sont affectés : décolorés, difformes et ayant une croissance ralentie.
Kim et al. montrent que chez le poisson zèbre (Danio rerio) ce produit inhibe la croissance des axones lors du développement neuronal et modifie la morphologie crânais-faciale de l'animal[10] ; c'est la première étude qui montre un neurotoxicité pour ce produit.
Développement de la résistance microbienne
Comme la plupart des antibiotiques et biocides très utilisé, le triclosan a beaucoup contribué et contribue encore au développement de souches bactériennes plus antibiorésistantes. C'est même le biocide qui a suscité le plus grand nombre d’études sur la résistance aux antimicrobiens, et notamment sur les mécanismes d'apparition et de diffusion de l'antibiorésistance.
En , l'Association médicale canadienne a demandé au gouvernement canadien de bannir le triclosan des produits ménagers pour cette raison et parce qu'il est source de sous-produits dangereux tels le chloroforme[61] - [62].
Le Comité scientifique pour la sécurité des consommateurs (CSSC) a émis un rapport sur les dangers potentiels de la résistance aux antibiotiques causée par l'utilisation du triclosan[63]. Cependant, il est trop tôt pour dire si l’exposition au triclosan donne lieu à une résistance microbienne, car on ne dispose pas d’informations suffisantes pour faire une analyse exhaustive des risques[64].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC Press, 2014-2015, 95e éd., 2666 p. (ISBN 978-1-4822-08672), p. 428.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008).
- Haixia Yang et al. (2018), A common antimicrobial additive increases colonic inflammation and colitis-associated colon tumorigenesis in mice, Science Translational Medicine, 30 mai 2018, vol. 10, no 443, eaan4116.
- Catherine M. Cooney (2010), Personal care products : Triclosan Comes under Scrutiny, Environ Health Perspect, juin 2010, 118 (6), A242.
- EPA, Triclosan Facts, Washington, DC, U.S. Environmental Protection Agency, 2010 (consulté le 13 mai 2010).
- « Le Triclosan est soupçonné d'être un perturbateur endocrinien », RTS Info, RTS Un, Radio télévision suisse, (lire en ligne [vidéo]) « […] on en trouve dans les savons, les déodorants ou les cosmétiques. »
- « Le triclosan favoriserait les maladies inflammatoires de l’intestin », sur francetvinfo, (consulté le )
- « Triclosan », PAN Pesticides Database - Chemicals.
- Kim J. et al. (2018). Triclosan affects axon formation in the neural development stages of zebrafish embryos (Danio rerio), Environmental Pollution, 236, 304-312 (résumé).
- R.U. Halden et D.H. Paull, « Co-occurrence of triclocarban and triclosan in U.S. water resources », Environ Sci Technol., vol. 39, no 6, , p. 1420-1426
- « Triclosan », INERIS - Données technico-économiques sur les substances chimiques en France.
- « Since 1996, Scientific & Regulatory Consultants, Inc. (SRC) has offered scientific and regulatory strategies for biocidal and pesticidal products. Participation in industry trade associations and standard setting organizations has allowed our company to shape emerging issues and stay current on topics affecting our clients. Scientific and regulatory advice from SRC’s staff draws from a broad range of expertise including research, development, manufacturing, quality, and registration experience in the antimicrobial industry. Our staff also has extensive knowledge in chemistry, toxicology, and microbiology », source : Site internet de Scientific & Regulatory Consultants, Inc, consulté 2013-11-13.
- Jones RD, Jampani HB, Newman JL, Lee AS, « Triclosan : a review of effectiveness and safety in health care settings », Am. J. Infect. Control, vol. 28, no 2, , p. 184-96 (PMID 10760227)
- P.M. Tierno, « Efficacity of tricolsan », Am. J. Infect. Control, vol. 27, no 1, , p. 71-72; author reply 72-74 (PMID 9949382)
- Yazdankhah SP, Scheie AA, Høiby EA, Lunestad BT, Heir E, Fotland TØ, Naterstad K, Kruse H., « Triclosan and antimicrobial resistance in bacteria: an overview », Microb Drug Resist., vol. 12, no 2, , p. 83-90 (PMID 16922622)
- L. Birosová et M. Mikulásová, « Development of triclosan and antibiotic resistance in Salmonella enterica serovar Typhimurium », J. Med. Microbiol., vol. 58(Pt 4), , p. 436-441 (lire en ligne [PDF]).
- FDA issues final rule on safety and effectiveness of antibacterial soaps, FDA News Release, 2 septembre 2016.
- « Irgasan DP 300, Description, Triclosan », BASF, Home Care and I&I.
- Le 5-chloro-2-(2,4-dichlorophenoxy)phénol – vous connaissez ? sur le site Agence Science-Presse.
- E.N. Perencevich, M.T. Wong et A.D. Harris, « National and regional assessment of the antibacterial soap market: a step toward determining the impact of prevalent antibacterial soaps », Am. J. Infect. Control, vol. 29, no 5, , p. 281-283.
- « Les savons antibactériens sont-ils plus efficaces ? », sur Franceinfo, (consulté le )
- (en) M. S. Rhee, K. Lee, H. Moon et S. A. Kim, « Bactericidal effects of triclosan in soap both in vitro and in vivo », Journal of Antimicrobial Chemotherapy, vol. 70, no 12, , p. 3345–3352 (ISSN 0305-7453, DOI 10.1093/jac/dkv275, lire en ligne, consulté le )
- EWG (2008), Pesticide in Soap, Toothpaste and Breast Milk—Is It Kid-Safe ?, Washington, DC, Environmental Working Group (consulté 13 mai 2010).
- A.M. Calafat, X. Ye, L.-Y. Wong, J.A. Reidy et L.L. Needham, « Urinary concentrations of triclosan in the U.S. population: 2003-2004 », Environ Health Perspect, vol. 116, no 3, , p. 303-307 (lire en ligne [PDF]).
- E. Butler, M.J. Whelan, R. Sakrabani et R. van Egmond, « Fate of triclosan in field soils receiving sewage sludge. », Environ Pollut., vol. 167, , p. 101-109 (lire en ligne)
- H. Svenningsen, T. Henriksen, A. Priemé et A.R. Johnsen AR, « Triclosan affects the microbial community in simulated sewage-drain-field soil and slows down xenobiotic degradation », Environ Pollut., vol. 159, no 6, , p. 1599-1605 (lire en ligne)
- Butler E, Whelan MJ, Ritz K, Sakrabani R, van Egmond R., Environ. Toxicol. Chem., février 2011, 30 (2), 360-6.
- Par ex. Pseudomonas syringae.
- Buth, J.M., Steen, P.O., Sueper, C., Blumentritt, D., Vikesland, P.J., Arnold, W.A. et McNeill, K. (2010), Dioxin photoproducts of triclosan and its chlorinated derivatives in sediment cores, Environ. Sci. Technol., 44 (12), p. 4545–4551, DOI 10.1021/es1001105.
- Jackson-Browne, M. S., Papandonatos, G. D., Chen, A., Calafat, A. M., Yolton, K., Lanphear, B. P. et Braun, J. M. (2018), Identifying Vulnerable Periods of Neurotoxicity to Triclosan Exposure in Children, Environ Health Perspect, 126(5), 057001-057001.
- (en) Antibacterial agent could cause pregnancy problems
- (en) Jackson J, Sutton R. « Sources of endocrine-disrupting chemicals in urban wastewater, Oakland, CA » Sci Total Environ., 2008, 405 (1-3), 153-60, , DOI 10.10116/j.scitotenv.2008.06.033.
- (en) Paul K.B., Hedge J.M., Devito M.J. et Crofton K.M., « Developmental triclosan exposure decreases maternal and neonatal thyroxine in rats », Environ. Toxicol. Chem., 2010, 29 (12), 2840-4, , DOI 10.1002/etc.339.
- Paul KB, Hedge JM, Bansal R et al. (2012), Developmental triclosan exposure decreases maternal, fetal, and early neonatal thyroxine: a dynamic and kinetic evaluation of a putative mode-of-action. Toxicology ; 300:31–45
- (en) Erin M. Rees Clayton, Megan Todd, Jennifer Beam Dowd, Allison E. Aiello, « The Impact of Bisphenol A and Triclosan on Immune Parameters in the U.S. Population, NHANES 2003–2006 », Environ Health Perspect, vol. 119, no 3, , p. 390-6 (PMID 21062687, PMCID PMC3060004, DOI 10.1289/ehp.1002883)
- (en) Moss T, Howes D, Williams FM, « Percutaneous penetration and dermal metabolism of triclosan (2,4, 4'-trichloro-2'-hydroxydiphenyl ether) », Food Chem Toxicol, vol. 38, no 4, , p. 361-70. (PMID 10722890, DOI 10.1016/S0278-6915(99)00164-7)
- (en) Ki Chang Ahn, Bin Zhao, Jiangang Chen, Gennady Cherednichenko, Enio Sanmarti, Michael S. Denison, Bill Lasley, Isaac N. Pessah, Dietmar Kültz, Daniel P.Y. Chang, Shirley J. Gee, Bruce D. Hammock, « In Vitro Biologic Activities of the Antimicrobials Triclocarban, Its Analogs, and Triclosan in Bioassay Screens: Receptor-Based Bioassay Screens », Environ Health Perspect, vol. 116, no 9, , p. 1203-1210 (ISSN 0091-6765, PMID 18795164, DOI 10.1289/ehp.11200, lire en ligne, consulté le )
- (en) Gennady Cherednichenko, Rui Zhang, Roger A. Bannister, Valeriy Timofeyev, Ning Li, Erika B. Fritsch, Wei Feng, Genaro C. Barrientos, Nils H. Schebb, Bruce D. Hammock, Kurt G. Beam, Nipavan Chiamvimonvat, Isaac N. Pessah, « Triclosan impairs excitation–contraction coupling and Ca2+ dynamics in striated muscle », Proceedings of the National Academy of Sciences, (ISSN 0027-8424 et 1091-6490, PMID 22891308, DOI 10.1073/pnas.1211314109, lire en ligne, consulté le )>
- AFP, « Le triclosan, un antibactérien qui ferait plus de mal que de bien », sur google.com/hostednews/afp, (consulté le ) : « D'autres études animales effectuées ces dernières années sur le triclosan ont avancé, outre son effet sur le fonctionnement de la thyroïde, un risque augmenté d'allergie et de développement d'une résistance à certains antibiotiques, conduisant l'agence américaine du médicament (FDA) et l'agence américaine de protection de l'environnement (EPA) à réévaluer les risques de ce composant. »
- (en) Pessah IN, et al., « Structure-activity relationship for noncoplanar polychlorinated biphenyl congeners toward the rynodine receptor-Ca2+ channel complex type 1 (RyR1) », Chem. Res. Toxicol., vol. 19, , p. 92–101 (DOI 10.1021/tx050196m)
- (en) G. Cherednichenko, R. Zhang, R. A. Bannister, V. Timofeyev, N. Li, E. B. Fritsch, W. Feng, G. C. Barrientos et N. H. Schebb, « Triclosan impairs excitation-contraction coupling and Ca2+ dynamics in striated muscle », Proceedings of the National Academy of Sciences, (DOI 10.1073/pnas.1211314109).
- (en) « Plain soap as effective as antibacterial but without the risk » (consulté le )
- Sicherer, Scott H. et Leung, Donald Y.M. (2013), Advances in allergic skin disease, anaphylaxis, and hypersensitivity reactions to foods, drugs, and insects in 2012, Journal of Allergy and Clinical Immunology, 131 (1), 55–66, DOI 10.1016/j.jaci.2012.11.007, .
- Clayton, Erin M. Rees ; Todd, Megan ; Dowd, Jennifer Beam et Aiello, Allison E. (2010), The Impact of Bisphenol a and Triclosan on Immune Parameters in the U.S. Population, NHANES 2003–2006, Environ Health Perspect, 119 (3), 390–96, DOI 10.1289/ehp.1002883, PMC 3060004, accès libre, . Lay summary – ScienceDaily (30 novembre 2010).
- Fulton, April (29 novembre 2010), New Questions Raised On Chemicals In Soaps, Plastics, NPR (consulté le ).
- Bhutani, Tina et Jacob, Sharon E. (2009), Triclosan, Dermatologic Surgery, 35 (5), 888–89, DOI 10.1111/j.1524-4725.2009.01151.x, .
- Aller Campbell, Lauren ; Zirwas, Matthew J. et Mowad, Christen M. (2006), Triclosan, Dermatitis, 17 (4), 204–07, DOI 10.2310/6620.2006.06014, .
- Bertelsen, R. J. ; Longnecker, M. P. ; Løvik, M. ; Calafat, A. M. ; Carlsen, K-H. ; London, S. J. et Lødrup Carlsen, K.C. (2013), Triclosan exposure and allergic sensitization in Norwegian children, Allergy, 68 (1), 84–91, DOI 10.1111/all.12058, PMC 3515701, accès libre, .
- (en) Haixia Yang1,2,*, Weicang Wang1,*, Kymberleigh A. Romano3, Min Gu1, Katherine Z. Sanidad1,4, Daeyoung Kim5, Jun Yang6, « A common antimicrobial additive increases colonic inflammation and colitis-associated colon tumorigenesis in mice », Science Translational Medicine, (lire en ligne)
- (en) « Germ-killing chemical from soaps, toothpaste building up in dolphins », (consulté le )
- (en) Adolfsson-Erici M., Pettersson M., Parkkonen J. et Sturve J., « Triclosan, a commonly used bactericide found in human milk and in the aquatic environment in Sweden », Chemosphere, vol. 46, nos 9–10, , p. 1485–1489 (PMID 12002480, DOI 10.1016/S0045-6535(01)00255-7)
- (se) Edvardsson S., Burman L.G., AdolfssonErici M. et Bäckman N., « Risker och nytta med triklosan i tandkräm », Tandläkartidningen, vol. 97, no 10, , p. 58–64 (lire en ligne).
- http://www.naturskyddsforeningen.se/ Naturskyddsforeningen
- (sv) Beware of Triclosan in toothpaste, sur naturskyddsforeningen.se.
- Dayan A.D. (2007), Risk assessment of triclosan [Irgasan] in human breast milk, Food and Chemical Toxicology, 45(1), 125-129 (résumé).
- (en) L. M. Zorrilla, E. K. Gibson, S. C. Jeffay, K. M. Crofton, W. R. Setzer, R. L. Cooper et T. E. Stoker, « The Effects of Triclosan on Puberty and Thyroid Hormones in Male Wistar Rats », Toxicological Sciences, vol. 107, no 1, , p. 56–64 (PMID 18940961, DOI 10.1093/toxsci/kfn225)
- Wang, F., Liu, F., Chen, W., Xu, R. et Wang, W. (2018), Effects of triclosan (TCS) on hormonal balance and genes of hypothalamus-pituitary-gonad axis of juvenile male Yellow River carp (Cyprinus carpio), Chemosphere, 193, 695-701 (résumé).
- Fan Wanga et al. (2017), Toxicology and Applied Pharmacology Effects of triclosan on hormones and reproductive axis in female Yellow River carp (Cyprinus carpio): Potential mechanisms underlying estrogen effect, DOI 10.1016/j.taap.2017.10.005 (résumé).
- Barron C. (2018), The Effect of Irgasan of the embryonic development of Arbacia punctulata.
- (en) Jeniffer Yang, « Experts concerned about dangers of antibacterial products », Globe and Mail, (lire en ligne, consulté le )
- Fiss, E. M. ; Rule, K. L. et Vikesland, P. J., Formation of Chloroform and Other Chlorinated Byproducts by Chlorination of Triclosan-Containing Antibacterial Products, Environ. Sci. Technol., 2007, 41, 2387-2394.
- http://ec.europa.eu/health/scientific_committees/consumer_safety/docs/sccs_o_023.pdf
- Triclosan et la résistance aux antibiotiques résumé par GreenFacts de ce rapport scientifique du Comité scientifique pour la sécurité des consommateurs de la Commission européenne(CSSC)
Voir aussi
Articles connexes
Bibliographie
- Dayan, A. D. (2007), Risk assessment of triclosan [Irgasan] in human breast milk, Food and Chemical Toxicology, 45 (1), 125-129 (résumé).
- Kumar V., Chakraborty A., Kural M.R. et Roy P. (2009), Alteration of testicular steroidogenesis and histopathology of reproductive system in male rats treated with triclosan, Reproductive Toxicology, , 27 (2), 177-185 (résumé)
- Kumar V., Balomajumder C. et Roy P. (2008), Disruption of LH-induced testosterone biosynthesis in testicular Leydig cells by triclosan: probable mechanism of action, Toxicology, 4 septembre 2008, 250 (2-3), 124-31. Epub 9 juillet 2008 (résumé)
- Leah M. Zorrilla, Emily K. Gibson, Susan C. Jeffay, Kevin M. Crofton, Woodrow R. Setzer, Ralph L. Cooper and Tammy E. Stoker (2009), The Effects of Triclosan on Puberty and Thyroid Hormones in Male Wistar Rats, Toxicological Sciences (2009), 107 (1), 56-64 (résumé)
- Tammy E. Stoker, Emily K. Gibson et Leah M. Zorrilla (2010), Triclosan Exposure Modulates Estrogen-Dependent Responses in the Female Wistar Rat, Toxicol. Sci. (2010) 117 (1), 45-53 (résumé)
- Gennady Cherednichenko, Rui Zhang, Roger A. Bannister, Valeriy Timofeyev, Ning Li, Erika B. Fritsch, Wei Feng, Genaro C. Barrientos, Nils H. Schebb, Bruce D. Hammock, Kurt G. Beam, Nipavan Chiamvimonvat et Isaac N. Pessah, (2012), Triclosan impairs excitation-contraction coupling and Ca2+ dynamics in striated muscle, Proc. Natl. Acad. Sci., États-Unis, 109 (35), 14158-14163 (résumé)
- Katie B. Paul, Joan M. Hedge, Michael J. DeVito et Kevin M. Crofton (2010), Short-term Exposure to Triclosan Decreases Thyroxine In Vivo via Upregulation of Hepatic Catabolism in Young Long-Evans Rats, Toxicol. Sci., 113 (2), 367-379 (résumé)
- Heath R.J. et Rock C.O. (2000), A triclosan-resistant bacterial enzyme, Nature, 13 juillet 2000, 406 (6792), 145-6.
- FDA (2010), Triclosan: What Consumers Should Know, Washington, DC: U.S. Food and Drug Administration ; consulté le
- SCCS, Request for a Scientific Opinion: Triclosan (CAS 3380-34-5) (EINECS 222-182-2), Supplement I (P32) Brussels : Scientific Committee on Consumer Safety (consulté ).